Cuando una sustancia cambia de fase, es decir, pasa de sólido a líquido o de líquido a gas, la energía, requiere energía para hacerlo. La energía potencial almacenada en las fuerzas interatómicas entre las moléculas necesita ser vencida por la energía cinética el movimiento de las partículas antes de que la sustancia pueda cambiar de fase.
Si medimos la temperatura de la sustancia que es inicialmente sólida a medida que la calentamos producimos un gráfico como el de la figura 1.
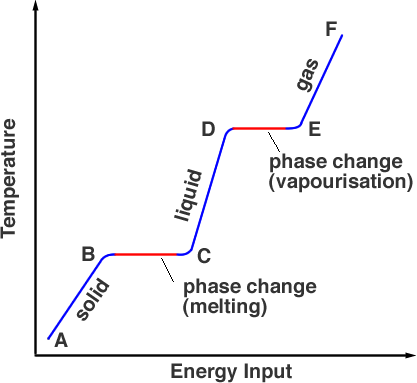
A partir de un punto A, la sustancia se encuentra en su fase sólida, al calentarla se eleva la temperatura hasta su punto de fusión, pero el material sigue siendo un sólido en el punto B. A medida que se calienta más, la energía de la fuente de calor pasa a romper los enlaces que mantienen a los átomos en su lugar. Esto ocurre de B a C. En el punto C toda la fase sólida se ha transformado en fase líquida. Una vez más, a medida que se añade energía, ésta se destina a la energía cinética de las partículas, aumentando la temperatura (de C a D). En el punto D la temperatura ha alcanzado su punto de ebullición pero todavía está en fase líquida. De los puntos D a E la energía térmica está superando los enlaces y las partículas tienen suficiente energía cinética para escapar del líquido. La sustancia entra en la fase gaseosa. Más allá de E, un mayor calentamiento bajo presión puede elevar aún más la temperatura es como funciona una olla a presión.
Calor latente de fusión y vaporización
La energía necesaria para cambiar la fase de una sustancia se conoce como calor latente. La palabra latente significa oculto. Cuando el cambio de fase es de sólido a líquido debemos utilizar el calor latente de fusión, y cuando el cambio de fase es de líquido a gas, debemos utilizar el calor latente de vaporización.
La energía requerida es Q= m L, donde m es la masa de la sustancia y L es el calor latente específico de fusión o vaporización que mide la energía calorífica para cambiar 1 kg de un sólido a un líquido.
La tabla 1. muestra el
| Sustancia | Calor latente específico de fusión kJ.kg-1 |
°C | Calor latente específico de vaporización kJ.kg-1 |
°C |
|---|---|---|---|---|
| Agua | 334 | 0 | 2258 | 100 |
| Etanol | 109 | -114 | 838 | 78 |
| Ácido etanoico | 192 | 17 | 395 | 118 |
| Cloroformo | 74 | -64 | 254 | 62 |
| Mercurio | 11 | -39 | 294 | 357 |
| Azufre | 54 | 115 | 1406 | 445 |
| Hidrógeno | 60 | -259 | 449 | -253 |
| Oxígeno | 14 | -219 | 213 | -183 |
| Nitrógeno | 25 | -210 | 199 | -196 |
Tubos de calor
A medida que aumenta la densidad de transitores en un microprocesador, la cantidad de calor disipado aumenta. Un procesador Pentium 4 (180 nm a 2 GHz) disipa 55 vatios de energía en forma de calor. Su superficie es de sólo 131 mm2. Esto supone 55 W/(131/(102)) = 42 W cm-2. En comparación, una plancha de vapor tiene 5 Wcm-2.
Una solución es el tubo de calor. Como su nombre indica, transfiere el calor de las regiones de alta temperatura a las de baja temperatura, donde hay más espacio para los disipadores de calor o los ventiladores de refrigeración.
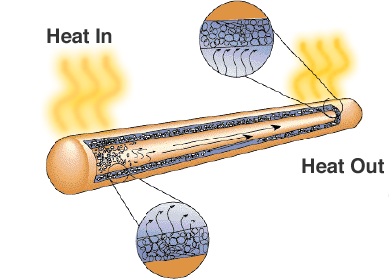
Aunque sólo parece un tubo metálico sellado, hay una mecha o material poroso y un líquido con un alto calor latente de vaporización. Cuando el tubo se calienta, el líquido utiliza el calor para evaporarse y se convierte en gas, el gas se desplaza a una zona más fría del tubo de calor donde se condensa y utiliza el calor latente para volver a convertirse en líquido. Los tubos de calor son una solución fiable y rentable para los ordenadores portátiles en los que los ventiladores reducirían la duración de la batería.