Považte obecnou nukleofilní substituční reakci.
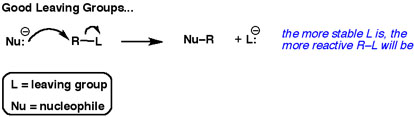
Druhá šipka vždy ukazuje pár elektronů směřující k odcházející skupině.
Nejlepší odcházející skupiny tyto elektrony „chtějí“. Nechtějí se o ně dělit s jinými atomy.
Dobré odcházející skupiny jsou slabé báze.
Slabé báze mají silné konjugované kyseliny. Slabé báze tedy můžeme identifikovat podle tabulky #“p „K_“a „#.
Pozor: Hodnota #“p „K_“a „# měří polohu rovnováhy. Schopnost opustit skupinu je však založena na reakčních rychlostech. Takže i když je korelace dobrá, není dokonalá.

Všeobecně platí, že čím slabší je báze, tím lepší je odcházející skupina.
Výjimka:
F- je malý iont. Jeho vysoká hustota náboje ho činí relativně nepolarizovatelným. Opouštějící skupina musí být polarizovatelná, aby se snížila energie přechodného stavu. V reakci #“S“_“N „2# byste nikdy neměli vidět odcházející F-.
Otázka: Proč je voda dobrou odcházející skupinou?
Odpověď#color(white)(ll)#: Není! Hydroniový iont je odcházející skupinou.
Vysvětlení:
Považte rovnováhu
#“R-OH ⇌ R“^“+“ + podbraz(„OH“^“-„)_color(red)(„konj. báze H“_2 „O“)#
Voda je slabá kyselina, takže hydroxidový iont je silná báze. „Chce“ využít svůj osamělý elektronový pár k vytvoření kovalentní vazby.
Poloha rovnováhy tedy leží daleko vlevo.
Pokud alkohol protonujeme, dostaneme
#“R-„stackrelcolor(blue)(+)(„O“) „H“_2 ⇌“R“^“+“ + underbrace(„OH“_2)_color(red)(„konj. báze H“_3 „O“^“+“)#
Voda je konjugovanou bází hydroniového iontu, nejsilnější kyseliny, která může ve vodě existovat.
Má malou tendenci sdílet své elektronové páry s jiným druhem.
Voda ve formě hydroniového iontu je výbornou opouštějící skupinou.
Tady je video o tom, co dělá dobrou opouštějící skupinu.