Úvod
Neutrofily jsou nejpočetnější populací cirkulujících bílých krvinek a první linií obrany hostitele proti napadení patogeny . Za normálních podmínek mají cirkulující neutrofily poločas rozpadu 6-12 h a jsou funkčně klidné. Během zánětu neutrofily rychle přicházejí do míst infekce a poranění, zvyšují antimikrobiální aktivitu a odumírají v infiltrované tkáni . Hrají důležitou roli ve vrozeném imunitním systému a významné reakce neutrofilů jsou pozorovány při systémových zánětech, jako je trauma, popáleniny, sepse a velké chirurgické zákroky .
Dysregulace reakcí neutrofilů, jako je nadměrné nebo nekontrolované uvolňování prozánětlivých cytokinů, však může způsobit poškození tkání nebo orgánů hostitele při těžké sepsi a autoimunitních onemocněních .
Terapie odstraňováním leukocytů (LRT), leukocytaferéza (LCAP) nebo aferéza granulocytů/monocytů (GMA) je metoda terapeutické aferézy, která odstraňuje periferní leukocyty prostřednictvím mimotělního oběhu. Používá se jako nefarmakologická léčba ulcerózní kolitidy (UC) a Crohnovy choroby (CD) a vykazuje vynikající krátkodobou účinnost .
LCAP s použitím Cellsorby, kolony z polyethylen-teftalátových vláken (Asahi-Kasei Medical, Tokio, Japonsko), údajně odstraňuje ~ 100 % granulocytů/monocytů, ~ 60 % lymfocytů a ~ 50 % trombocytů ze vstupu i výstupu přístroje Cellsorba . Ačkoli přesné mechanismy LRT nebyly plně prozkoumány, byly popsány jejich potenciální mechanismy, které zahrnují snížení počtu aktivovaných leukocytů nebo prozánětlivých cytokinů, jako je tumor nekrotizující faktor (TNF)-α, interleukin (IL)-1β, IL-6 a IL-8 .
Infekce v místě operace (SSI) zůstává jednou z nejčastějších příčin morbidity při velkých chirurgických zákrocích, která prodlužuje hospitalizaci a zvyšuje náklady na léčbu . Japonské prospektivní multicentrické sledování ukázalo, že u 19,5 % pacientů s UC se po operaci vyvinula SSI .
Ve studii případů a kontrol jsme retrospektivně porovnávali výskyt SSI mezi pacienty podstupujícími proktokolektomii s ileální pouch-anální anastomózou (IPAA) (n=29) a pacienty podstupujícími IPAA s pooperační LCAP (n=43). Pooperační LCAP významně snížil výskyt SSI u pacientů s UC podstupujících proktokolektomii s IPAA (p<0,01) . V multicentrické prospektivní studii, kterou jsme provedli, byl porovnáván výskyt SSI mezi pacienty s UC podstupujícími operaci (kontrolní skupina; n=103) a pacienty podstupujícími operaci s pooperačním LCAP (n=40). SSI se vyskytly u 4 z 37 pacientů (10,8 %) ve skupině s LCAP, zatímco v kontrolní skupině se vyskytly u 29 ze 103 pacientů (28,2 %), ačkoli rozdíl nedosáhl statistické významnosti (p=0,069) .
Tato klinická pozorování naznačují, že LCAP odstraňuje aktivované leukocyty produkující prozánětlivé cytokiny při pooperačním systémovém zánětu způsobeném velkou kolorektální operací a může potlačit výskyt SSI. Zaznamenali jsme souvislost mezi dysfunkcí neutrofilů a pooperačními infekčními komplikacemi .
Neutrofily jsou nejhojnějšími buňkami mezi cirkulujícími leukocyty a mohou být nejčastěji odstraněny pomocí LCAP . Proto jsme se zaměřili na funkce cirkulujících neutrofilů izolovaných před a po LCAP, abychom objasnili terapeutické mechanismy pooperační LCAP na výskyt SSI u pacientů s UC po operaci.
Materiál a metoda
Pacienti
Čtyřicet tři pacientů s UC podstupujících IPAA dostalo v letech 2004-2008 pooperační LCAP na oddělení gastrointestinální a dětské chirurgie Mie University Graduate School of Medicine. Diagnóza UC byla stanovena na základě klinických, radiografických, endoskopických, chirurgických a histopatologických údajů. Před operací pacienti dostávali různou medikamentózní léčbu včetně protizánětlivých léků (aminosalicyláty, kortikosteroidy) nebo imunosupresiv (azathioprin, merkaptopurin, cyklosporin), případně obojí. Pooperační LCAP byla provedena jednou do 2 hodin po operaci. Pacienti s klinickými příznaky sepse byli ze studie vyloučeni. Pacienti s nestabilní hemodynamikou po operaci byli podle protokolu rovněž vyloučeni. Před zahájením této studie byl od všech pacientů získán písemný informovaný souhlas, který byl proveden v souladu s Helsinskou deklarací a schválen Institucionální revizní komisí (č. 474).
Izolace neutrofilů
Před a po LCAP byly neutrofily izolovány od stejných pacientů před a po operaci. Izolace neutrofilů byla založena na dříve popsaném postupu . Vzorky krve (10 ml) byly zředěny stejným objemem fyziologického roztoku s fosfátovým pufrem (PBS), navrstveny na objem Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) a odstředěny při 600 × g po dobu 30 minut při pokojové teplotě. Po odstranění mononukleárních buněk, plazmy a Ficoll-Paque PLUS byla peleta resuspendována ve 12 ml roztoku chloridu amonného k lyzi červených krvinek, dvakrát promyta v PBS a resuspendována v PBS. Neutrofily byly dvakrát promyty PBS a resuspendovány v TCM-10 . Buněčné preparáty byly testovány na životaschopnost (>99 %) vyloučením trypanovou modří a na čistotu (>95 % CD13+, CD33+ granulocytů) pomocí průtokové cytometrie.
Fagocytární aktivita
Ex vivo byla porovnána fagocytární aktivita cirkulujících neutrofilů proti Escherichia coli mezi neutrofily před a po LCAP izolovanými od identických pacientů.
Fagocytóza neutrofilů byla měřena pomocí fluorescenčních biopartikulí . K opsonizaci bakteriálních biopartikulí bylo rekonstituované opsonizační činidlo a bakteriální biopartikule (5 × 105) smícháno, vortexováno a inkubováno po dobu 1 h při 37 °C ve zvlhčeném inkubátoru s 5 % CO2. Po dvou promytích PBS a separaci nízkorychlostní centrifugací (1500 × g, 15 min, 4 °C) byly pelety inkubovány s neutrofily (5 × 105) v 1 ml média bez antibiotik po dobu 3 h při 37 °C ve zvlhčeném inkubátoru s 5 % CO2. Po 3 h inkubaci byla fagocytární aktivita neutrofilů vůči E. coli analyzována pomocí přístroje FACScan (Becton-Dickinson, San Jose, CA, USA) a bylo spočítáno 10 000 událostí na jeden vzorek.
Příprava E. coli. coli
Escherichia coli (ATCC25922) byla zakoupena od American Type Culture Collection (Manassas, VA, USA) a kultivována v Dulbeccově modifikovaném médiu Eagle’s Medium (Invitrogen, Tokio, Japonsko) po dobu 10 hodin při 37 °C. Kultivační médium bylo odstředěno při 1 700 × g po dobu 10 minut při pokojové teplotě, aby se získala peleta, která byla dvakrát promyta a resuspendována ve sterilním fyziologickém roztoku. Alikvotní část (100 μl) suspenze byla sériově naředěna sterilním fyziologickým roztokem, nanesena na Agar-B (Qbiogene, Carlsbad, CA, USA) a inkubována po dobu 18 h pro stanovení koncentrace bakterií. Zbytek byl až do použití uchováván při -80 °C.
Kultura neutrofilů s E. coli
Těsně před použitím byla suspenze E. coli zředěna v médiu tak, aby bylo dosaženo konečné koncentrace 2,5 × 106 KTJ/ml. Po opsonizaci E. coli pomocí autologního séra po dobu 30 min při 37 °C byly neutrofily (2,5 × 105 /ml) kokultivovány v 1 ml média bez antibiotik po dobu 3 h při 37 °C ve zvlhčeném inkubátoru s 5 % CO2. Po odstředění buněk při 600 × g po dobu 10 min při 4 °C byl odebrán supernatant k analýze produkce cytokinů, neutrofilní elastázy (NE) a životaschopnosti neutrofilů.
Životaschopnost neutrofilů
Ex vivo životaschopnost cirkulujících neutrofilů proti E. coli byla porovnána mezi neutrofily izolovanými od identických pacientů před a po LCAP. K vyhodnocení životaschopnosti neutrofilů po společné kultivaci s E. coli byl proveden test apoptózy .
Apoptóza neutrofilů po společné kultivaci s E. coli byla kvantifikována průtokovou cytometrií pomocí soupravy Annexin V Apoptosis Detection Kit (BioVision Research Products, Palo Alto, CA, USA). Neutrofily byly inkubovány v 1X vazebném pufru, do kterého bylo přidáno 5 μl Annexin V-fluorescein isothiokyanátu (FITC) a 5 μl propidium jodidu (PI). Po inkubaci při pokojové teplotě po dobu 5 min ve tmě byly buňky analyzovány pomocí přístroje FACScan a bylo spočítáno 10 000 událostí na vzorek.
Kombinace Annexin V-FITC a PI byla schopna rozlišit časné apoptotické buňky (Annexin V+, PI-), nekrotické buňky (Annexin V-, PI+), pozdní apoptotické nebo sekundární nekrotické buňky (Annexin V+, PI+) a životaschopné buňky (Annexin V-, PI-).
Enzyme-linked immunosorbent assay (ELISA)
Cytokiny v séru pacientů před a po LCAP a v supernatantech po kokultivaci neutrofilů před a po LCAP s E. coli byly měřeny metodou ELISA podle návodu výrobce. Cytokiny zahrnovaly TNF-α, antagonistu receptoru IL-1 (IL-1Ra), IL-6, IL-8 a NE. Soupravy ELISA pro TNF-α, IL-1Ra, IL-6 a IL-8 byly zakoupeny od společnosti R&D Systems (Minneapolis, MN, USA). Souprava NE ELISA byla zakoupena od společnosti Immundiagnostik (Bensheim, Německo). Detekční limity TNF-α, IL-1Ra, IL-6, IL-8 a NE byly 1, 2, 0,01 a 2 pg/ml, resp. 0,12 ng/ml a hladiny pod těmito limity byly považovány za nedetekovatelné. Hladina každého cytokinu byla hodnocena ve dvou opakováních a byla vypočtena průměrná hodnota cytokinu.
Statistická analýza
Všechny statistické analýzy byly provedeny pomocí programu JMP verze 5 (SAS Institute, Cary, NC, USA). Asociace mezi spojitými a kategorickými proměnnými byly hodnoceny pomocí Mannova-Whitneyho U testu nebo případně párového t testu. P<0,05 bylo považováno za statisticky významné.
Výsledky
Harakteristika pacientů
Dvaceti devíti pacientům s UC, kteří podstoupili IPAA, byl po operaci aplikován LCAP. Charakteristiky pacientů jsou uvedeny v tabulce 1. Průměrný věk v době stanovení diagnózy byl 27 let (rozmezí 15-54 let) a průměrný věk v době operace byl 33 let (rozmezí 16-61 let). Doba trvání onemocnění byla 6,9 roku (rozmezí 0,1-28 let). Levostrannou kolitidu mělo 6/29 (21 %) pacientů a pankolitidu 23/29 (79 %) pacientů. závažnost onemocnění kolitidy byla klasifikována jako mírná (7; 24 %), středně závažná (11; 38 %) a závažná (4; 38 %).
| Charakteristika pacientů | |
|---|---|
| Proměnné | Pacienti (n=29) Počet |
| Pohlaví. | |
| Muži | 19 |
| Ženy | 10 |
| Věk při diagnóze | 27( 15-54) |
| Věk při operaci | 33(16-61) |
| Trvání nemoci | 6.9 (0.1-28) |
| Závažnost onemocnění | |
| mírná | 7 |
| střední | 11 |
| těžký | 4 |
| Rozsah onemocnění | |
| levý-kolitida | 6 |
| Pan- kolitida | 23 |
| Maltsův klasifikační systém | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Celková dávka steroidů (mg) | 17285 (800-.70000) |
| Použití imunosupresiv | |
| Ano | 5 |
| Ne | 24 |
| Doba operace (min) | 262.4 (118-496) |
| Krvní ztráta (ml) | 307,9 (17-826) |
Tabulka 1: Charakteristika pacientů.
Časový průběh změny počtu WBC, neutrofilů a trombocytů
WBC, neutrofily a trombocyty byly počítány před operací, před LCAP (po operaci), resp. po LCAP (do 12 hodin po LCAP). Jak ukazuje obrázek 1, počet WBC, neutrofilů a trombocytů byl po LCAP významně nižší než před LCAP. Všichni pacienti, kteří dostávali pooperační LCAP, neměli žádný hematologický nežádoucí účinek.
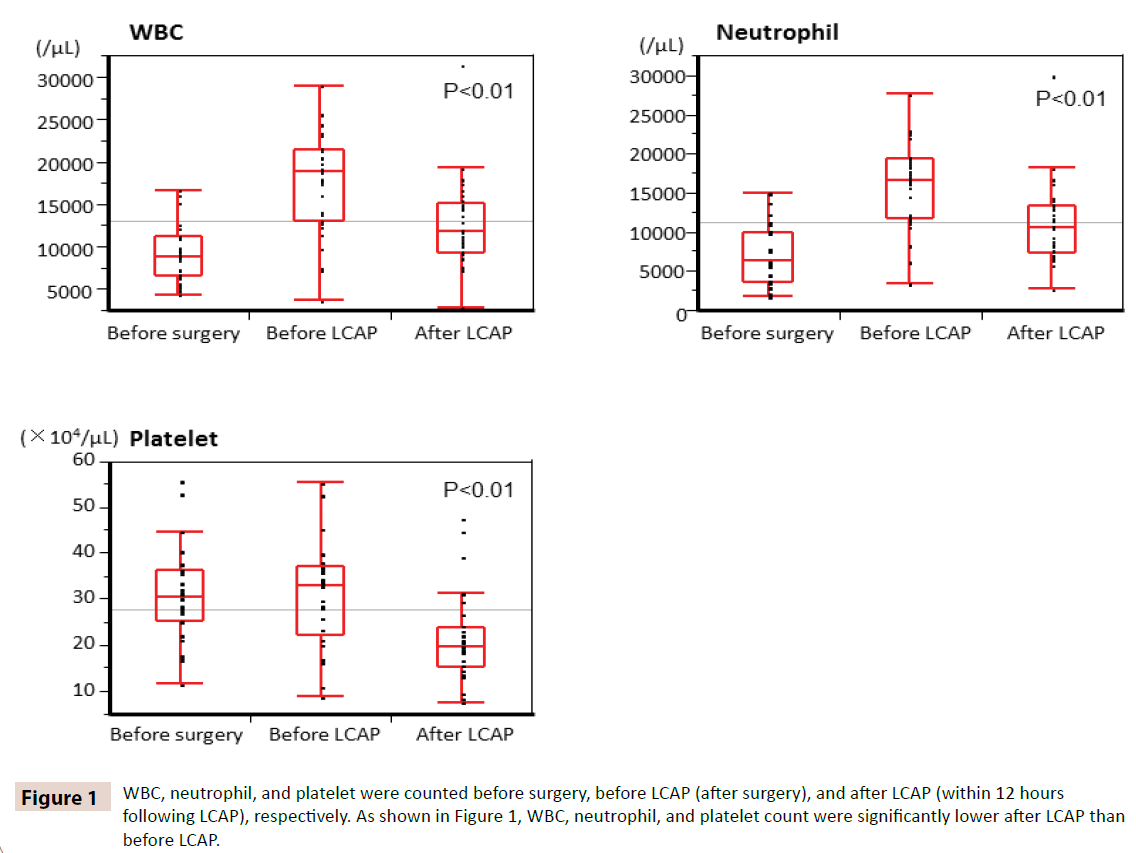
Obrázek 1: Počet WBC, neutrofilů a trombocytů byl počítán před operací, před LCAP (po operaci) a po LCAP (do 12 hodin po LCAP), v tomto pořadí. Jak ukazuje obrázek 1, počet WBC, neutrofilů a trombocytů byl po LCAP významně nižší než před LCAP.
Fagocytární aktivita neutrofilů vůči E. coli
Pro objasnění, zda LCAP ovlivňuje fagocytární aktivitu cirkulujících neutrofilů, byla porovnána fagocytární aktivita vůči E. coli mezi neutrofily před a po LCAP. Jak ukazuje obrázek 2, mezi neutrofily před LCAP (medián 1259,4, rozmezí 50,8-3505,6) a po LCAP (medián 1077,6, rozmezí 24,4-4152,1) nebyl pozorován žádný významný rozdíl ve fagocytární aktivitě neutrofilů (průměrná intenzita fluorescence) proti E. coli (P=0,72). Tyto výsledky naznačují, že LCAP neovlivňuje fagocytární aktivitu cirkulujících neutrofilů vůči E. coli.
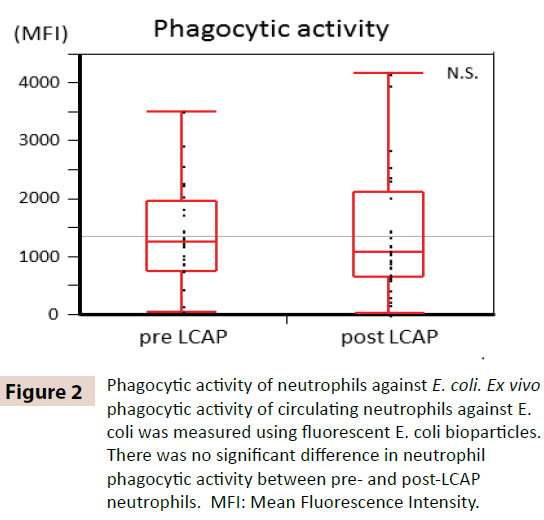
Obrázek 2: Fagocytární aktivita neutrofilů vůči E. coli. Fagocytární aktivita cirkulujících neutrofilů ex vivo proti E. coli byla měřena pomocí fluorescenčních biopartikul E. coli. Nebyl zjištěn žádný významný rozdíl ve fagocytární aktivitě neutrofilů mezi neutrofily před a po LCAP. MFI:
Životaschopnost neutrofilů po společné kultivaci s E. coli
Pro objasnění, zda LCAP ovlivňuje odpověď neutrofilů proti bakteriální infekci, byla porovnána životaschopnost neutrofilů proti E. coli mezi neutrofily před a po LCAP. Bylo porovnáno procento životaschopných buněk (Annexin V-, PI-), časných apoptotických buněk (Annexin V+, PI-), nekrotických buněk (Annexin V-, PI+) a pozdních apoptotických nebo sekundárních nekrotických buněk (Annexin V+, PI+) mezi neutrofily před a po LCAP. Jak ukazuje obrázek 3, medián procenta životaschopných neutrofilů kokulovaných s E. coli byl vyšší u post-LCAP (medián 34,2 %, rozmezí 1,16- 77,7 %) než u pre-LCAP (medián 27,9 %, rozmezí 0,53-89,7 %) neutrofilů, ačkoli rozdíl nedosáhl statistické významnosti(P=0,82). Procento nekrotických neutrofilů kokulovaných s E. coli bylo významně nižší u neutrofilů po LCAP (medián 0,73 %, rozmezí 0,0-26,0 %) než u neutrofilů před LCAP (medián 1,14 %, rozmezí 0,0-26,0 %) (P=0,0232).
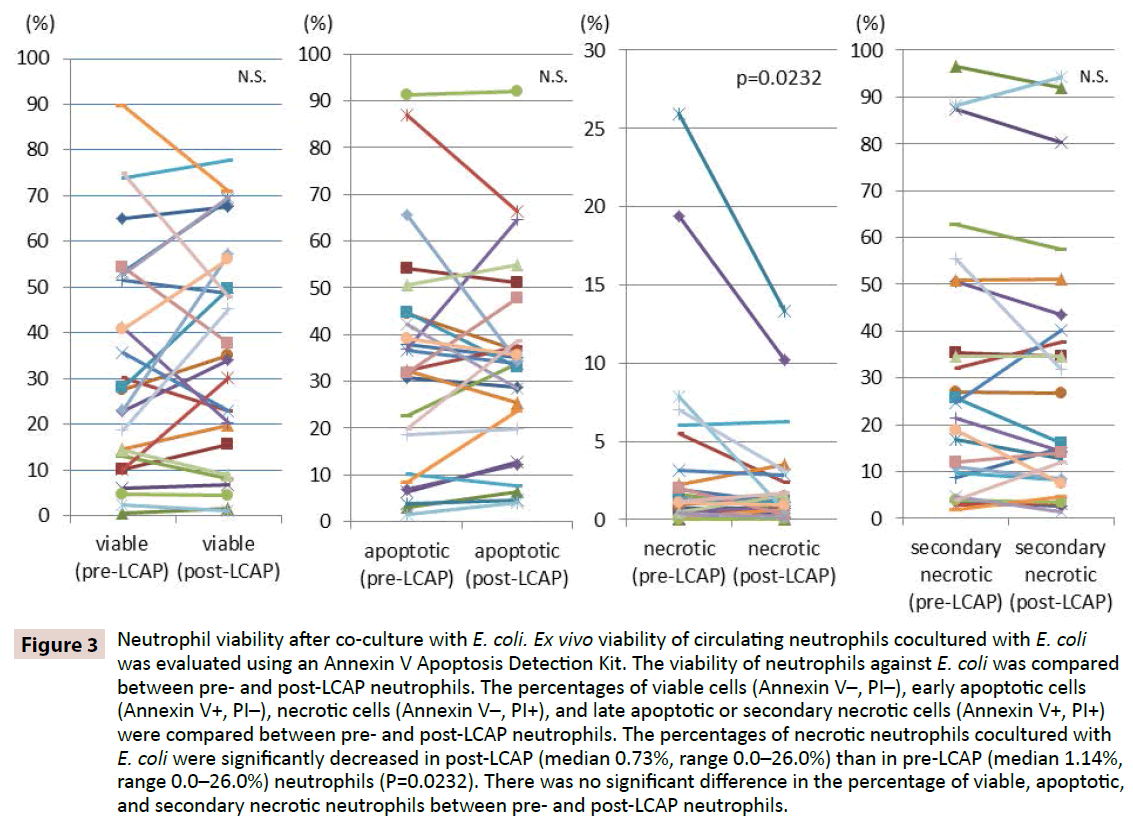
Obr. 3: Životaschopnost neutrofilů po kokultivaci s E. coli. Životaschopnost ex vivo cirkulujících neutrofilů kokultivovaných s E. coli byla hodnocena pomocí soupravy pro detekci apoptózy Annexin V. Životaschopnost neutrofilů proti E. coli byla porovnána mezi neutrofily před a po LCAP. Procento životaschopných buněk (Annexin V-, PI-), časných apoptotických buněk (Annexin V+, PI-), nekrotických buněk (Annexin V-, PI+) a pozdních apoptotických nebo sekundárně nekrotických buněk (Annexin V+, PI+) bylo porovnáno mezi neutrofily před a po LCAP. Procento nekrotických neutrofilů kokulovaných s E. coli bylo významně nižší u post-LCAP (medián 0,73 %, rozmezí 0,0-26,0 %) než u pre-LCAP (medián 1,14 %, rozmezí 0,0-26,0 %) neutrofilů (P=0,0232). Nebyl zjištěn žádný významný rozdíl v procentuálním zastoupení životaschopných, apoptotických a sekundárně nekrotických neutrofilů mezi neutrofily před a po LCAP.
Nebyl pozorován žádný významný rozdíl v procentuálním zastoupení apoptotických neutrofilů kokultivovaných s E. coli mezi neutrofily před LCAP (medián 32,3 %, rozmezí 1,51-91,2 %) a po LCAP (medián 33,8 %, rozmezí 4,0-92,1 %) (P=0,57). Mezi neutrofily před LCAP (medián 23,1 %, rozmezí 1,81-96,5 %) a po LCAP (medián 16,1 %, rozmezí 1,44-94,3 %) nebyl rovněž pozorován významný rozdíl v procentu pozdně apoptotických nebo sekundárně nekrotických neutrofilů kokulovaných s E. coli (P=0.13).
Tyto výsledky naznačují, že LCAP může snížit odlišnou podskupinu cirkulujících neutrofilů, které indukují nekrózu proti bakteriální infekci, a zvýšit počet životaschopných (pravděpodobně neprimovaných) neutrofilů v systémové cirkulaci.
Tvorba cytokinů neutrofily po kokultuře s E. coli
Pro objasnění, zda LCAP ovlivňuje produkci cytokinů cirkulujícími neutrofily, byly porovnány hladiny cytokinů v kultivačních supernatantech po kokultuře s E. coli mezi neutrofily před a po aplikaci LCAP. Jak ukazuje obrázek 4, v hladinách NE, TNF-α, IL-6, IL-8 a IL-1Ra v kultivačních supernatantech mezi neutrofily před a po LCAP nebyl zjištěn významný rozdíl. Tyto výsledky naznačují, že LCAP neovlivňuje produkci cytokinů cirkulujících neutrofilů proti E. coli.
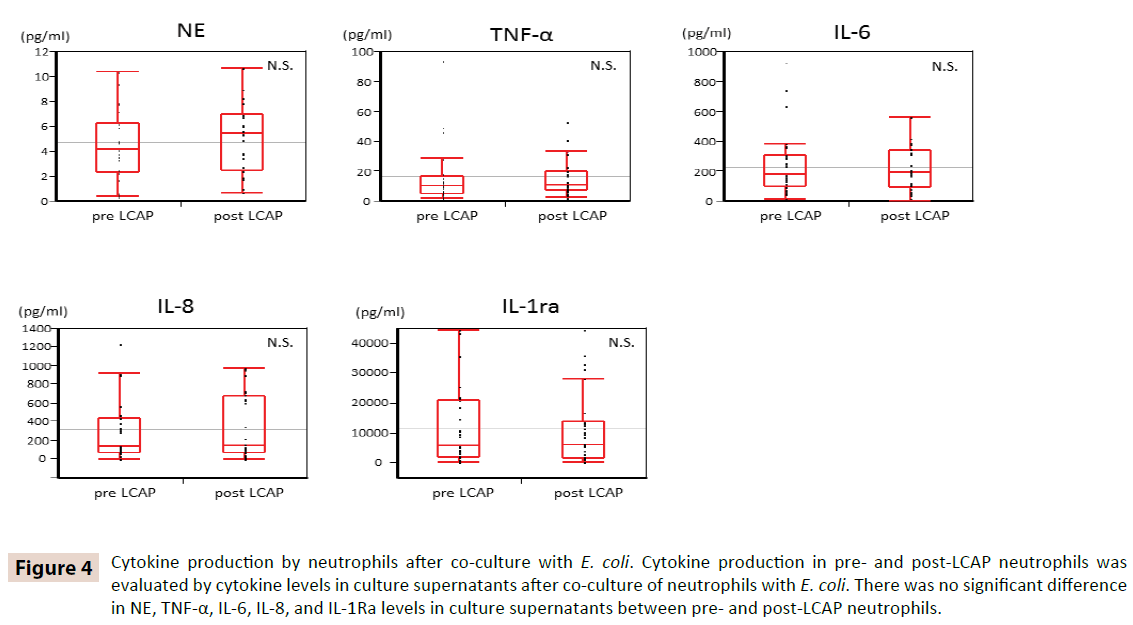
Obr. 4: Produkce cytokinů neutrofily po společné kultivaci s E. coli. Produkce cytokinů u neutrofilů před a po LCAP byla hodnocena podle hladin cytokinů v kultivačních supernatantech po společné kultivaci neutrofilů s E. coli. Nebyl zjištěn žádný významný rozdíl v hladinách NE, TNF-α, IL-6, IL-8 a IL-1Ra v kultivačních supernatantech mezi neutrofily před a po LCAP.
Sérové cytokiny před a po LCAP
Pro objasnění, zda LCAP ovlivňuje systémovou zánětlivou odpověď hostitele, byly měřeny sérové cytokiny pomocí vzorků krve odebraných před a po LCAP. Jak ukazuje obrázek 5, NE v séru po LCAP (medián 5,62 pg/ml, rozmezí 0,16-10,4 pg/ml) byl významně vyšší než před LCAP (medián 2,87 pg/ml, rozmezí 0,15-7,61 pg/ml) (P=0,0251). V sérových hladinách TNF-α, IL-6, IL-8 a IL-1Ra před a po LCAP nebyl zjištěn žádný významný rozdíl.
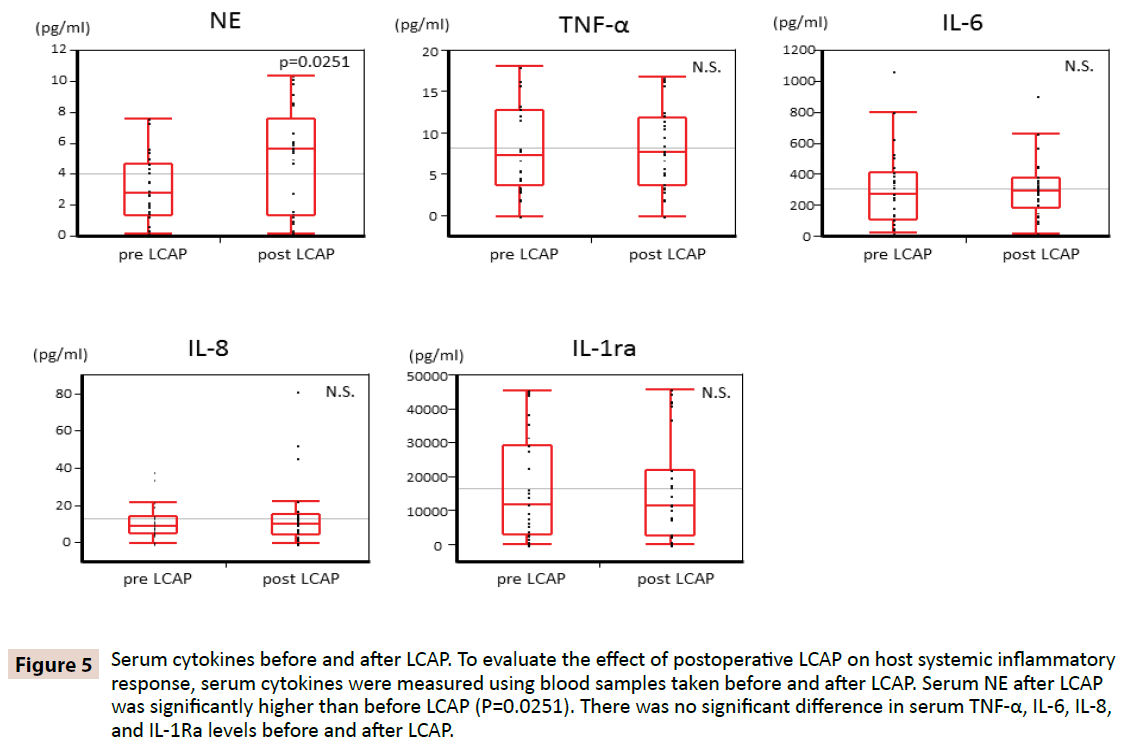
Obrázek 5: Sérové cytokiny před a po LCAP. K vyhodnocení vlivu pooperační LCAP na systémovou zánětlivou odpověď hostitele byly měřeny sérové cytokiny pomocí vzorků krve odebraných před a po LCAP. Sérové NE po LCAP byly významně vyšší než před LCAP (P=0,0251). V sérových hladinách TNF-α, IL-6, IL-8 a IL-1Ra před a po LCAP nebyl zjištěn významný rozdíl.
Souvislost funkcí neutrofilů po LCAP s operačním časem nebo počtem pooperačních neutrofilů
Pro objasnění, zda cirkulující funkce neutrofilů po LCAP ovlivňují výskyt SSI, jsme zkoumali souvislost mezi fagocytární aktivitou nebo produkcí cytokinů neutrofily po LCAP a rizikovými faktory SSI souvisejícími s chirurgickým stresem, jako je operační čas, krevní ztráta a počet pooperačních neutrofilů.
Jak ukazuje obrázek 6, NE v supernatantu po společné kultivaci post-LCAP neutrofilů s E. coli byl signifikantně vyšší u pacientů s operačním časem >3 h (medián 5,65 pg/ml, rozmezí 0,97-10 mld.7 pg/ml) než u pacientů s operačním časem <3 h (medián 1,05 pg/ml, rozmezí 0,72-2,44 pg/ml) (P=0,0158).
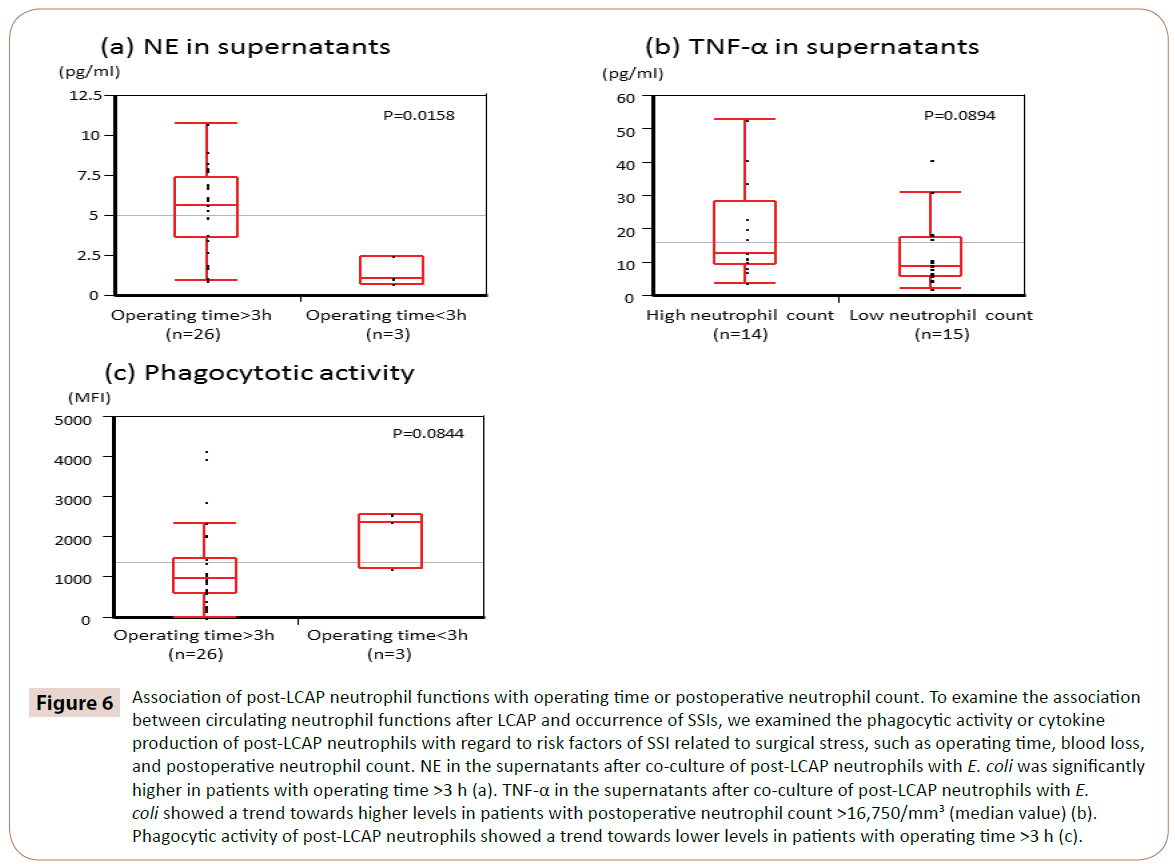
Obrázek 6: Asociace funkcí neutrofilů po LCAP s operačním časem nebo počtem pooperačních neutrofilů. Abychom prozkoumali souvislost mezi funkcemi cirkulujících neutrofilů po LCAP a výskytem SSI, zkoumali jsme fagocytární aktivitu nebo produkci cytokinů neutrofilů po LCAP s ohledem na rizikové faktory SSI související s chirurgickou zátěží, jako je operační čas, krevní ztráta a počet pooperačních neutrofilů. NE v supernatantu po společné kultivaci post-LCAP neutrofilů s E. coli byl významně vyšší u pacientů s operačním časem >3 h (a). TNF-α v supernatantech po společné kultivaci post-LCAP neutrofilů s E. coli vykazoval trend k vyšším hladinám u pacientů s pooperačním počtem neutrofilů >16 750/mm3 (mediánová hodnota) (b). Fagocytární aktivita post-LCAP neutrofilů vykazovala trend k nižším hladinám u pacientů s operačním časem >3 h (c).
TNF-α v supernatantech po společné kultivaci post-LCAP neutrofilů s E. coli. coli vykazovaly trend k vyšším hladinám u pacientů s počtem neutrofilů po operaci >16 750/mm3 (mediánová hodnota) (P=0,0894).
Fagocytární aktivita neutrofilů po LCAP vůči E. coli vykazovala trend k nižším hladinám u pacientů s operačním časem >3 h (P=0,0844).
Souvislost mezi sérovým TNF-α po LCAP a SSI
Pro objasnění, zda systémová zánětlivá odpověď hostitele po LCAP ovlivňuje výskyt SSI, jsme zkoumali souvislost mezi sérovými hladinami cytokinů po LCAP a výskytem SSI.
Jak ukazuje obrázek 7, sérové hladiny TNF-α po LCAP vykazovaly trend k vyšším hladinám u pacientů, u kterých se vyvinula SSI, než u těch, u kterých se nevyvinula (P=0,0714).
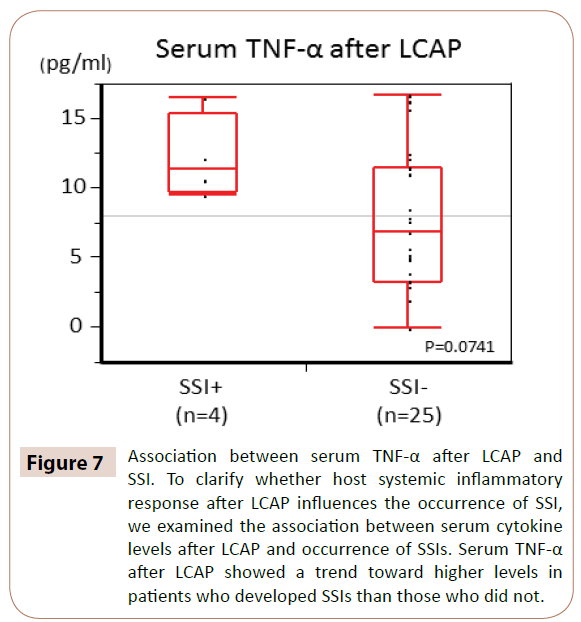
Obr. 7: Asociace mezi sérovými hladinami TNF-α po LCAP a SSI. Abychom objasnili, zda systémová zánětlivá odpověď hostitele po LCAP ovlivňuje výskyt SSI, zkoumali jsme souvislost mezi sérovými hladinami cytokinů po LCAP a výskytem SSI. Sérový TNF-α po LCAP vykazoval trend k vyšším hladinám u pacientů, u kterých se vyvinuly SSI, než u těch, u kterých se SSI nevyvinuly.
Nebyl zjištěn žádný významný rozdíl mezi sérovými hladinami IL-6, IL-8 a IL-1Ra po LCAP a výskytem SSI.
Diskuse
Bylo popsáno několik možných mechanismů účinku LCAP nebo GMA , i když jejich přesné mechanismy nebyly plně prozkoumány. Zdá se, že variabilita výsledků závisí na rozdílech v krevních buňkách použitých k analýze (granulocyty, monocyty nebo lymfocyty), metodách odběru krve (odebrané ze vstupní nebo výstupní linky nebo periferní žíly) a subjektech studie (zdraví dobrovolníci nebo nemocní pacienti).
Většina zkoušejících použila leukocyty, jako jsou neutrofily, monocyty nebo lymfocyty odebrané ze vstupní a výstupní linky zařízení pro mimotělní oběh . Leukocyty z výstupních linek jsou zbývající buňky filtrované LCAP. Jsou okamžitě vráceny do systémového oběhu pacientů a znovu smíchány s cirkulujícími leukocyty. Leukocyty z výstupních linek představují malou část všech cirkulujících leukocytů po LCAP. K objasnění systémového účinku LCAP na imunitní systém hostitele jsme použili cirkulující neutrofily izolované z periferních žil pacientů s UC.
Přísně vzato by se leukocytaferéza (LCAP) měla označovat jako leukocytafiltrace, protože dokáže leukocyty nejen odstranit, ale také je přes filtr aktivovat. Ve skutečnosti LCAP nemůže absorbovat a odstranit všechny krvinky, které do ní vstoupily. Určitý počet krevních buněk může projít filtrem a poté se vrátit do oběhu. Předpokládá se, že filtrované krevní buňky jsou aktivovány filtrací LCAP.
Neutrofily jsou nejpočetnější populací leukocytů a nejúčinněji odstraňovanými buňkami LCAP. Odhadovaný počet odfiltrovaných leukocytů je téměř 1,1 × 1010 buněk na jedno sezení LCAP , což může být srovnatelné s odstraněním téměř poloviny počtu cirkulujících neutrofilů (2 × 10-3 × 1010 buněk). Zkoumali jsme tedy funkční rozdíl mezi neutrofily před LCAP a po LCAP s ohledem na reakci na E. coli, abychom objasnili potenciální mechanismy klinického pozorování, že pooperační LCAP snižuje výskyt SSI. LCAP pomocí Cellsorba však může odstranit a aktivovat nejen neutrofily, ale i ostatní krevní buňky (monocyty, lymfocyty a trombocyty) s různou účinností odstranění. Proto je nutné prozkoumat změnu reakce na E. coli nejen u neutrofilů, ale i u ostatních krevních buněk mezi stavem před a po LCAP, ačkoli v této studii nebyly hodnoceny.
Jedním z nejvýznamnějších výsledků této studie byla skutečnost, že procento nekrotických neutrofilů bylo významně sníženo, když byly neutrofily po LCAP společně kultivovány s E. coli, ve srovnání s neutrofily před LCAP. Toto pozorování naznačuje, že LCAP snižuje podíl neutrofilů, které E. coli indukuje k nekróze, a zvyšuje podíl životaschopných (pravděpodobně nepřipravených) neutrofilů v systémové cirkulaci.
Byly pozorovány velké rozdíly v procentech životaschopnosti, apoptózy nebo nekrózy neutrofilů při společné kultivaci s E. coli. V našich nedávných nepublikovaných údajích se procento časné apoptózy (Annexin V+, PI-) u cirkulujících neutrofilů pohybovalo v širokém rozmezí od přibližně 10 % do 90 % u pacientů se systémovým zánětem, jako je zvýšený C-reaktivní protein >0,3 mg/l. Tato pozorování naznačují, že neutrofily mohou být již apoptotické bez kokultivace E. coli v důsledku vyšších chirurgických inzultů.
Nekróza je považována za nekontrolovanou buněčnou smrt a zřejmě neočekávaně uvolňuje toxické formy kyslíku a proteolytické enzymy . Je známo, že nekróza neutrofilů je hlavní příčinou poškození dýchacích cest a plic u intenzivně zanícených plic pacientů s cystickou fibrózou . Pooperační LCAP může kromě odstranění aktivovaných leukocytů, které způsobují systémový zánět, vyvolat nábor podskupiny neutrofilů, která je odolná vůči neočekávané nebo nekontrolované nekrotické buněčné smrti proti bakteriální infekci, do systémové cirkulace.
Na rozdíl od výše uvedených výsledků experimentů ex vivo byl NE v séru po LCAP výrazně zvýšen. Bezprostřední snížení NE v séru vlivem LCAP nebylo pozorováno. Jedním z možných vysvětlení je, že jediné sezení LCAP nemusí dostatečně potlačit uvolňování NE z celotělových neutrofilů při systémovém zánětu vyvolaném operací
Cirkulující neutrofily po LCAP izolované od pacientů s delší dobou operace (>3 h) nebo vyšším počtem pooperačních neutrofilů (>16 750/mm3; mediánová hodnota) vykazovaly nejen vyšší aktivitu produkce NE nebo TNF-α, ale také nižší fagocytární aktivitu proti E. coli. Tato zjištění naznačují, že neutrofily izolované od pacientů s vysokým chirurgickým stresem vykazují nadměrnou produkci prozánětlivých cytokinů nebo zhoršenou fagocytární aktivitu, a to i po obnově neutrofilů pomocí pooperační LCAP.
Z 29 pacientů s UC s pooperační LCAP se SSI vyvinuly pouze u čtyř pacientů (13,8 %). Jejich sérový TNF-α po LCAP byl vyšší než u pacientů bez SSI, i když rozdíl nedosáhl statistické významnosti. Sérový TNF-α proto může být užitečný pro identifikaci pacientů, u kterých se po pooperační LCAP vyvine SSI. Nebyla však pozorována žádná souvislost mezi rozvojem SSI a životaschopností neutrofilů, apoptózou nebo nekrózou při společné kultivaci s E. coli, což může být částečně způsobeno malou velikostí vzorku.
V poslední době bylo zjištěno, že cirkulující neutrofily jsou funkčně heterogenní populací a jsou různě připraveny proti různým inzultům . Uváděli jsme klinický význam cirkulujících neutrofilů při systémovém zánětu . Domníváme se, že cirkulující neutrofily mohou být primárním cílem pro zkoumání systémového účinku LCAP na imunitní systém hostitele.
Někteří badatelé navíc uvádějí, že leukodeplece, která odstraňuje polymorfonukleární buňky ze systémové cirkulace pomocí leukocytárních filtrů, vede k významnému zlepšení plicních a renálních funkcí pacientů, u nichž se po kardiopulmonálním bypassu rozvíjí syndrom systémové zánětlivé odpovědi (SIRS) . Cílená leukodeplece neutrofilů může být prospěšná pro prevenci orgánového selhání v důsledku SIRS .
Závěrem lze říci, že toto je pravděpodobně první zpráva prokazující, že pooperační LCAP snižuje podskupinu cirkulujících neutrofilů, které vyvolávají nekrózu proti bakteriální infekci. Pro prevenci SSI může být přínosné snížení neočekávané nebo nekontrolované nekrotické buněčné smrti způsobené uvolněním toxických nebo proteolytických látek do systémové cirkulace.
Poděkování
Autoři děkují Motoko Ueeda a Chihiro Hibi za poskytnutí vynikající technické pomoci.
Autorský podíl
K.T., T.A. a M.K. navrhli a provedli experimenty, analyzovali a interpretovali data a napsali rukopis. S.Y., Y.O. a S.K. provedli experimenty a analyzovali data. Y.T., M.I., M.O., M.K., Y.I., K.U. a Y.M. navrhli experimenty a analyzovali a interpretovali data. C.M. a M.K. navrhli experimenty a interpretovali data.
Grant Support and Disclosure of Financial Arrangements
Tato práce byla částečně podpořena granty Ministerstva školství, kultury, sportu, vědy a technologie Japonska (KAKENHI 23791523 pro S.Y., 25861181 pro Y.O. a 24791887 pro M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Living and dying for inflammation: neutrophils, eosinophils, basophils. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrofily ve vrozené a adaptivní imunitě. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Současný stav a budoucí perspektivy leukocytaferézy u zánětlivých střevních onemocnění. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factors affecting short- and long-term effects of leukocyte removal therapy in active ulcerative colitis. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytaferéza s použitím filtru pro odstranění leukocytů. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunomodulatory effects of granulocyte and monocyte adsorption apheresis as a treatment for patients with ulcerative colitis. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013)Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Účinnost leukocytaferézy při potlačování výskytu infekcí v místě chirurgického výkonu po operaci ulcerózní kolitidy. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdosed patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009 (Klasifikace buněčné smrti: doporučení Výboru pro nomenklaturu buněčné smrti 2009). Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanismus dysfunkce neutrofilů: serinové proteázy neutrofilů štěpí a inaktivují receptor C5a. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Přímý důkaz sekundární nekrózy neutrofilů během intenzivního zánětu plic. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse novel functions of neutrophils in immunity, inflammation, and beyond. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Deplece krevních neutrofilů u pacientů se sepsí: léčba budoucnosti? IntImmunopharmacol17:1226-1232.