US Pharm. 2008;33(3)(OTC suppl):4-7.
Astma je plicní onemocnění charakterizované reverzibilní obstrukcí průtoku vzduchu a bronchiální hyperreaktivitou. Ústředním rysem astmatu je zánět, který vede k opakovaným epizodám sípání, kašle, dušnosti a tlaku na hrudi.1,2 Cílem léčby je získat kontrolu nad onemocněním, aby byla zachována normální kvalita života.
Zátěž astmatem se v posledních třech desetiletích neustále zvyšuje. V roce 1970 trpěla astmatem přibližně 3 % populace, zatímco v roce 1995 to bylo 5,5 % a v roce 2005 7,7 %.3 Posledně uvedený odhad odpovídá přibližně 22,2 milionu Američanů.2,3 S nárůstem prevalence tohoto onemocnění ve Spojených státech roste také nemocnost a úmrtnost způsobená astmatem. V roce 2004 bylo astmatu přičítáno 1,8 milionu návštěv pohotovosti, 497 000 hospitalizací a 4 055 úmrtí.3
Léčba založená na kontrole astmatu
Národní program pro vzdělávání a prevenci astmatu (National Asthma Education and Prevention Program, NAEPP), divize Národního institutu pro srdce, plíce a krev (National Heart, Lung, and Blood Institute), vydává Pokyny pro diagnostiku a léčbu astmatu, naposledy aktualizované v roce 2007.2 Pokyny klasifikují závažnost astmatu jako intermitentní nebo perzistentní na základě symptomů a frekvence užívání léků pro rychlou úlevu. Jedinci s intermitentním astmatem mají zřídkavé příznaky, následně zřídka užívají léky rychlé úlevy a nenarušují běžnou činnost. Pokud je astma hůře kontrolováno, pak je závažnost astmatu klasifikována jako perzistentní (viz TABULKA 1).
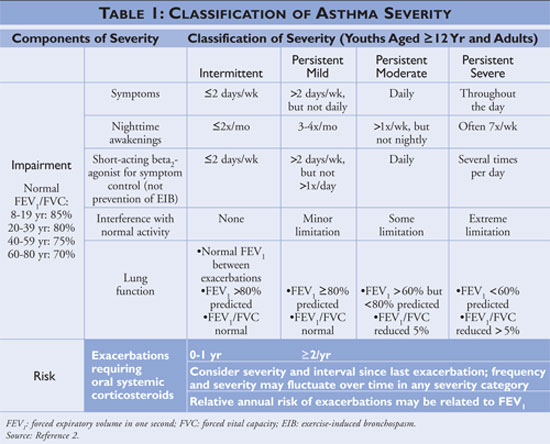
Pokyny popisují základní kameny léčby astmatu jako vzdělávání v oblasti sebeřízení, používání léků s rychlou úlevou a používání léků s dlouhodobou kontrolou u jedinců s perzistentním astmatem. Poskytovatelé zdravotní péče, kteří nabízejí vzdělávání v oblasti samosprávy, by měli pacienty poučit, jak rozpoznat spouštěče astmatu a jak se jim pokud možno vyhnout, jak správně používat farmakologickou léčbu a jak vypracovat akční plán pro léčbu astmatu. U všech pacientů s diagnózou astmatu by měla být zahájena léčba léky pro rychlou úlevu a u jedinců s intermitentním astmatem mohou být používány jako monoterapie; jedinci s diagnózou perzistujícího astmatu by však měli mít do svého režimu přidán jeden nebo více dlouhodobých kontrolních léků. Mezi dlouhodobé kontrolní léky patří inhalační kortikosteroidy, modifikátory leukotrienů, dlouhodobě působící beta-agonisté a teofylin (viz TABULKA 2).

V pokynech se rovněž uvádí, že přibližně 30 % americké populace používá doplňkové a alternativní léky a intervence. V současné době však neexistuje dostatek důkazů pro doporučení těchto způsobů léčby astmatu. Pokyny nedoporučují používat k léčbě astmatu bylinné prostředky na základě nedostatku údajů o bezpečnosti a účinnosti.
Přípravky pro léčbu astmatu bez lékařského předpisu a jejich regulace
Přípravky pro léčbu astmatu bez lékařského předpisu jsou k dispozici od 50. let 20. století, i když některé účinné látky se v průběhu let značně změnily. V současné době jsou dostupné účinné látky bez lékařského předpisu efedrin – s guaifenesinem nebo bez něj – a adrenalin. Teofylin a fenobarbital byly dříve účinnými složkami přípravků pro léčbu astmatu bez lékařského předpisu; oba jsou však nyní klasifikovány jako přípravky, jejichž výdej je vázán na lékařský předpis.4
V posledních třech desetiletích přijímá FDA opatření týkající se regulace léčby astmatu bez lékařského předpisu. V roce 1976 dospěl úřad FDA k závěru, že inhalační epinefrin poskytuje rychlou a účinnou úlevu při mírném až středně těžkém astmatu. V roce 1982 opět dospěl k závěru v předběžné závěrečné monografii: „Epinefrin, epinefrin bitartrát a epinefrin hydrochlorid (racemický; od té doby přejmenovaný na racepinefrin hydrochlorid) v inhalačních aerosolových formách pod tlakem mohou být obecně uznány za bezpečné a účinné pro volně prodejné použití v dávce pro dospělé a děti od 4 let věku 1 až 2 inhalace odměřené dávky odpovídající 0,5 mg.16 až 0,25 mg epinefrinu na inhalaci ne častěji než každé 3 hodiny. „5,6
V roce 1986 FDA přezkoumala přípravky s efedrinem pro bronchodilataci a schválila tuto účinnou látku jako obecně uznávanou jako bezpečnou a účinnou pro použití bez lékařského předpisu. V tomto roce FDA rozhodl, že údaje nejsou dostatečné pro omezení inhalačního epinefrinu pouze na použití na lékařský předpis a že výhody dostupnosti bez lékařského předpisu převažují nad riziky. Úřad FDA dospěl k závěru, že rozšířené a revidované značení bude pro spotřebitele přínosem.5,6
Po hlášeních o život ohrožujících příhodách a úmrtích způsobených kombinovanými přípravky bez lékařského předpisu obsahujícími teofylin vydal úřad FDA v roce 1995 konečné rozhodnutí, že tyto přípravky nejsou bezpečné ani účinné.7 Proto byla ukončena výroba přípravků obsahujících kombinaci efedrinu a teofylinu a některé z nich byly přeformulovány na přípravky obsahující efedrin a guaifenesin. V roce 1995 také FDA navrhl odstranit efedrin z trhu s přípravky bez lékařského předpisu kvůli jeho roli při výrobě metamfetaminu a metkatinonu a jeho zneužívání k regulaci hmotnosti a posilování svalů.7
V roce 1996 FDA změnil konečnou monografii z roku 1986 tak, že zrušil status monografie pro volně prodejné bronchodilatancia.6 Místo toho musí výrobci všech nových inhalátorů s odměřeným dávkováním bez lékařského předpisu předložit schválenou žádost, která obsahuje informace, jež se v monografii nenacházejí.6 V současnosti prodávaných bronchodilatancií bez lékařského předpisu se tato změna nedotkla.
Přes návrh FDA odstranit efedrin z trhu bez lékařského předpisu kvůli jeho použití jako základního prvku při výrobě metamfetaminu zůstává tento přípravek dostupný bez lékařského předpisu. Místo toho zákon o boji proti metamfetaminové epidemii z roku 2005, který byl v roce 2006 začleněn do zákona Patriot Act, udělil výrobkům bez lékařského předpisu obsahujícím efedrin status volně prodejných výrobků.8 Spotřebitelé, kteří si chtějí zakoupit výrobky s obsahem efedrinu, musí nyní v lékárně předložit vládou vydaný průkaz totožnosti s fotografií, protože tyto výrobky se již legálně neprodávají v obchodech se smíšeným zbožím nebo ve velkoobchodech bez registrované lékárny.
V rámci celosvětové ochrany veřejného zdraví byla vytvořena mezinárodní dohoda s cílem omezit a nakonec vyloučit výrobky, které obsahují látky poškozující ozonovou vrstvu (ODS), jako jsou chlorofluorouhlovodíky (CFC) obsažené v inhalátorech s dávkovačem (MDI). Tato dohoda dala vzniknout Montrealskému protokolu z roku 1987 a následně i změnám zákona o čistotě ovzduší z roku 1990.9-11 Dohoda stanoví výjimku pro používání freonů v inhalátorech MDI používaných k léčbě astmatu, pokud je použití výrobku FDA označeno jako nezbytné.12 Léky na astma, které nejsou na předpis, zůstaly pod označením nezbytného použití. V roce 2007 však FDA oznámil návrh na zrušení označení nezbytného použití pro inhalační epinefrin s účinností od 31. prosince 2010.13 FDA při přezkoumání označení nezbytného použití inhalačního epinefrinu použil následující kritéria uvedená v 21 CFR 2.125(g)(2): „(i): Existují podstatné technické překážky pro formulaci přípravku bez ODS; (ii): Přípravek bude poskytovat nedostupný významný přínos pro veřejné zdraví a (iii): Používáním výrobku nedojde k uvolnění kumulativně významného množství látek poškozujících ozonovou vrstvu do ovzduší nebo je toto uvolnění oprávněné vzhledem k nedostupnému významnému přínosu pro veřejné zdraví. „13 Úřad FDA v současné době přijímá připomínky k této záležitosti před vydáním konečného rozhodnutí.
Bezpečnost a účinnost výrobků, jejichž výdej není vázán na lékařský předpis
Jak je patrné z různých návrhů a opatření FDA týkajících se statusu výrobků pro léčbu astmatu, jejichž výdej není vázán na lékařský předpis, v posledních několika desetiletích proběhlo mnoho diskusí ohledně bezpečnosti a účinnosti účinných látek v těchto výrobcích. Přestože tyto výrobky nejsou aktivně propagovány, jejich dostupnost znamená, že jejich bezpečnost a účinnost jsou pro spotřebitele kriticky důležité.
Efedrin: Jednosložkové efedrinové přípravky určené k použití jako bronchodilatancia jsou od roku 1986 považovány FDA za obecně uznávané jako bezpečné a účinné.14 Efedrin uvolňuje z tkání adrenalin, který vyvolává aktivitu alfa-adrenergních a neselektivních beta-adrenergních receptorů. Účinnost efedrinu při bronchodilataci byla prokázána ve studiích z 50. let 20. století. Mezi vlastnosti, které činí efedrin jako bronchodilatátor méně žádoucí, patří pomalejší nástup účinku než u inhalačních přípravků (15 minut až jedna hodina) a neselektivita beta stimulace, která by mohla přispívat ke kardiovaskulárním nežádoucím účinkům (NÚ).15-17 Studie však prokázaly rozporuplné výsledky týkající se kardiovaskulárních nežádoucích účinků přičitatelných užívání efedrinu v označených dávkách 12,5 až 25 mg.16
Epinefrin: Epinefrin vykazuje stejnou aktivitu alfa- a beta-adrenergních receptorů jako efedrin, a proto existují stejné obavy ohledně možnosti kardiovaskulárních nežádoucích účinků. Nástup účinku inhalačního adrenalinu (15 s) je mnohem rychlejší než u perorálního efedrinu, což z něj činí vhodnější volbu pro okamžitou úlevu od akutní exacerbace astmatu.6 Jeho krátké trvání účinku (23 min) však může vyžadovat, aby pacient používal přípravek opakovaně pro pokračující úlevu, místo aby se řídil pokyny na obalu, že během tří hodin nesmí provést více než dvě inhalace.6 Inhalátory s epinefrinem, jejichž výdej není vázán na lékařský předpis, se zdají být bezpečné a účinné pro pacienty s mírným, intermitentním astmatem, pokud jsou používány v souladu s etiketou.5 To však zůstává zdrojem kontroverzí, protože mnoho poskytovatelů zdravotní péče se obává, že pacientům, kteří se spoléhají na inhalátory bez lékařského předpisu, se nemusí dostat odpovídající léčby onemocnění od zdravotnického týmu, což může vést k závažným následkům.
Guaifenesin: Guaifenesin se používá v kombinaci s efedrinem k léčbě astmatu a je uznáván jako bezpečný a účinný, pokud je přípravek označen pro kašel spojený s astmatem.14 Ačkoli je guaifenesin mukolytikum schválené FDA, nemá bronchodilatační účinky. Nepřispívá tedy k dalšímu přínosu efedrinového přípravku při akutní exacerbaci.17
Používání přípravků pro astma bez lékařského předpisu
Průzkum společnosti Wyeth Consumer Healthcare (WCH) provedený v roce 1999 zjistil, že zhruba šest milionů (30 %) osob s astmatem užívá efedrinové inhalátory.6 Z vlastního vyjádření respondentů vyplývá, že asi 20 % z těchto šesti milionů by bylo klasifikováno jako osoby s mírným až středně těžkým perzistujícím astmatem, což není v označeném použití tohoto přípravku.5 Směrnice NAEPP podporují používání krátkodobě působících beta-agonistů alespoň podle potřeby u všech osob trpících astmatem; směrnice však inhalační epinefrin jako volbu léčby výslovně nezmiňují.
V roce 2005 provedla Světová zdravotnická organizace internetový průzkum mezi 330 osobami ohledně používání bronchodilatancií bez lékařského předpisu k léčbě jejich příznaků. WCH zjistila, že z uživatelů, kteří užívají pouze léky bez lékařského předpisu, bylo 92 % diagnostikováno astma, 91 % užívá inhalační epinefrin pouze při akutní exacerbaci astmatu, 31 % nemá zdravotní pojištění a 38 % nemá pojištění na předpis.6 WCH extrapolovala tyto výsledky a odhadla, že přibližně 5 až 10 % osob s astmatem užívá bronchodilatancia bez lékařského předpisu jako monoterapii.6 Hlavní důvody uváděné pro užívání přípravků bez lékařského předpisu – snadná dostupnost a nižší cena – přímo korelují s obavami poskytovatelů zdravotní péče, že jedincům užívajícím přípravky pro astma bez lékařského předpisu nemusí být poskytována odpovídající léčba onemocnění.6
Diskuse
Mezi vlastnosti žádoucí při léčbě akutního astmatu patří účinnost jako bronchodilatátor, bezpečnost při užívání podle označení, rychlý nástup účinku a dlouhé trvání účinku. Jak inhalační adrenalin, tak perorální efedrin prokazují účinnost ve studiích již desítky let. Vzhledem ke smíšeným kardiovaskulárním výsledkům v klinických studiích je však bezpečnost užívání bronchodilatancií bez lékařského předpisu osobami, které nemusí být lékařsky sledovány, hlavním problémem poskytovatelů zdravotní péče. Inhalační efedrin má rychlejší nástup účinku než perorální efedrin, ale jeho krátké trvání účinku může omezovat jeho účinnost.
Dostupnost perorálního efedrinu je od roku 2006 omezena jeho volně prodejným statusem. Dostupnost inhalačního adrenalinu závisí na rozhodnutí FDA ohledně toho, zda si tento přípravek zachová své označení pro základní použití. Pro v současnosti prodávané bronchodilatancia bez předpisu obsahující CFC neexistují žádné alternativy.12 Jeden výrobce se pokusil změnit složení svého přípravku s inhalačním epinefrinem bez předpisu pomocí hydrofluoroalkanového hnacího plynu, což mělo pro uživatele nežádoucí účinky; na změně složení spolupracuje s jinou farmaceutickou firmou a očekává, že do roku 2011 podá žádost u FDA.6 Mezi hlavní obavy týkající se alternativních hnacích plynů patří potřeba účinného podávání epinefrinu a údaje o bezpečnosti a účinnosti nového přípravku v důsledku změn.18
Při rozhodování o tom, zda zrušit označení pro základní použití inhalačního epinefrinu, nezkoumá úřad FDA bezpečnost nebo účinnost v současnosti uváděných výrobků obsahujících freony; zkoumá spíše dopad na veřejné zdraví v případě zrušení tohoto označení. V dopisech Národní asociace řetězců lékáren (National Association of Chain Drug Stores) a Americké asociace lékárníků (American Pharmacists Association) adresovaných FDA v souvislosti s návrhem na zrušení označení pro základní použití se uváděla především obava z možného negativního dopadu na současné uživatele inhalátorů bez lékařského předpisu, pokud by se tyto výrobky staly nedostupnými.19,20 FDA uvedla, že pokud navrhované pravidlo o zrušení označení pro základní použití vstoupí v platnost a nebudou existovat alternativy bez lékařského předpisu, bude nutné, aby si spotřebitelé opatřili alternativní výrobek na lékařský předpis.12 Mnoho spotřebitelů užívajících inhalační epinefrin se může rozhodnout vzdát se léčby astmatu nebo vyhledat alternativní léčbu bez lékařského předpisu.
Je nezbytné, aby si lékařská komunita uvědomila závažnost důsledků nekontrolovaného astmatu a aby každá osoba, která má potíže s dýcháním, navštívila poskytovatele zdravotní péče za účelem diagnostiky a léčby. Pacient, který se rozhodne používat bronchodilatancia bez lékařského předpisu, by měl být upozorněn, aby o tom informoval svého poskytovatele zdravotní péče; pacient by měl být také poučen o rozdílu v pokynech na etiketě inhalátorů bez lékařského předpisu a inhalátorů na lékařský předpis. Současná trvalá dostupnost bronchodilatancií, jejichž výdej není vázán na lékařský předpis, vyžaduje informované poradenství pacientům, aby se předešlo nesprávnému užívání těchto přípravků a následným nežádoucím účinkům.
1. Inhalátory, jejichž výdej není vázán na lékařský předpis, mohou být používány pouze na lékařský předpis. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Zpráva expertní skupiny 3: Pokyny pro diagnostiku a léčbu astmatu. Národní program vzdělávání a prevence astmatu. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Spojené státy americké, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Přístup 10. prosince 2007.
4. W. Steven Pray. OTCprodukty a léčba astmatu. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Bezpečnost volně prodejných inhalátorů pro astma: zpráva Rady pro vědecké záležitosti. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Použití látky poškozující ozonovou vrstvu: stanovení základního použití volně prodejných inhalátorů s epinefrinem. Informační dokument. December 19, 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Přístup 30. prosince 2007.
7. Kupec IF. Bronchodilatancia obsahující teofylin a léčivé přípravky s efedrinem. Odpovědi T95-40. 27. července 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Dostupné 10. prosince 2007.
8. Drug Enforcement Administration (Úřad pro kontrolu léčiv). Obecné informace týkající se zákona o boji proti metamfetaminové epidemii z roku 2005 . Květen 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Přístupné 4. února 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of „essential use exemptions“ for metered-dose inhalers under the Montreal Protocol [Ekonomika výjimek pro „základní použití“ pro inhalátory s odměřenou dávkou podle Montrealského protokolu]. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions [Montrealský protokol a výjimky pro základní použití]. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Úřad pro kontrolu potravin a léčiv. Zprávy Úřadu pro kontrolu potravin a léčiv (FDA). FDA proposing phase out of CFCs in metered-dose inhalers for epinephrine. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Přístup 10. prosince 2007.
13. Úřad pro kontrolu potravin a léčiv. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Přístup 6. února 2008.
14. Whitehall-Robins. RE: dokument č. 98N-0148; Fed. Reg. 13258, mezinárodní seznamy drog; Úmluva o psychotropních látkách. April 16, 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Přístup 30. prosince 2007.
15. Lexi-Comp Online. www.crlonline.com. Přístup 28. prosince 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Dvojitě zaslepené srovnání akutních bronchiálních a kardiovaskulárních účinků perorálního terbutalinu a efedrinu. Chest. 1975;68:155-161.
17. Dulfano MJ. Nová perorální bronchodilatancia . Chest.1975;68:133-134.
18. Léčivé přípravky proti nachlazení, kašli, alergii, bronchodilatační a antiastmatické léčivé přípravky pro humánní použití bez lékařského předpisu; změna monografie pro volně prodejné bronchodilatační léčivé přípravky. Fed Regist. 1996; 61:25142-25147.
19. Národní asociace řetězců lékáren. Předmět: Použití hnacích plynů poškozujících ozonovou vrstvu; zrušení označení základního použití pro volně prodejné inhalátory s dávkovačem epinefrinu (MDI). 6. ledna 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Přístup 6. února 2008.
20. Prohlášení Americké asociace lékárníků (APhA) pro Poradní výbor pro léky bez předpisu a Poradní výbor pro léky proti plicním alergiím Úřadu pro kontrolu potravin a léčiv. Use of ozone-depleting substance: essential-use determination of OTC epinephrine metered dose inhalers (Použití látky poškozující ozon: stanovení nezbytného použití volně prodejných inhalátorů s epinefrinem). January 24, 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Přístup 6. února 2008.
Chcete-li se k tomuto článku vyjádřit, kontaktujte [email protected].