4.3 Vícenásobné kovalentní vazby
Cíl výuky
- Rozpoznat molekuly, které pravděpodobně mají vícenásobné kovalentní vazby.
V mnoha molekulách by pravidlo oktetu nebylo splněno, pokud by každý pár vázaných atomů sdílel dva elektrony. Uvažujme oxid uhličitý (CO2). Pokud každý atom kyslíku sdílí s atomem uhlíku jeden elektron, dostaneme následující:
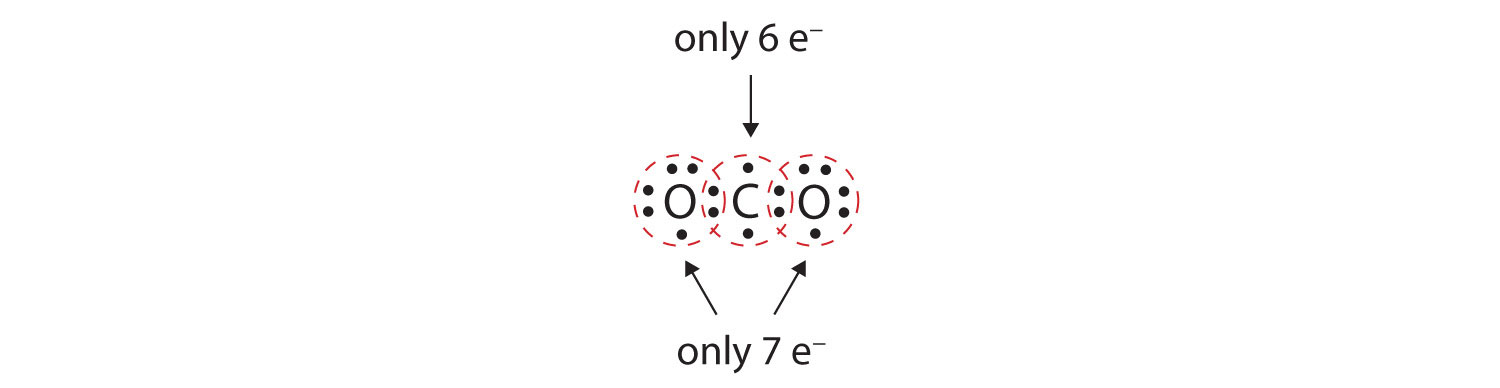
Tím atom uhlíku nezíská úplný oktet; v jeho valenční slupce najdete pouze šest elektronů. Kromě toho má každý atom kyslíku ve své valenční slupce pouze sedm elektronů. A konečně, žádný atom nevytváří tolik vazeb, kolik jich obvykle tvoří (obrázek 4.2 „Kolik kovalentních vazeb vzniká?“). Toto uspořádání sdílených elektronů není zdaleka uspokojivé.
Někdy musí být mezi dvěma atomy sdíleno více než jeden pár elektronů, aby oba atomy měly oktet. V oxidu uhličitém je druhý elektron z každého atomu kyslíku sdílen také s centrálním atomem uhlíku a atom uhlíku sdílí ještě jeden elektron s každým atomem kyslíku:
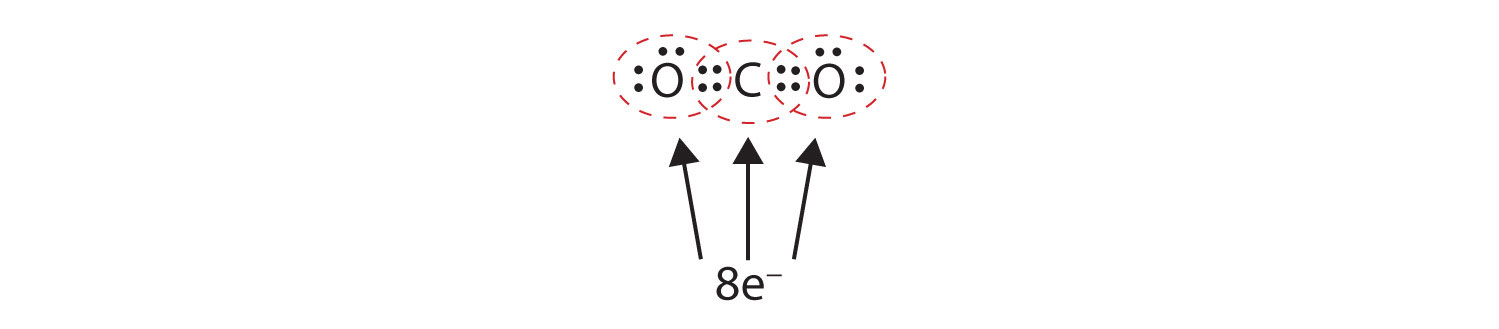
V tomto uspořádání sdílí atom uhlíku čtyři elektrony (dva páry) s atomem kyslíku vlevo a čtyři elektrony s atomem kyslíku vpravo. Kolem každého atomu je nyní osm elektronů. Dva páry elektronů sdílené mezi dvěma atomy tvoří dvojnou vazbuDva páry elektronů sdílené dvěma atomy v molekule. mezi atomy, což je znázorněno dvojitou pomlčkou:
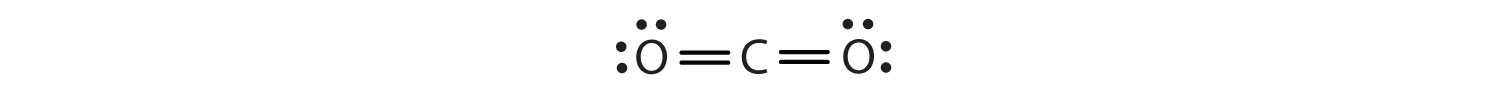
Některé molekuly obsahují trojnou vazbuTři páry elektronů sdílené dvěma atomy v molekule. kovalentní vazby, ve kterých jsou tři páry elektronů sdílené dvěma atomy. Jednoduchou sloučeninou, která má trojnou vazbu, je acetylen (C2H2), jehož Lewisův diagram je následující:

Příklad 5
Nakreslete Lewisův diagram pro každou molekulu.
- N2
- CH2O (Atom uhlíku je centrální atom.)
Roztok
-
Vazba mezi dvěma atomy dusíku je trojná. Lewisův diagram pro N2 je následující:

-
V CH2O je centrální atom obklopen dvěma různými typy atomů. Lewisův diagram, který vyplňuje valenční elektronový obal každého atomu, je následující:

Poznámka
Jedním z použití CH2O, nazývaného také formaldehyd, je konzervace biologických vzorků. Vodné roztoky CH2O se nazývají formalín a mají ostrý, charakteristický (štiplavý) zápach.
Cvičení na rozvoj dovedností
-
O2
-
C2H4
Kreslete Lewisův diagram pro každou molekulu.
Cvičení na kontrolu pojmů
-
Jaké je jedno z vodítek, že molekula má násobnou vazbu?
Odpověď
-
Pokud jednoduché vazby mezi všemi atomy nedávají všem atomům (kromě vodíku) oktet, může se jednat o násobnou kovalentní vazbu.
Klíčový závěr
- Některé molekuly musí mít mezi atomy více kovalentních vazeb, aby bylo splněno pravidlo oktetu.
Cvičení
-
Každá molekula obsahuje více vazeb. Nakreslete pro každou z nich Lewisův diagram. Prvním prvkem je centrální atom.
- CS2
- C2F4
- COCl2
-
Každá molekula obsahuje dvojné vazby. Nakreslete pro každou z nich Lewisův diagram. Předpokládejte, že první prvek je centrálním atomem, pokud není uvedeno jinak.
- N2
- HCN (Atom uhlíku je centrálním atomem.)
- POCl (Atom fosforu je centrálním atomem.)
-
Vysvětlete, proč atomy vodíku netvoří dvojnou vazbu.
-
Proč je nesprávné zakreslit dvojnou vazbu do Lewisova diagramu pro MgO?
Odpovědi
-
-
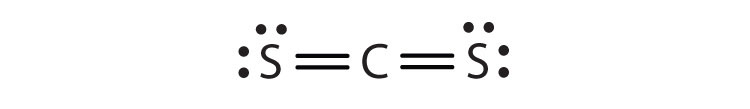
-
.
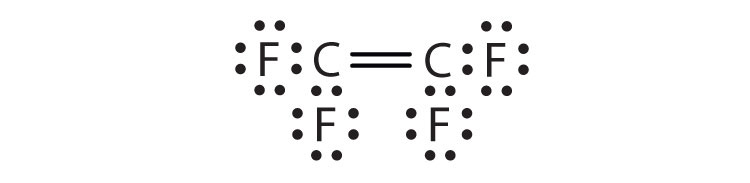
-
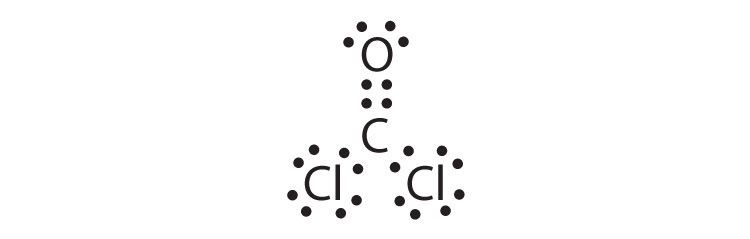
-
-
Vodík může přijmout pouze jeden další elektron; vícenásobné vazby vyžadují sdílení více než jednoho elektronového páru.