- U rostlin s průměrným obsahem 2C DNA vyšším než 0 se objevují dutiny bez chromatinu.8 pg na chromozom
- Kondenzaci/dekondenzaci chromozomů lze vizualizovat v polotlustých řezech N. damascena po barvení 4′,6-diamidino-2-fenylindolem (DAPI)
- Kondenzace/dekondenzace chromozomů během mitózy analyzovaná po inkorporaci 5-ethynyl-2′-deoxyuridinu (EdU)
- Kondenzace/dekondenzace chromozomů během mitózy analyzovaná elektronovou mikroskopií
U rostlin s průměrným obsahem 2C DNA vyšším než 0 se objevují dutiny bez chromatinu.8 pg na chromozom
Anafázové a telofázové chromatidy některých rostlin obsahují v axiálních oblastech dutiny bez chromatinu, které tyto rostliny odlišují od většiny ostatních dosud zkoumaných rostlin a živočichů (obr. 1a, b). Pokud je nám známo, zprávy popisující takové uspořádání chromozomů se omezují na rostliny s velkými genomy a lze předpokládat, že takové morfologické uspořádání je pro tyto rostliny specifické. Abychom se o této domněnce přesvědčili, analyzovali jsme pomocí elektronové mikroskopie také chromatidy v anafázi a telofázi u 12 druhů (tab. 1; obr. 1a, b; doplňkový soubor 1: obr. S1). Obrázek 1c ukazuje, že axiální dutiny bez chromatinu byly jasně patrné pouze uvnitř chromozomů rostlin s velkými genomy a s velkými chromozomy, ale zdálo se, že průměrná velikost chromozomů lépe koreluje s přítomností nebo nepřítomností těchto dutin. Mezi rostlinami s axiálními dutinami mělo Hordeum vulgare nejmenší genom a nejmenší průměrný obsah 2C DNA na chromozom (0,79 pg). Toto uspořádání chromozomů je tedy charakteristickým znakem rostlinných chromozomů, jejichž obsah 2C DNA lze přibližně odhadnout na více než 0,8 pg na chromozom.
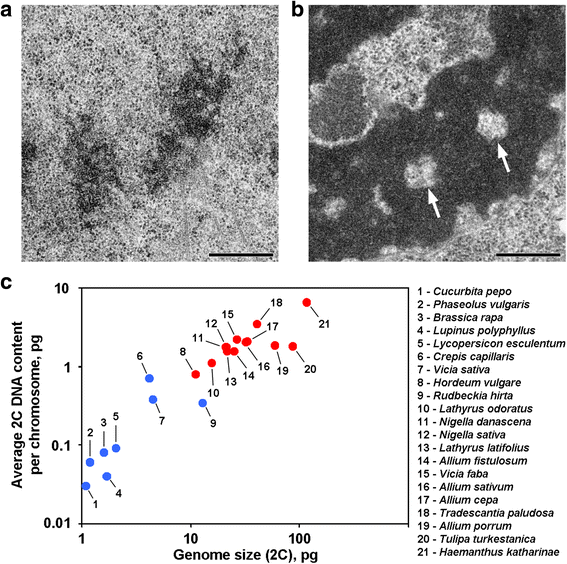
Dvě varianty uspořádání chromozomů u rostlin. a Telofázní chromozomy fazolu obecného (Phaseolus vulgaris) jako příklad chromozomů bez axiálních dutin bez chromatinu. b Telofázní chromozomy N. damascena s jasně viditelnými dutinami bez axiálního chromatinu (šipky). c Přítomnost dutin bez axiálního chromatinu závisí na velikosti genomu a chromozomu. Modré body představují rostliny, u nichž chromozomy neobsahují dutiny bez axiálního chromatinu; červené body představují rostliny, u nichž chromozomy obsahují dutiny bez axiálního chromatinu. Měřítko: 0,5 μm
Kondenzaci/dekondenzaci chromozomů lze vizualizovat v polotlustých řezech N. damascena po barvení 4′,6-diamidino-2-fenylindolem (DAPI)
Nejvhodnější objekt pro studium rostlinných chromozomů, kořenový apikální meristém, neumožňuje pořízení snímků s vysokým rozlišením kvůli rozostřené fluorescenci. Zde jsme použili metodu založenou na aplikaci polotenkých (200-250 nm) řezů kořenů zalitých v médiu LR White. Tloušťka těchto řezů byla výrazně menší než tloušťka optických řezů, i když byl použit konfokální mikroskop. Abychom zjistili morfologické charakteristiky, které nám umožnily identifikovat buňky v různých mitotických stadiích, analyzovali jsme morfologii buněk obarvených pomocí DAPI.
V organizaci chromozomů N. damascena došlo k několika proměnám, které byly snadno viditelné i pod fluorescenčním mikroskopem. Uvnitř jader v rané profázi byly viditelné části tenkých chromozomů (přibližně 0,6 μm v průměru) (obr. 2a). Ve střední profázi se vytvořily silnější profázní chromozomy (přibližně 1,2 μm), uvnitř kterých bylo možné rozlišit přítomnost tenčích vláken, která pravděpodobně odpovídala složeným chromozomům rané profáze (obr. 2b). Chromozomy pozdní profáze (obr. 2c), metafáze (obr. 2d) a anafáze (obr. 2e) byly hustě kondenzované a nebyla zjištěna žádná vnitřní organizace. Během dekondenzace v telofázi vedlo oddělení chromatinových vláken o průměru přibližně 0,4 μm ke vzniku dutin bez chromatinu v axiálních oblastech chromatid (obr. 2f), jejichž velikost se během telofáze postupně zvětšovala (obr. 2g a h). Průměr chromatinových vláken v chromozomech v telofázi byl srovnatelný s velikostí chromozomů v časné profázi. Všechna mitotická stadia N. damascena tak byla snadno detekovatelná v polotlustých řezech obarvených DAPI.
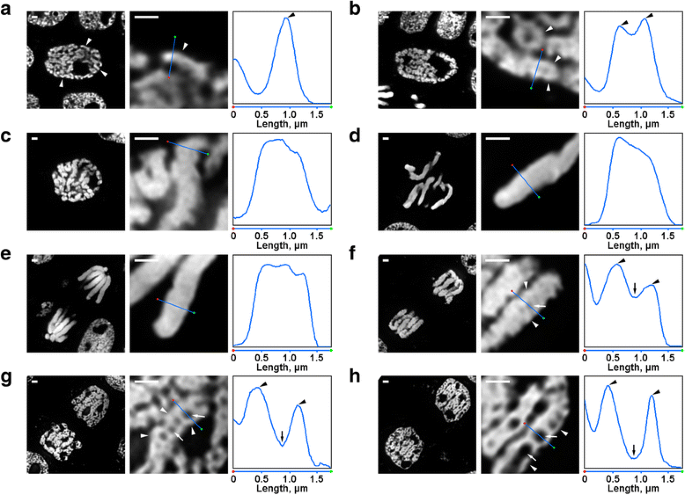
Morfologie mitotických chromozomů N. damascena. Levý a prostřední panel představují fluorescenční mikroskopické snímky polotenkého řezu obarveného DAPI (celkový pohled a fragment); pravý panel představuje graf hustoty přes čáru v prostředních panelech. a Časná profáze (chromozomy jsou označeny šipkami). b Střední profáze (vlákna tvořící chromozomy, která zřejmě odpovídají chromozomům časné profáze, jsou označena hroty šipek). c Pozdní profáze. d Metafáze. e Anafáze. f Časná telofáze (axiální dutiny bez chromatinu jsou označeny šipkami, vlákna tvořící chromozomy telofáze jsou označena hroty šipek). g Pozdní telofáze. h G1-fáze. Měřítka: 1 μm
Kondenzace/dekondenzace chromozomů během mitózy analyzovaná po inkorporaci 5-ethynyl-2′-deoxyuridinu (EdU)
Během profáze se tenké chromozomy časné profáze přeměnily na tlusté chromozomy pozdní profáze. Ztluštění profázových chromozomů může být důsledkem buď skládání časných profázových chromozomů, nebo důsledkem jejich postupného ztlušťování. K prozkoumání těchto dvou možných mechanismů bylo nutné označit diskrétní ohniska chromozomů, která byla lineárně uspořádána uvnitř časných profázových chromozomů, a poté analyzovat jejich prostorové přeskupení během profázové kondenzace. Jak je znázorněno na obr. 3a, během přechodu z časné do pozdní profáze by taková ložiska buď ztratila lineární uspořádání (skládání), nebo by si lineární uspořádání zachovala a roztáhla by se do tenkých pásů (zahušťování). Pro značení chromozomových oblastí jsme do chromatinu během replikace inkorporovali syntetický nukleotid EdU, který lze detekovat pomocí click-chemie.
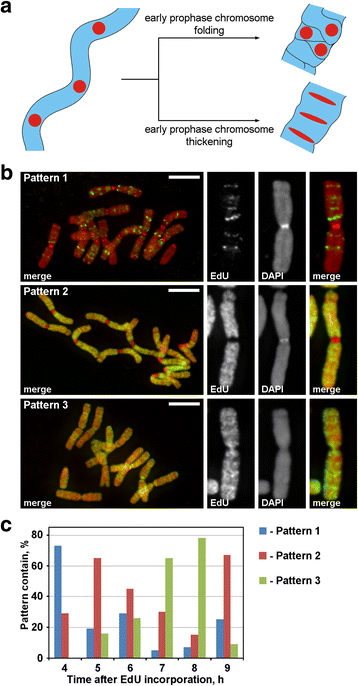
Značení chromozomů pomocí EdU. a Lokalizace a morfologie značených oblastí odhalily princip kondenzace chromozomů v profázi. Lineárně uspořádané, značené oblasti chromozomů při přechodu z časné do pozdní profáze buď ztrácely lineární uspořádání (skládání), nebo si lineární uspořádání zachovávaly (zahušťování). b V chromozomech byly zjištěny tři vzory inkorporace EdU: značení diskrétních oblastí (vzor 1), značení ramen chromozomů, ale ne centromer (vzor 2) a značení ramen chromozomů i centromer (vzor 3). c Frekvence různých vzorů značení v různých časových bodech po inkorporaci EdU. Měřítka: 5 μm
EdU byl inkorporován po dobu 30 min do kořenů N. damascena a po různých dobách pronásledování (od 2 do 14 h) byly provedeny rozptyly chromozomů. Byly zjištěny tři vzory značení chromozomů: značení diskrétních oblastí (vzor 1), značení ramen chromozomů, ale ne centromer (vzor 2) a značení ramen i centromer chromozomů (vzor 3) (obr. 3b). Vzor 1 byl častěji pozorován 4 h po inkorporaci EdU, což naznačuje, že takové značení je typické pro pozdní S-fázi (obr. 3c; doplňkový soubor 2: obr. S2). V případě vzoru 1 bylo značení homologních chromozomů podobné (Additional file 3: Figure S3), což naznačuje specifický vzor inkorporace EdU. Ramena chromozomů byla značena během zbytku S-fáze (vzory 2 a 3), ale přibližně na hranici mezi časnou a pozdní S-fází byly značeny i centromerické oblasti (vzor 3) (obr. 3c).
Přechody z časné do pozdní profáze jsme analyzovali pomocí chromozomů, u nichž byl značen pozdně se replikující chromatin (vzor 3). U chromozomů v časné profázi byly značené oblasti lineárně rozloženy podél tenkých chromozomů (obr. 4a). U chromozomů v pozdní profázi, které byly zhruba dvakrát tlustší než chromozomy v časné profázi, ztratily značené oblasti linearitu rozložení (obr. 4b). Toto pozorování nebylo zcela platné, protože profázní a metafázní chromozomy se skládají ze dvou chromatid, které se postupně segregují , a to může vést ke ztrátě linearity distribuce značených oblastí. Proto jsme dále analyzovali anafázové chromatidy (tj. plně zhuštěné chromozomy po segregaci chromatid). U anafázových chromatid s průměrem přibližně stejným jako průměr chromozomů pozdní profáze nebyly značené chromatinové oblasti uspořádány lineárně, ale byly rozloženy v celém objemu chromatid (obr. 4c). V telofázi byly v axiálních oblastech chromatid jasně viditelné dutiny bez chromatinu, což umožnilo detekovat chromatinová vlákna, uvnitř kterých byly značené oblasti uspořádány lineárně (obr. 4d). Během přechodu z časné do pozdní profáze tedy došlo ke skládání chromozomů v časné profázi. Tento výsledek je v souladu s pozorováním chromozomů střední profáze barvených DAPI (obr. 2b), uvnitř kterých byla jasně patrná skládaná tenká vlákna.
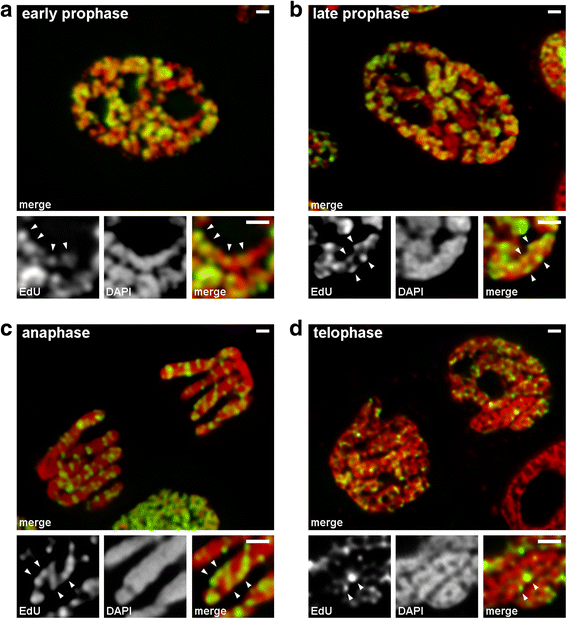
Kondenzace/dekondenzace chromozomů během mitózy N. damascena (mitotické buňky, jejichž chromozomy obsahovaly EdU během pozdní S-fáze). a V časné profázi byly značené oblasti lineárně rozmístěny v tenkých chromozomech, které téměř zcela pokrývaly šířku chromozomu. b V pozdní profázi byly značené oblasti rozptýleny po celém objemu chromozomu. c V anafázi byl vzor značení podobný jako u chromozomů v pozdní profázi. d V pozdní telofázi dekondenzace odhalila tenká vlákna tvořící chromatidy, uvnitř kterých byly značené oblasti rozmístěny podobně jako uvnitř chromozomů v časné profázi. Měřítka: 1 μm
Kondenzace/dekondenzace chromozomů během mitózy analyzovaná elektronovou mikroskopií
Pro detekci vnitřní organizace chromatinových vláken, jejichž skládání bylo popsáno pomocí světelné mikroskopie, jsme použili elektronovou mikroskopii. Pro detekci a měření substruktur chromatinových vláken jsme analyzovali dutiny bez chromatinu, které oddělovaly chromatinová vlákna, jak jsme předpokládali (Additional file 4: Figure S4; Table 2).
Interfázní jádra byla vyplněna sítí silných 234 ± 49 nm (průměr ± S.D.) vláken (obr. 5a), která lze označit jako „interfázní chromonemata“, jak je uvedeno jinde . Elektronová mikroskopie umožnila detekovat tři stadia profázní kondenzace chromozomů, z nichž nejranější nebylo možné detekovat pomocí světelné mikroskopie a bude zde označováno jako „předfázní“. Druhé a třetí stadium odpovídalo časné a pozdní profázi, jak je popsáno výše (obr. 2a a c).
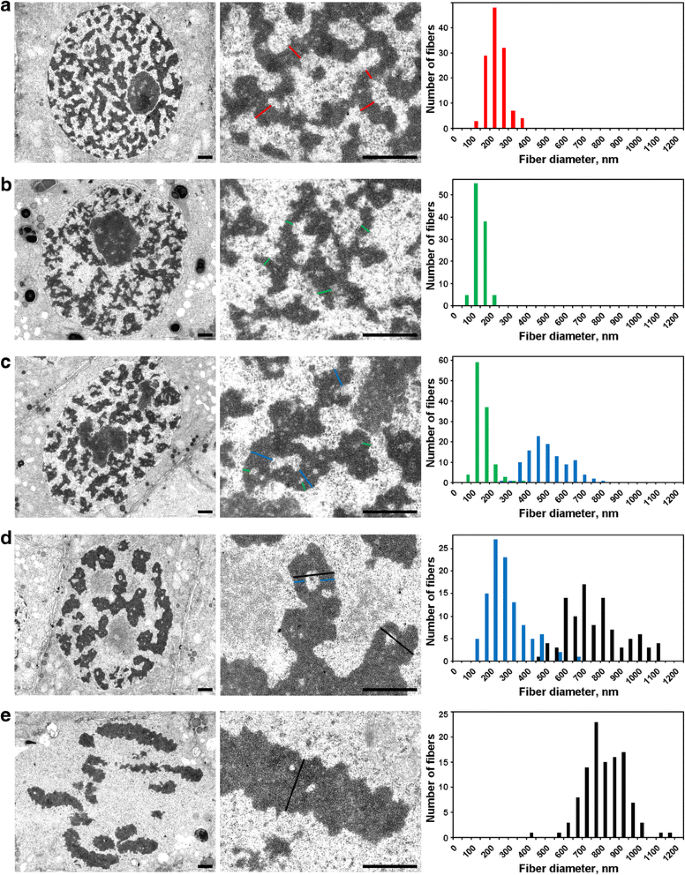
Morfometrie chromozomů N. damascena pomocí elektronové mikroskopie: kondenzace chromozomů od interfáze po metafázi. Levý a prostřední panel zobrazují ultrastrukturální uspořádání (celkový pohled a fragment), pravý panel zobrazuje histogramy znázorňující rozložení šířky chromozomů a chromatinových vláken. a Interfáze. b Předfáze. c Časná profáze. d Pozdní profáze. e Metafáze. Typické průřezy chromozomů a/nebo chromatinových vláken jsou vyznačeny barevnými čarami: červená – interfázní chromonemata (heterochromatin), zelená – chromonemata; modrá – „300 nm vlákna“; černá – chromozomy. Měřítka: 1 μm
(1) V předfázi byly chromozomy od sebe špatně odděleny a nemohli jsme přesně změřit jejich průměr (obr. 5b). Chromozomy v předfázi byly tvořeny vlákny o průměru 148 ± 30 nm (tab. 2), což pravděpodobně odpovídalo vláknům o průměru 100-130 nm (chromonema), která jsou hlavní chromozomovou substrukturou chromozomů v profázi a telofázi u živočišných buněk . Získaná data nám neumožnila určit identitu interfázních a mitotických chromonemat, ale dříve publikované údaje naznačují, že interfázní chromonemata jsou komplexy tvořené složenými chromonematy .
(2) Na počátku profáze došlo k oddělení chromozomů (obr. 5c). Průměr chromozomů byl 527 ± 107 nm a tyto chromozomy byly rovněž tvořeny chromonematy o průměru 158 ± 46 nm.
(3) Nakonec jsme analyzovali buňky pozdní profáze, které obsahovaly ztluštělé chromozomy o průměru 809 ± 185 nm (obr. 5d). Některé pozdní profázní chromozomy obsahovaly v axiálních oblastech dutiny, které nám umožnily rozlišit vlákna o průměru 285 ± 102 nm („300 nm vlákna“). Analýza pomocí označených segmentů chromozomů ukázala, že časné profázní chromozomy se skládají a vytvářejí silnější pozdní profázní chromozomy (obr. 4). Proto je možné předpokládat, že vlákna o velikosti 285 ± 102 nm a časné profázní chromozomy o velikosti 527 ± 107 nm byla stejná vlákna. Zmenšený průměr vláken může souviset se zhutněním chromatinu časných profázních chromozomů, na což poukazovalo i vymizení viditelných chromonemat.
Chromatin uvnitř metafázních chromozomů (obr. 5e) a anafázních chromatid (obr. 6a) byl silně zhutněný, a přestože v nich byly vidět vzácné dutiny bez chromatinu, přesné rozlišení případných fibrilárních substruktur nebylo možné. U časných telofázových chromozomů byly jasně detekovány dva typy dutin (obr. 6b). Velké dutiny se nacházely v axiální oblasti chromatid, což nám umožnilo identifikovat a změřit vlákna o průměru 422 ± 78 nm. V centrálních oblastech těchto vláken jsme detekovali malé dutiny, které umožnily identifikovat druhý typ vláken o průměru 182 ± 47 nm. První typ vláken by mohl odpovídat „300 nm vláknům“ uvnitř chromozomů v pozdní profázi, druhý typ by mohl odpovídat chromonematům.

Morfometrie chromozomů N. damascena pomocí elektronové mikroskopie: dekondenzace chromozomů od anafáze po G1-fázi. Levý a prostřední panel zobrazují ultrastrukturální uspořádání (celkový pohled a fragment), pravý panel zobrazuje histogramy znázorňující rozložení šířky chromatid a chromatinových vláken. a Anafáze. b Časná telofáze. c Pozdní telofáze. d G1-fáze. Typické průřezy chromozomů a/nebo chromatinových vláken jsou vyznačeny barevnými čarami: červená – interfázní chromonemata, zelená – chromonemata; modrá – „300 nm vlákna“; černá – chromatidy. Měřítka: 1 μm
V pozdní telofázi (obr. 6c) a G1-fázi (obr. 6c) se chromatomy nacházejí ve fázi G1. 6d), byly chromozomy dekondenzovány do chromozomových domén v dceřiných jádrech, kde je nelze snadno pozorovat. Přesto bylo možné identifikovat oddělené fragmenty chromatid. V této fázi byly chromatidy tvořeny vlákny o průměru přibližně 250 nm, což zhruba odpovídá průměru interfázních chromonemat. Toto pozorování spolu se zánikem chromonematických vláken naznačuje, že v této fázi mitózy se chromatinová vlákna přeložila a vytvořila interfázní komplexy kondenzovaného chromatinu
.