Úvod
Karcinom prostaty je nejčastější formou malignity a druhou nejčastější příčinou úmrtí na rakovinu u mužů.1 Kadaverózní studie ukazují, že možnost vzniku mikroskopických ložisek karcinomu prostaty se zvyšuje s věkem (30 % ve čtvrté dekádě života, 40 % v páté dekádě atd.).2
Některé nádory jsou agresivní, jiné mají malý nebo žádný metastatický potenciál.3 U mnoha mužů s karcinomem prostaty s nízkým rizikem nedojde během života k progresi ani ke klinickým symptomům.4 Vzhledem k této variabilitě byly zavedeny různé možnosti léčby, které nabízejí léčebné účinky srovnatelné s radikální prostatektomií (RP) a zároveň zachovávají sexuální funkce a kontinenci. V tomto případě může aktivní sledování (AS) nabídnout snížení morbidity a zlepšení kvality života.5 Ideálními kandidáty pro AS jsou malé, neagresivní nádory, i když nebylo dosaženo konsenzu. Nízkorizikové onemocnění je definováno jako Gleasonovo skóre (GS) 6 a prostatický specifický antigen (PSA)
ng/ml. Pacienti s klinickým stadiem >T2a jsou obvykle vyloučeni.6
Histologický stupeň je nezávislým faktorem určujícím prognózu onemocnění a přežití.7 Systém GS gradingu je nejrozšířenější klasifikací,8 ale mnoho studií prokázalo, že GS získané z biopsie prostaty ne vždy koreluje s konečným patologickým stupněm chirurgických vzorků. Zvýšení GS (zvýšení GS alespoň o jeden bod) bylo zaznamenáno až v 57 % případů.9,10 Chyby v přiřazení GS mohou vést k nevhodnému sledování biologicky agresivních nádorů nebo k výběru léčby s horší mírou vyléčení u vysoce rizikového onemocnění, což může mít v konečném důsledku negativní dopad na výsledky léčby pacientů.11 Několik nedávných studií proto hledalo faktory, které by mohly předpovídat zvýšení GS.12
Nízký objem prostaty (PV) a konkrétněji vysoká hustota prostatického specifického antigenu (PSAD) se v mnoha studiích ukázaly jako prediktory progrese rizika, což odráží možnost neodhaleného agresivního karcinomu.6 Několik studií prokázalo silný vztah mezi PSAD a agresivitou karcinomu prostaty.13 PSAD byl navržen jako silný prediktor zvýšení GS u pacientů s biopticky potvrzeným Gleasonovým onemocněním 6, ale neexistuje obecná shoda ohledně hraniční hodnoty.11-17
Hlavním cílem naší studie bylo identifikovat nezávislé prediktory pro GS upgrade a určit nejlepší hraniční hodnotu pro PSAD k identifikaci rizikových pacientů.
Materiál a metody
Informace pro studii jsme získali z prospektivně vedené databáze našeho nemocničního centra. Byli vybráni pacienti s klinicky lokalizovaným karcinomem prostaty, kteří podstoupili radikální prostatektomii (RP) a měli předoperační biopsii prostaty v časovém rozmezí od ledna 2004 do února 2015. Jako kritérium zařazení byl brán nález GS 3+3 při biopsii prostaty. Všechny klinické, zobrazovací, laboratorní a patologické informace byly získány z databáze a potvrzeny klinickými záznamy pacientů.
Zohlednili jsme předoperační věk pacienta, klinické stadium onemocnění, PSA před biopsií, předoperační PSAD, GS při biopsii, celkový počet odebraných bioptických jader a počet bioptických jader s karcinomem a analyzovali souvislost těchto faktorů s upgradem GS po RP. Pro každou proměnnou byly použity různé hraniční hodnoty, aby bylo možné identifikovat a kvantifikovat potenciální vztah s Gleasonovým upgradem. Analyzovali jsme také souvislost upgradu GS s proměnnými metabolického syndromu, jako je diabetes mellitus (DM), vysoký krevní tlak (HBP) a obezita, které jsme získali z klinických záznamů pacientů. Poslední proměnné byly zahrnuty, protože předchozí studie prokázaly jejich souvislost s horší prognózou a vyšší mírou recidivy.18,19
PSAD byl vypočten vydělením předoperační hodnoty PSA hodnotou PV. PV byla vypočtena transrektálním ultrazvukem pomocí maximálního příčného průměru (D1), maximálního předozadního průměru (D2) a maximálního podélného průměru (D3) podle vzorce D1×D2×D3×ϖ/6 založeného na teorii rozměrů elipsy prostaty.14 Biopsie prostaty byla provedena podle dříve popsaného protokolu naší nemocnice. Všichni pacienti byli mírně sedováni a 15 minut před zákrokem jim byla podána jedna i.v. dávka piperacilinu/tazobaktamu.20 K získání tkáně prostaty jsme použili jehlu ráže 18 s automatickou bioptickou pistolí. Při první biopsii bylo odebráno 12-18 jader v závislosti na velikosti prostaty a přítomnosti podezřelých uzlin.21 Všechny vzorky byly uloženy do samostatného kontejneru s označením příslušného místa a byly odeslány na patologii naší nemocnice.
Popisné statistiky byly prezentovány jako průměr ± směrodatná odchylka (SD) a medián/IQR pro spojité proměnné a jako absolutní četnost a procentuální rozdělení pro kategoriální proměnné. Pacienti pooperačně upgradovaní na GS 7 nebo vyšší byli porovnáváni s těmi, kteří upgradováni nebyli. Pro stanovení průměrných rozdílů a podobností byly kategorické proměnné porovnány pomocí Pearsonova chí-kvadrát testu a spojité proměnné pomocí testu mediánu a Studentova t testu. Pro zjištění významných nezávislých prediktorů povýšení byl použit jednorozměrný regresní test. Byla použita křivka ROC (receiver operating characteristic) a vypočtena plocha pod křivkou (AUC), která ukázala optimální mezní hodnotu pro proměnné s prediktivním významem pro upgrade GS. Odhadli jsme senzitivitu, specificitu, pozitivní prediktivní hodnotu a negativní prediktivní hodnotu různých hraničních hodnot navržených jinými autory, aplikovali je na naši populaci a poté je porovnali s naší hraniční hodnotou. Všechny testy byly dvouvýběrové a p hodnota
Výsledky
Z celkového počtu 342 pacientů v naší databázi bylo 144 (42,1 %) vyřazeno, protože měli v biopsii prostaty GS ≥4. V případě, že se jednalo o pacienty s GS ≥4, byla hodnota p
. Zůstalo tedy 198 (57,9 %) pacientů, kteří splňovali naše kritéria pro zařazení GS 6 (3+3). Sedmdesát tři z těchto pacientů bylo vyřazeno z důvodu neúplných klinických informací ze zdravotnické dokumentace.
Průměrný věk pacientů byl 65,1±6,3 let, index tělesné hmotnosti (BMI) byl 26,7±3,6 kg/m2, počet odebraných jader byl 13,4±3,5, počet pozitivních jader byl 2,5±2 a předoperační PSAD byl 0,26±0,23ng/ml2. Předoperační medián PSA byl 7,2 IQR 5,67-10,05 a PV byl 38 IQR 26,5-55,5. Klinické stadium na základě digitálního rektálního vyšetření bylo T1c u 86 (69,6 %) pacientů, T2a u 28 (22,4 %), T2b u 7 (5,6 %), T2c u 2 (1,6 %) a T3 u jednoho (0,8 %) pacienta.
Předoperační PSA bylo kategorizováno následovně: 6 (4,8 %) pacientů mělo hodnotu PSA
ng/ml, 88 (70,4 %) mělo hodnotu mezi 4 a 9,9ng/ml, 23 (18,4 %) mělo hodnotu mezi 10 a 19,9ng/ml a 8 (6,4 %) mělo PSA ≥20ng/ml. Bioptický GS a chirurgický GS zůstaly stejné u 71 (56,8 %) pacientů s GS 3+3, zatímco u 54 (43,2 %) pacientů došlo ke zvýšení. U 70 % pacientů s upgradem došlo ke zvýšení GS na 7 a u 30 % ke zvýšení na ≥8.
Tabulka 1 uvádí demografické a klinické charakteristiky pacientů s upgradem GS a bez něj. Zjistili jsme statisticky významnou korelaci mezi pooperačním upgradem a předoperační hodnotou PSAD (p0,001), předoperačním PSA (p=0,039), PV (p=0,004) a věkem pacienta ≥70 let (p=0.011).
Charakteristika pacientů s upgradem Gleasonova skóre po radikální prostatektomii a bez něj.
| Charakteristika | Upgrade | No upgrade | p-Value |
|---|---|---|---|
| Ne. pacientů (%) | 54 (43,2%) | 71 (56.8%) | |
| Věk (v letech) | |||
| Průměr±SD | 66.22±6,5 | 64,28±6,0 | 0,092b |
| Věk (ne.) | |||
| >70 let | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| průměr±SD | 26.22±4,0 | 27,14±3,1 | 0,178c |
| PSA (ng/ml) | |||
| Medián/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c |
| Objem prostaty (ml) | |||
| Medián/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Mean±SD | .36±.27 | .19±.16 | *,c |
| Bioptická jádra (č.) | |||
| Průměr±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Pozitivní jádra (počet) | |||
| Průměr±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c |
| Obezita (č.) | |||
| Pozitivní | 9 (16,6%) | 16 (22,5%) | 0.500a |
| Negativní | 45 (83,4%) | 55 (77.5%) | |
| DM (č.) | |||
| Pozitivní | 16 (29,6%) | 14 (19.7%) | 0,150a |
| Negativní | 38 (70,4%) | 57 (80.3%) | |
| HBP (č.) | |||
| Pozitivní | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Negativní | 33 (61,1%) | 41 (57.8%) | |
IQR: mezikvartilové rozpětí; BMI: index tělesné hmotnosti; PSA: prostatický specifický antigen; PSAD: hustota prostatického specifického antigenu; DM: diabetes mellitus; HBP: vysoký krevní tlak.
X2 test.
Studentův t-test.
Mediánový test.
Statisticky významné s hodnotou p
Odhadli jsme optimální hraniční hodnotu PSAD 0.17ng/ml2 pomocí ROC analýzy s AUC 0,675 (p=0,001, 95%CI .580-.770) a poté jsme analyzovali hraniční hodnoty navržené jinými autory a porovnali je. Tyto výsledky jsou uvedeny v tabulce 2 a na obr. 1.
Analýza různých hraničních hodnot PSAD jako prediktoru zvýšení GS.
| Upgrade | No upgrade | p | Odds poměr | Sens % | Spec % | PPV % | NPV % | ||
|---|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8%) | ||||||||
| PSAD (ne.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7%) | ||||||||
| PSAD (ne.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2%) | ||||||||
| PSAD (č.) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4%) | 49 (69%) | ||||||||
PSAD: prostatický specifický antigen.
X2 test.
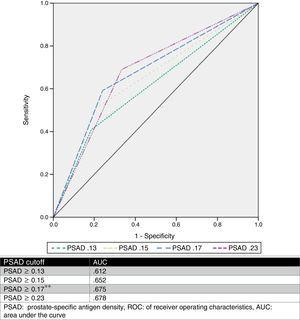
ROC křivka.
Tabulka 3 ukazuje výsledky z jednorozměrné regrese pro zjištění nezávislých prediktorů modernizace.
Nezávislé prediktory upgradingu (jednorozměrná regrese).
| Charakteristiky | HR | 95 CI | p hodnota |
|---|---|---|---|
| Věk | 0.5 | 0,99-1,11 | 0,09 |
| >70 let | 1.06 | 1,26-6,63 | 0,039* |
| BMI | 0,072 | 0,97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Objem prostaty | 0.02 | 1,01-1,04 | 0,008* |
| Pozitivní bioptická jádra | 0.06 | 0,98-1,18 | 0,24 |
| Obezita | 0,31 | 0.54-3,40 | 0,507 |
| DM | 0,61 | 0,79-4.27 | 0,152 |
| HBP | 0,10 | 0,53-2,29 | 0.775 |
BMI: index tělesné hmotnosti; PSA: prostatický specifický antigen; PSAD: hustota prostatického specifického antigenu; DM: diabetes mellitus; HBP: vysoký krevní tlak.
Diskuse
V několika studiích byla zjištěna neshoda mezi zprávou o GS z biopsie prostaty a zprávou z radikální prostatektomie. V nedávné metaanalýze zahrnující 14 839 pacientů autoři odhadli zlepšení GS u 30 % pacientů, přičemž pouze 63 % zůstalo po prostatektomii beze změny.22 Gleasonův upgrade byl zjištěn u 29-58 % případů23 a je horší v podskupině pacientů s bioptickým GS 3+3 (až 63,3 %).14 V našem nemocničním centru jsme zjistili GS upgrade u 42,1 % všech pacientů, kteří podstoupili radikální prostatektomii, a u 43,2 % pacientů s bioptickým Gleasonovým skóre 3+3.
Mnoho autorů se snažilo najít prediktory GS upgrade, zejména v souvislosti se současnou rostoucí popularitou protokolů AS. Dříve popsanými prediktory jsou věk >60 let, hodnota PSA >5,0 ng/ml a >25 % pozitivních jader při biopsii.24
PSAD byl analyzován a bylo popsáno několik hraničních hodnot (například ≥0,13 ng/ml, ≥0,15 ng/ml a ≥0,23 ng/ml).11,13,16,17 Nicméně neexistuje shoda ohledně použití této hodnoty k přesné predikci upgradu GS. Na základě našich výsledků jsme navrhli hraniční hodnotu ≥0,17ng/ml, která měla AUC 0,675, senzitivitu 75,9 %, specificitu 59,2 %, PPV 58,5 % a NPV 76,3 % pro predikci upgradu GS. Zvolili jsme tento hraniční bod, protože při analýze ostatních navržených hodnot ve vztahu k naší sérii případů bylo dosaženo nejlepší AUC s hodnotou ≥ 0,23ng/ml (0,678), která však měla horší senzitivitu a vysokou míru falešné negativity (33,33 %). Na druhou stranu, když jsme použili hodnoty ≥0,13ng/ml a ≥0,15ng/ml, měly 59%, resp. 49% míru falešné pozitivity. Míra falešně negativních a falešně pozitivních výsledků u hraniční hodnoty navržené naším týmem byla 24 %, resp. 41 %, což jsme považovali za nejužitečnější. Na obr. 2 je zobrazen graf naší populace.

Studovaná populace, znázorňující různé denzity prostatického specifického antigenu a údaje o upgradu.
Naše studie zahrnovala pouze pacienty s bioptickým GS 3+3, a to z důvodu důležitosti této proměnné při zvažování pacienta pro AS. Vzhledem k tomu, že při aktivním sledování se berou v úvahu i další faktory, nemůžeme prohlásit, že riziko zvýšení GS a PSAD jsou rozhodujícími proměnnými pro návrh terapeutické strategie, ale rozhodně se domníváme, že by měly být před rozhodnutím diskutovány. U pacientů s PSAD ≥ 0,17 ng/ml by mohla být s ohledem na riziko nedostatečné klasifikace indikována druhá biopsie za účelem potvrzení GS. MRI prostaty a fúzní biopsie pod kontrolou MRI prokázaly vysokou senzitivitu a specificitu pro lokalizaci neidentifikovaného významného karcinomu.25 Tyto možnosti však nejsou v Mexiku běžně dostupné, takže transrektální ultrazvukem navigovaná saturační nebo šablonová biopsie by mohla být schůdnější možností, jak zvýšit diagnostickou přesnost.26
Nejnovější důkazy naznačují souvislost mezi různými složkami metabolického syndromu a karcinomem prostaty, což zvyšuje riziko výskytu onemocnění a úmrtí na něj21 , stejně jako vyšší míru biochemické recidivy po radikální léčbě.22 V naší studii se však nepodařilo prokázat souvislost s upgradem Gleasonova skóre.
Rozptylujícím prvkem může být objem prostaty, který přímo souvisí s věkem. Při náhodné biopsii pod ultrazvukovou kontrolou u velké prostaty existuje potenciální riziko ponechání větších nedostatečně odebraných vzorků, což představuje vyšší riziko přehlédnutí významného nádoru.
AS přinesla slibné výsledky u pacientů s karcinomem prostaty s nízkým rizikem, kdy došlo ke zlepšení kvality života, zachování erektilní funkce a kontinence moči a dalších komplikací spojených s radikální léčbou.6 Existuje však riziko chybné diagnózy agresivního karcinomu a oddálení vhodné léčby, což ovlivňuje prognózu pacienta. Existuje mnoho kritérií pro výběr kandidátů na AS, přičemž nejčastěji se k tomuto účelu používají D’Amicova klasifikace rizika26 a Epsteinova kritéria27. První z nich nezahrnuje PSAD, ale v Epsteinových kritériích se navrhuje použití hraniční hodnoty ≥ 0,15 ng/ml. V naší nemocnici používáme velmi přísná kritéria a hraniční hodnota PSAD ≥0,17ng/ml bude zahrnuta jako součást diskuse při výběru možného kandidáta pro AS.
Retrospektivní charakter naší studie byl jejím hlavním omezením. Potenciální vzorek byl ještě více redukován kvůli neúplným údajům v klinických záznamech. Dalším omezením byla skutečnost, že jsme neměli k dispozici všechny údaje z bioptických vzorků, takže jsme nemohli analyzovat pacienty s úplnými kritérii AS. Nicméně při množství pacientů zařazených do studie jsme získali významné výsledky, které lze využít ke zvážení rizika upgradu GS u pacientů s GS 3+3.
Závěry
Dospěli jsme k závěru, že je důležité používat co nejvíce nástrojů k přesnému rozhodování a k identifikaci pacientů s vysokým rizikem patologického upgradu, kteří by mohli mít prospěch z pečlivějšího hodnocení a/nebo agresivní léčby. PSAD by měl být rutinně používán k identifikaci pacientů se zjevně nízkorizikovým karcinomem s rizikem upgradu GS, což povede k přesnějšímu výběru kandidátů na AS. Podle našich údajů se můžeme vyhnout potenciálně nesprávnému GS stagingu přibližně ve 43 % případů.
Zjistili jsme vysokou frekvenci upgradu GS v naší populaci. V naší studii byly hodnoty PSAD významně spojeny s upgradingem a nejpřesnější cut-off hodnota byla 0,17ng/ml2. Doporučujeme, aby ve všech nemocničních centrech bylo provedeno místní přezkoumání rizika upgradu GS a jeho potenciálních prediktorů před tím, než bude potenciálním kandidátům nabídnuto aktivní sledování.
Etická prohlášeníOchrana lidských a zvířecích subjektů
Autoři prohlašují, že pro účely této studie nebyly prováděny žádné pokusy na lidech ani na zvířatech.
Důvěrnost údajů
Autoři prohlašují, že v tomto článku nejsou uvedeny žádné údaje o pacientech.
Právo na soukromí a informovaný souhlas
Autoři prohlašují, že se v tomto článku neobjevují žádné údaje o pacientech.
Financování
Na realizaci tohoto článku nebyla získána žádná podpora jakéhokoli druhu.
Střet zájmů
Autoři prohlašují, že nejsou ve střetu zájmů, ani neobdrželi žádný sponzorský příspěvek na tuto studii.
Vyjádření autorů k této studii