
El zumo de limón sabe agrio porque contiene entre un 5% y un 6% de ácido cítrico y tiene un pH de 2,2. (alta acidez)
El pH (potencial de hidrógeno) es una escala de acidez de 0 a 14. Indica lo ácida o alcalina que es una sustancia. Las soluciones más ácidas tienen un pH más bajo. Las soluciones más alcalinas, tienen un pH más alto. Las sustancias que no son ácidas ni alcalinas (es decir, las soluciones neutras) suelen tener un pH de 7. Los ácidos tienen un pH inferior a 7. Los álcalis tienen un pH superior a 7.
El pH es una medida de la concentración de protones (H+) en una solución. S.P.L. Sørensen introdujo este concepto en el año 1909. La p corresponde al alemán potenz, que significa potencia o concentración, y la H al ion hidrógeno (H+).
Las sustancias alcalinas tienen, en lugar de iones hidrógeno, una concentración de iones hidróxido (OH-).
Indicadores de pH
Un indicador de pH es un compuesto químico que se añade en pequeñas cantidades a una solución para poder ver el pH (acidez o basicidad) de la misma. El indicador de pH es un detector químico de iones de hidronio (H3O+) o de iones de hidrógeno (H+). Normalmente, el indicador hace que el color de la solución cambie en función del pH.
Los indicadores típicos son la fenolftaleína, el naranja de metilo, el rojo de metilo, el azul de bromotimol y el azul de timol. Cada uno de ellos cambia de color en diferentes puntos de la escala de pH, y pueden utilizarse juntos como un indicador universal.
Otra forma es utilizar papel tornasol, que se basa en un indicador natural de pH. El papel puede indicar la fuerza de la sustancia química, si es un ácido más fuerte o una base más fuerte.
Algunos valores de pH comunes
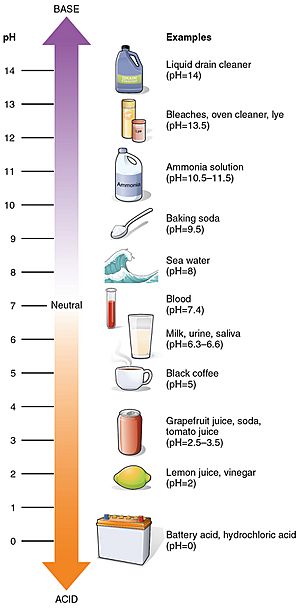
Valores de pH de algunas sustancias comunes
Neutralización
La neutralización se puede resumir con la ecuación:
H+ + OH- → H2O
(ácido + base → agua)
Páginas relacionadas
- Ácido
- Base
- Alcalino
- Titración
- Transpiración(Sreekanta Das).
Imágenes para niños
-
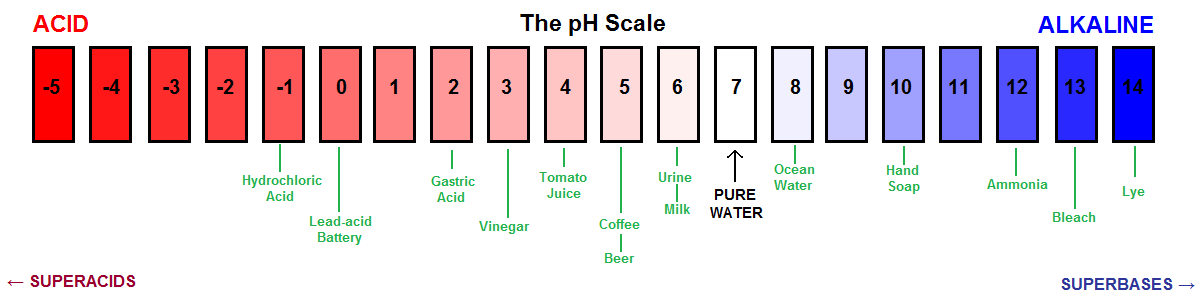
Otra representación visual de la escala de pH.
-

Rangos de referencia para análisis de sangre, mostrando la concentración de protones (púrpura) a la izquierda. Se puede ver que los rangos se mantienen en un rango estrecho, y que los protones libres se encuentran entre los compuestos con las concentraciones de masa más pequeñas.

Gráfico que muestra la variación del color del papel indicador universal con el pH