Dopamin ist eine organische Chemikalie aus der Familie der Katecholamine und Phenethylamine. Dopamin fungiert als Neurotransmitter im Gehirn.
Die dopaminerge Signalübertragung wird mit belohnungsmotiviertem Verhalten und motorischer Kontrolle in Verbindung gebracht, wobei Dysfunktionen des Dopaminsystems zu zahlreichen Krankheiten führen. So wird beispielsweise die degenerative Parkinson-Krankheit durch den Verlust von Dopamin-produzierenden Neuronen verursacht, was zu motorischen Beeinträchtigungen führt. Enzo Life Sciences bietet einen Dopamin-ELISA-Kit zur quantitativen Messung der Dopaminkonzentration in Serum, Plasma und Zellkulturüberständen an.
Erstmalige Entdeckung der Rolle von Dopamin als Neurotransmitter
Vor 1957 war die vorherrschende Meinung, dass 3-Hydroxytyramin ein Zwischenprodukt bei der Synthese von Noradrenalin und Adrenalin aus Tyrosin ist. Zwischen 1957 und 1959 führten jedoch parallele Bemühungen von Kathleen Montagu und ihren Kollegen im Hans Weil-Malherbe-Labor am Runwell Hospital (England) sowie von Arvin Carlsson und seinen Kollegen an der Universität Lund (Schweden) zu den ersten Erkenntnissen, die insgesamt auf die Rolle von Dopamin als Neurotransmitter im menschlichen Gehirn schließen lassen. Im August 1957 veröffentlichte Montagu die erste Arbeit, in der sie ihre Erkenntnisse über wichtige Neurotransmitter darlegte. Im Rahmen ihrer Forschungen untersuchte sie die Mengen an Noradrenalin, Adrenalin und 3-Hydroxytyramin aus extrahiertem Hirngewebe verschiedener Spezies (Ratte, Kaninchen, Meerschweinchen, Küken, Mensch und Frosch) mit einem säulenbasierten Assay. Montagu vermutete, dass es ein weiteres, dem Hydroxytyramin ähnliches Katecholamin geben könnte, das sie später durch Papierchromatographie der Eluate aus den Harzen, die sie für ihre extrahierten Hirngewebe verwendete, als 3,4-Dihydroxytyramin („Dopamin“) bestätigte. Im November 1957 stellte Carlsson fest, dass er die akinetischen Effekte, die Reserpin bei seinen Kaninchen auslöste, durch intravenöse Injektion des Dopamin- und Noradrenalinvorläufers 3,4-Dihydroxyphenylalanin (L-DOPA) rückgängig machen konnte und dass dies mit einer Erholung von Dopamin, aber nicht von Noradrenalin korrelierte. Diese Daten legten nahe, dass der Mangel an Dopamin für den akinetischen Zustand seiner Tiere verantwortlich sein könnte. Schließlich entwickelte Carlssons Gruppe einen Test, mit dem die Dopaminkonzentration im Gehirn gemessen werden konnte, und stellte fest, wo die höchste Dopaminkonzentration vorhanden war. Sie stellten fest, dass Dopamin in hohen Konzentrationen im Striatum, dem größten Teil der Basalganglien, zu finden war. Zu diesem Zeitpunkt war bereits bekannt, dass die Basalganglien eine Schlüsselrolle bei der Willkürmotorik spielen. Diese Erkenntnisse trugen dazu bei, die ersten Hypothesen zu formulieren, dass Dopamin ein wichtiger Neurotransmitter bei der Steuerung der motorischen Funktionen sein könnte.
Was ist Dopamin? Wo wird es im Gehirn produziert? Wie wird es hergestellt?
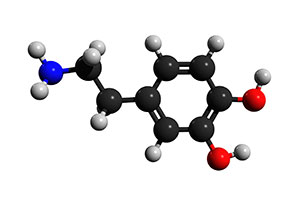
Abbildung 1: Molekül des Neurotransmitters Dopamin
Seit seiner ersten Entdeckung wurde Dopamin, das auch als 3,4-Dihydroxytyramin bekannt ist, umfassend charakterisiert. Es besteht aus einem Benzolring mit zwei Hydroxyl-Seitengruppen, die über eine Ethylgruppe an eine Amingruppe gebunden sind. Es wird von dopaminergen Neuronen im Gehirn aus Tyrosin hergestellt, indem eine Hydroxylgruppe hinzugefügt wird, die es in L-DOPA (oder Levo-DOPA) umwandelt, und anschließend eine Carbonsäuregruppe von der Ethyl-Seitenkette, die mit der Amingruppe verbunden ist, entfernt wird, wodurch Dopamin entsteht. Die dopaminergen Neuronen, die dieses Signalmolekül produzieren, befinden sich im Gehirn in der Substantia nigra und im ventralen tegmentalen Areal, die beide im Mittelhirn liegen, sowie im Arcuate Nucleus des Hypothalamus. Dopamin dient als Neurotransmitter – eine Chemikalie, die von Neuronen freigesetzt wird, um ein elektrisches Signal chemisch von einem Neuron zum nächsten zu übertragen und so ein Signal an das zentrale Nervensystem weiterzuleiten. Nach der Produktion von Dopamin wird der Neurotransmitter in einem synaptischen Vesikel, dem vesikulären Monoamintransporter 2 (VMAT2), verpackt und gespeichert, bis Aktionspotentiale die Freisetzung von Dopamin in den synaptischen Spalt auslösen und eine Bindung an Dopaminrezeptoren auf dem postsynaptischen Neuron bewirken.
Dopamin-Neurotransmitter binden an fünf Subtypen von Dopaminrezeptoren: D1, D2, D3, D4 und D5, die zur Familie der G-Protein-gekoppelten Rezeptoren gehören und in zwei große Unterklassen unterteilt werden: D-1-ähnlich und D-2-ähnlich. Durch die Bindung von Dopamin an diese Rezeptoren werden Signalkaskaden in Gang gesetzt, die für die Aktivierung von Funktionen in den entsprechenden Hirnregionen verantwortlich sind, in denen der jeweilige Rezeptortyp am häufigsten vorkommt. D1-artige Rezeptoren sind weiter verbreitet als D2-artige Rezeptoren. Um zu verstehen, wie Dopamin im menschlichen Gehirn als Neurotransmitter funktioniert, muss man die Wirkung der Bindung von Dopamin an D1-ähnliche und D2ähnliche Rezeptortypen untersuchen, die ihre Wirkung über Second-Messenger-Systeme entfalten. Die Bindung von Dopamin an D1-ähnliche Rezeptoren (D1 und D5) führt zur Erregung über die Öffnung von Na+-Kanälen oder zur Hemmung über die Öffnung von K+-Kanälen. Die Stimulation des D1-ähnlichen Rezeptors führt zur Aktivierung der Adenylatzyklase, des Enzyms, das ATP in cAMP umwandelt, wodurch der cAMP-Spiegel steigt, was zur Enthemmung der Proteinkinase A (PKA) führt, die nachgeschaltete Ziele wie das cAMP-regulierende Element (CREB) phosphoryliert. Die Verlagerung von CREB in den Zellkern und die CREB-abhängige Transkription zahlreicher Gene ist für die synaptische Plastizität verantwortlich, die für die Lern- und Gedächtnisbildung erforderlich ist. Im Gegensatz dazu führt die Bindung von D-2-ähnlichen Rezeptoren (D2, D3 und D4) zu einer Hemmung des Zielneurons, indem sie durch Kopplung an G-Proteine Gi/o die Adenylatzyklase hemmen, was die Produktion von cAMP verringert. Ob Dopamin erregend oder hemmend wirkt, hängt davon ab, welche Art von Wirkung auf ein Zielneuron ausgeübt wird, die darauf beruht, welche Arten von Rezeptoren sich auf der Membranoberfläche des Neurons befinden und wie das Neuron auf eine Erhöhung oder Verringerung der cAMP-Konzentration reagiert.
Was macht Dopamin im menschlichen Gehirn?
Dopamin spielt eine wichtige Rolle in der exekutiven Funktion, der motorischen Kontrolle, der Motivation, der Erregung, der Verstärkung und der Belohnung durch Signalkaskaden, die über die Bindung an dopaminerge Rezeptoren an den Projektionen in der Substantia nigra, dem ventralen tegmentalen Areal und dem Nucleus arcuatus des Hypothalamus des menschlichen Gehirns ausgeübt werden.
In der Substantia nigra projiziert die nigro-striatale Bahn dopaminerge Neuronen aus dem Eingangsbereich (der so genannten Pars compacta) in das dorsale Striatum und spielt eine primäre Rolle bei der Kontrolle der motorischen Funktion und dem Erlernen motorischer Fähigkeiten. Wenn die dopaminergen Neuronen in der nigro-striatalen Bahn degenerieren, führt dies zu einer Dysregulation der motorischen Kontrolle, die ein Kennzeichen der Parkinson-Krankheit ist.
Im ventralen tegmentalen Areal (VTA) projiziert die mesolimbische Bahn vom präfrontalen Kortex zum Nucleus accumbens der Amygdala, dem Gyrus cinguli, dem Hippocampus und dem pyriformen Komplex des Riechkolbens. Die dopaminergen Projektionen in der Amygdala und im Gyrus cingulare sind für die Emotionsbildung und -verarbeitung verantwortlich. Im Hippocampus wird das Vorhandensein dopaminerger Neuronen mit Lernen, Arbeitsgedächtnis und Langzeitgedächtnisbildung in Verbindung gebracht. Der pyriforme Komplex des Riechkolbens schließlich ist für den menschlichen Geruchssinn verantwortlich. Im mesolimbischen Pfad wird Dopamin in angenehmen Situationen freigesetzt, was zu Erregung führt und das Verhalten (die Motivation) beeinflusst, die angenehme Aktivität oder Beschäftigung zu suchen und sich an dopaminerge Rezeptoren im Nucleus accumbens und im präfrontalen Kortex zu binden. Erhöhte Aktivität in den Projektionen zum Nucleus accumbens spielen eine wichtige Rolle bei der Verstärkung und in extremeren Fällen bei Abhängigkeiten.
Im Nucleus arcuatus des Hypothalamus bilden Dopamin-Neuronen die tuberoinfundibuläre Bahn, die zur Hypophyse projiziert und die Sekretion des Hormons Prolaktin hemmt. Das von den Neuronen des Nucleus arcuatus produzierte Dopamin wird in den hypothalamo-hypophysären Blutgefäßen freigesetzt, die die Hypophyse mit Dopamin versorgen, um die Produktion von Prolaktin zu hemmen.
Quantitative Messung des Dopaminspiegels in Proben
Die Bewertung des Dopaminspiegels im Zusammenhang mit der Deregulierung von Funktionen in bestimmten Teilen des Gehirns ist ein attraktives Ziel für die neurowissenschaftliche Forschung. Enzo Life Sciences bietet einen Dopamin-ELISA-Kit an, bei dem es sich um einen kolorimetrischen kompetitiven Immunoassay handelt, der Dopamin in Serum, Plasma, Gewebehomogenaten und anderen biologischen Flüssigkeiten quantifizieren kann. Dieser Kit ist hochspezifisch für humanes Dopamin und weist eine vernachlässigbare Kreuzreaktivität zwischen dem Nachweis von humanem Dopamin und seinen Analoga auf. Dieser hochempfindliche Immunoassay hat einen Nachweisbereich, der von 1,56 ng/ml bis zu 100ng/ml reicht (Abbildung 1). Darüber hinaus wurde dieses Produkt mit hoher Empfindlichkeit, hoher Reproduzierbarkeit von Charge zu Charge und geringer Zeit bis zum Ergebnis entwickelt und bietet ein einfaches Protokoll, das zuverlässige, quantitative Ergebnisse für unsere Endanwender in weniger als 2 Stunden für bis zu 40 Proben in Doppelbestimmung liefern kann.
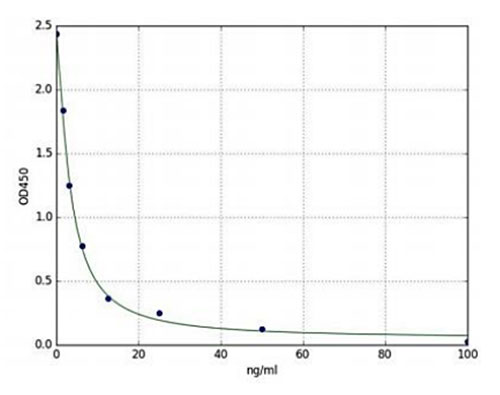
Abbildung 2: Standardkurve des Dopamin-ELISA-Kits (ENZ-KIT188), die eine typische Standardkurve (1,56 ng/ml-100ng/ml) zeigt.
Enzo Life Sciences bietet eine große Auswahl an Produkten für Ihre neurowissenschaftlichen und immunologischen Forschungsanforderungen. Wir bieten andere Neurotransmitter-Immunoassays wie unser Serotonin-ELISA-Kit und Histamin-ELISA-Kit sowie eine große Auswahl an Antikörpern zur Untersuchung von Neurotransmittern wie ACTH, ANP, BNP, CCK, CGRP, NPY, GABA, GLP-1 und Substanz P. Zum umfassenden Portfolio von Enzo gehört auch unsere SCREEN-WELL Neurotransmitter-Bibliothek, die 661 CND-Rezeptor-Liganden in einem 96-Well-Format enthält. Weitere Informationen finden Sie auf unseren Plattformen für Neurowissenschaften und Zellsignalisierung/Signaltransduktion. Für weitere Informationen wenden Sie sich bitte an unseren Technischen Support Service.