Die meisten Chemiker können die Artikel aufzählen, die ihr Leben geprägt haben. Für viele von uns sind die Cahn-Ingold-Prelog (CIP) Prioritätsregeln von 1966 einer der wichtigsten. Das Papier hat eine beeindruckende Anzahl von Zitaten, aber ebenso wichtig ist die Stabilität seiner Popularität: Sein praktischer Nutzen hat dafür gesorgt, dass es weiterhin von Generationen von Chemikern auf der ganzen Welt verwendet wird.
Die CIP-Regeln geben uns ein einfaches Instrument zur eindeutigen Beschreibung von Stereozentren an die Hand und sind somit ein wesentlicher Bestandteil unserer strengen Nomenklatur für Moleküle. Dennoch hinken die Regeln einigen Entwicklungen in der Chemie hinterher, insbesondere wenn es um supramolekulare Spezies geht.
Die kovalente chemische Bindung wird oft als Grundlage der CIP-Regeln angesehen, aber die nicht-kovalenten Wechselwirkungen, die für die supramolekulare Chemie so wichtig sind, führen auch zu stereogenen Zentren. Es ist klar, dass die Regeln verbessert werden können, aber wir sollten auch darauf achten, etwas, das bemerkenswert gut funktioniert, nicht unnötig zu verkomplizieren.
Die bestehenden Regeln berücksichtigen einsame Elektronenpaare – im Jahr 2004 hat die International Union of Pure and Applied Chemistry (Iupac) sie im Hinblick auf die Behandlung tetraedrischer Systeme mit einem Elektronenpaar integriert: „Ein einsames Elektronenpaar an einem Atom wie Stickstoff oder Schwefel hat die fiktive Ordnungszahl Null. Es ist also niedriger eingestuft als ein Wasserstoffatom“. Wir schlagen daher eine weitere, einfache Erweiterung der Prioritätsregeln vor, um das Problem der nicht-kovalenten Wechselwirkungen zu lösen.
Unser vorgeschlagenes System
Für Wechselwirkungen, an denen einsame Elektronenpaare beteiligt sind, schlagen wir vor, dem koordinierten einsamen Elektronenpaar eine fiktive Ordnungszahl zwischen 0 und 1 zuzuweisen (mit anderen Worten: größer als ein unkoordiniertes einsames Elektronenpaar, aber kleiner als ein Wasserstoffatom). Gibt es mehr als ein koordiniertes einsames Paar, werden sie nach dem Liganden gemäß den klassischen CIP-Regeln geordnet.
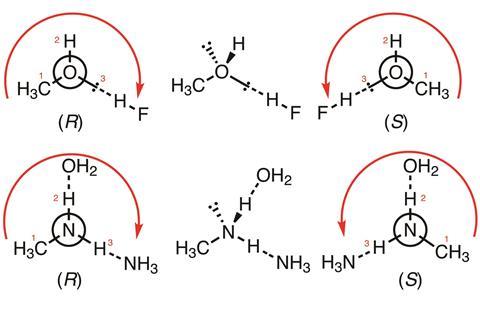
Die obigen Beispiele zeigen, wie die Prioritäten nach den vorgeschlagenen Änderungen der CIP-Regeln vergeben würden (gemäß den roten Linien und Zahlen)
Für Wechselwirkungen, an denen Atome beteiligt sind (z. B. H-Atome als Teil von Wasserstoffbrückenbindungen), erfolgt die Zuordnung nach denselben Regeln wie bei stereogenen Zentren; Somit hat eine Wasserstoffbindung oder eine andere nicht-kovalente Wechselwirkung höhere Priorität als Wasserstoff, und nicht-kovalente Bindungen werden nach der Ordnungszahl des Liganden (höchste bis niedrigste) geordnet.
Nachfolgend zwei einfache Beispiele, mit Pfeilen und Zahlen zur Angabe der Prioritätsreihenfolge. Im ersten Beispiel (CH3OH:HF-Komplexe) hat das koordinierende einsame Paar am Methanol eine mittlere Priorität zwischen dem nicht-koordinierenden einsamen Paar (das nach hinten zeigt) und dem Wasserstoffatom; im zweiten Beispiel (CH3NH2:NH3:OH2-Komplexe) hat der an Sauerstoff koordinierte Wasserstoff eine höhere Priorität als der an Stickstoff koordinierte. Beide haben eine höhere Priorität als das (rückwärts gerichtete) einsame Paar, aber eine niedrigere als die Methylgruppe.
Eine Verbindung richtig zu benennen bedeutet, sich bewusst zu machen, dass ein stereogenes Zentrum entstanden ist, und sich die Frage nach dem Ursprung der Chiralität zu stellen; außerdem führt das Vorhandensein eines zweiten, supramolekularen stereogenen Zentrums zu einem versteckten Diastereomerismus. Dieses einfache System ermöglicht es uns, supramolekulare Strukturen klar zu beschreiben und die Sprache der Chemie weiter zu verbessern.