US Pharm. 2008;33(3)(OTC suppl):4-7.
Asthma ist eine Lungenerkrankung, die durch eine reversible Atemwegsobstruktion und bronchiale Hyperreaktivität gekennzeichnet ist. Das zentrale Merkmal von Asthma ist eine Entzündung, die zu wiederkehrenden Episoden von Keuchen, Husten, Kurzatmigkeit und Engegefühl in der Brust führt.1,2 Das Ziel der Therapie ist es, die Krankheit unter Kontrolle zu bringen, um eine normale Lebensqualität zu erhalten.
Die Belastung durch Asthma hat in den letzten drei Jahrzehnten stetig zugenommen. Im Jahr 1970 litten etwa 3 % der Bevölkerung an Asthma, 1995 und 2005 waren es 5,5 % bzw. 7,7 %.3 Die letztgenannte Schätzung entspricht etwa 22,2 Millionen Amerikanern.2,3 Mit der Zunahme der Prävalenz dieser Krankheit in den Vereinigten Staaten steigen auch die Morbidität und Mortalität aufgrund von Asthma. Im Jahr 2004 wurden 1,8 Millionen Besuche in der Notaufnahme, 497.000 Krankenhausaufenthalte und 4.055 Todesfälle auf Asthma zurückgeführt.3
Behandlung auf der Grundlage der Asthmakontrolle
Das National Asthma Education and Prevention Program (NAEPP), eine Abteilung des National Heart, Lung, and Blood Institute, veröffentlicht Richtlinien für die Diagnose und Behandlung von Asthma, die zuletzt 2007 aktualisiert wurden.2 In den Richtlinien wird der Schweregrad von Asthma anhand der Symptome und der Häufigkeit der Einnahme von Medikamenten zur schnellen Linderung als intermittierend oder anhaltend eingestuft. Bei Personen mit intermittierendem Asthma treten die Symptome seltener auf, so dass sie seltener Medikamente zur schnellen Linderung benötigen und ihre normalen Aktivitäten nicht beeinträchtigt werden. Wenn das Asthma weniger gut kontrolliert ist, wird der Schweregrad des Asthmas als persistent eingestuft (siehe TABELLE 1).
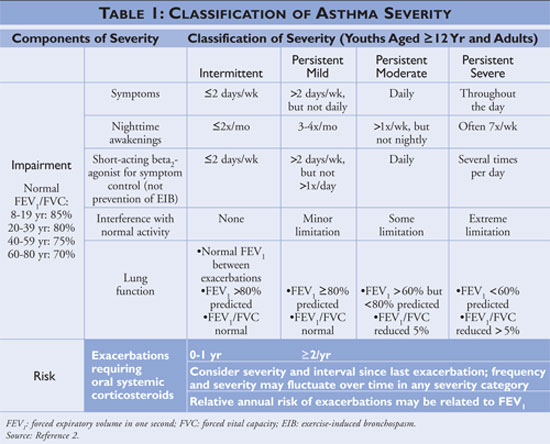
Die Leitlinien beschreiben die Eckpfeiler des Asthmamanagements als Selbstmanagementschulung, die Verwendung von Medikamenten zur schnellen Linderung und die Verwendung von Medikamenten zur langfristigen Kontrolle bei Personen mit persistentem Asthma. Gesundheitsdienstleister, die Schulungen zum Selbstmanagement anbieten, sollten die Patienten anleiten, Asthmaauslöser zu erkennen und nach Möglichkeit zu vermeiden, pharmakologische Therapien richtig anzuwenden und einen Asthma-Aktionsplan aufzustellen. Bei allen Patienten, bei denen Asthma diagnostiziert wird, sollten Medikamente zur schnellen Linderung eingesetzt werden. Bei Personen mit intermittierendem Asthma können sie als Monotherapie eingesetzt werden; bei Personen mit persistierendem Asthma sollten jedoch ein oder mehrere Medikamente zur Langzeitkontrolle in die Therapie aufgenommen werden. Zu den Medikamenten zur Langzeitkontrolle gehören inhalative Kortikosteroide, Leukotrien-Modifikatoren, langwirksame Beta-Agonisten und Theophyllin (siehe TABELLE 2).

In den Leitlinien wird auch darauf hingewiesen, dass etwa 30 % der US-Bevölkerung komplementäre und alternative Medikamente und Interventionen anwenden. Derzeit gibt es jedoch keine ausreichenden Beweise, um diese Behandlungsmethoden für Asthma zu empfehlen. Die Leitlinien raten von der Verwendung pflanzlicher Mittel zur Behandlung von Asthma ab, da es keine Daten zur Sicherheit und Wirksamkeit gibt.
Rezeptfreie Asthmaprodukte und ihre Regulierung
Rezeptfreie Asthmaprodukte sind seit den 1950er Jahren erhältlich, obwohl sich einige der Wirkstoffe im Laufe der Jahre erheblich verändert haben. Die derzeit verfügbaren rezeptfreien Wirkstoffe sind Ephedrin – mit oder ohne Guaifenesin – und Epinephrin. Theophyllin und Phenobarbital waren früher Wirkstoffe in nicht verschreibungspflichtigen Asthmaprodukten; beide werden jedoch jetzt als verschreibungspflichtige Produkte eingestuft.4
In den letzten drei Jahrzehnten hat die FDA Maßnahmen zur Regulierung nicht verschreibungspflichtiger Asthmabehandlungen ergriffen. Im Jahr 1976 kam die FDA zu dem Schluss, dass inhaliertes Epinephrin bei leichtem bis mittelschwerem Asthma schnelle und wirksame Linderung verschafft. Im Jahr 1982 kam sie in einer vorläufigen endgültigen Monographie erneut zu dem Schluss: „Epinephrin, Epinephrin-Bitartrat und Epinephrin-Hydrochlorid (racemisch; inzwischen umbenannt in Rasephrin-Hydrochlorid) in Dosieraerosol-Darreichungsformen mit Druckbeaufschlagung können bei Erwachsenen und Kindern ab 4 Jahren in einer Dosierung von 1 bis 2 Inhalationen einer Dosiermenge, die 0,16 bis 0,25 mg Epinephrin entspricht, für die rezeptfreie Anwendung allgemein als sicher und wirksam anerkannt werden.16 bis 0,25 mg Epinephrin pro Inhalation nicht öfter als alle 3 Stunden. „5,6
Im Jahr 1986 überprüfte die FDA Ephedrinprodukte zur Bronchodilatation und genehmigte diesen Wirkstoff als allgemein anerkannt sicher und wirksam für die rezeptfreie Anwendung. In jenem Jahr entschied die FDA, dass die Daten nicht ausreichten, um inhaliertes Epinephrin auf die verschreibungspflichtige Verwendung zu beschränken, und dass die Vorteile der nicht verschreibungspflichtigen Verfügbarkeit die Risiken überwiegen. Die FDA kam zu dem Schluss, dass eine erweiterte und überarbeitete Kennzeichnung den Verbrauchern zugute käme.5,6
Nach Berichten über lebensbedrohliche Vorfälle und Todesfälle, die auf nicht verschreibungspflichtige Kombinationspräparate mit Theophyllin zurückzuführen waren, erließ die FDA 1995 eine endgültige Entscheidung, dass diese Produkte weder sicher noch wirksam seien.7 Daher wurden Produkte, die eine Kombination aus Ephedrin und Theophyllin enthielten, eingestellt, und einige wurden so umformuliert, dass sie Ephedrin und Guaifenesin enthielten. Ebenfalls 1995 schlug die FDA vor, Ephedrin aufgrund seiner Rolle bei der Herstellung von Methamphetamin und Methcathinon und seiner missbräuchlichen Verwendung zur Gewichtskontrolle und Muskelstärkung vom Markt für rezeptfreie Produkte zu nehmen.7
Im Jahr 1996 änderte die FDA die endgültige Monographie von 1986, um den Monographiestatus für rezeptfreie Bronchodilatatoren aufzuheben.6 Stattdessen müssen die Hersteller neuer nicht verschreibungspflichtiger Dosieraerosole einen genehmigten Antrag einreichen, der Informationen enthält, die nicht in der Monographie enthalten sind.6 Derzeit vermarktete nicht verschreibungspflichtige Bronchodilatatoren waren von dieser Änderung nicht betroffen.
Trotz des Vorschlags der FDA, Ephedrin wegen seiner Verwendung als Grundstoff für die Methamphetaminherstellung vom Markt für nicht verschreibungspflichtige Arzneimittel zu nehmen, ist das Produkt weiterhin rezeptfrei erhältlich. Stattdessen wurde mit dem Combat Methamphetamine Epidemic Act von 2005, der 2006 in den Patriot Act aufgenommen wurde, ephedrinhaltigen rezeptfreien Produkten der Status der Freiverkäuflichkeit verliehen.8 Verbraucher, die ephedrinhaltige Produkte kaufen möchten, müssen nun in einer Apotheke einen amtlichen Lichtbildausweis vorlegen, da diese Produkte nicht mehr legal in Verbrauchermärkten oder Lagerhäusern ohne registrierte Apotheke verkauft werden.
Im Rahmen des weltweiten Schutzes der öffentlichen Gesundheit wurde ein internationales Abkommen geschlossen, um Produkte, die ozonabbauende Stoffe (ODS) wie Fluorchlorkohlenwasserstoffe (FCKW) in Dosieraerosolen enthalten, zu reduzieren und schließlich zu eliminieren. Diese Vereinbarung führte zum Montrealer Protokoll von 1987 und in der Folge zu den Änderungen des Luftreinhaltegesetzes von 1990.9-11 Die Vereinbarung sieht eine Ausnahmeregelung für die Verwendung von FCKW in Dosieraerosolen zur Asthmabehandlung vor, wenn die FDA die Verwendung des Produkts als wesentlich einstuft.12 Nicht verschreibungspflichtige Asthmamedikamente fallen weiterhin unter die Bestimmung der wesentlichen Verwendung. Im Jahr 2007 kündigte die FDA jedoch einen Vorschlag zur Aufhebung der Ausweisung für den wesentlichen Verwendungszweck von inhaliertem Epinephrin mit Wirkung zum 31. Dezember 2010 an.13 Die FDA verwendete die folgenden Kriterien, die in 21 CFR 2.125(g)(2) zu finden sind, um die Ausweisung für den wesentlichen Verwendungszweck von inhaliertem Epinephrin zu überprüfen: „(i): Es bestehen beträchtliche technische Hindernisse für die Formulierung des Produkts ohne ODS; (ii): Das Produkt wird einen nicht verfügbaren wichtigen Nutzen für die öffentliche Gesundheit erbringen; und (iii): Die Verwendung des Produkts führt nicht zu einer kumulativen Freisetzung signifikanter Mengen von ODS in die Atmosphäre, oder die Freisetzung ist angesichts des nicht verfügbaren wichtigen Nutzens für die öffentliche Gesundheit gerechtfertigt. „13 Die FDA nimmt derzeit Kommentare zu dieser Angelegenheit entgegen, bevor sie ihre endgültige Entscheidung trifft.
Sicherheit und Wirksamkeit nicht verschreibungspflichtiger Produkte
Wie die verschiedenen Vorschläge und Maßnahmen der FDA in Bezug auf den nicht verschreibungspflichtigen Status von Asthmaprodukten zeigen, gab es in den letzten Jahrzehnten viele Diskussionen über die Sicherheit und Wirksamkeit der Wirkstoffe in diesen Produkten. Obwohl diese Produkte nicht aktiv beworben werden, bedeutet ihre Verfügbarkeit, dass ihre Sicherheit und Wirksamkeit für die Verbraucher von entscheidender Bedeutung sind.
Ephedrin: Ephedrinprodukte mit einem einzigen Inhaltsstoff zur Verwendung als Bronchodilatatoren werden von der FDA seit 1986 als allgemein anerkannt sicher und wirksam angesehen.14 Ephedrin setzt Epinephrin aus dem Gewebe frei, das eine alpha-adrenerge und nichtselektive beta-adrenerge Rezeptoraktivität auslöst. Die Wirksamkeit von Ephedrin zur Bronchodilatation wurde in Studien aus den 1950er Jahren nachgewiesen. Zu den Eigenschaften, die Ephedrin als Bronchodilatator weniger wünschenswert machen, gehören ein langsamerer Wirkungseintritt als bei inhalativen Produkten (15 Minuten bis eine Stunde) und die Nichtselektivität der Betastimulation, die zu kardiovaskulären Nebenwirkungen beitragen könnte.15-17 Studien haben jedoch widersprüchliche Ergebnisse in Bezug auf kardiovaskuläre Nebenwirkungen gezeigt, die auf die Verwendung von Ephedrin in den angegebenen Dosen von 12,5 bis 25 mg zurückzuführen sind.16
Epinephrin: Epinephrin besitzt die gleiche alpha- und beta-adrenerge Rezeptoraktivität wie Ephedrin; daher bestehen die gleichen Bedenken hinsichtlich der Möglichkeit kardiovaskulärer Nebenwirkungen. Der Wirkungseintritt von inhalativem Epinephrin (15 Sekunden) ist wesentlich schneller als der von oralem Ephedrin, so dass es sich besser für die sofortige Linderung einer akuten Asthmaexazerbation eignet.6 Aufgrund seiner kurzen Wirkungsdauer (23 Minuten) kann es jedoch erforderlich sein, dass der Patient das Präparat wiederholt anwendet, um eine anhaltende Linderung zu erzielen, anstatt die Anweisungen auf dem Etikett zu befolgen, wonach nicht mehr als zwei Inhalationen innerhalb von drei Stunden erforderlich sind.6 Nicht verschreibungspflichtige Epinephrin-Inhalatoren scheinen bei Patienten mit leichtem, intermittierendem Asthma sicher und wirksam zu sein, wenn sie wie angegeben verwendet werden.5 Dies ist jedoch nach wie vor umstritten, da viele Gesundheitsdienstleister befürchten, dass Patienten, die auf nicht verschreibungspflichtige Inhalatoren angewiesen sind, möglicherweise kein angemessenes Krankheitsmanagement durch ein Gesundheitsteam erhalten, was zu schwerwiegenden Folgen führen kann.
Guaifenesin: Guaifenesin wird in Kombination mit Ephedrin zur Asthmabehandlung eingesetzt und gilt als sicher und wirksam, wenn das Produkt zur Behandlung von Husten im Zusammenhang mit Asthma zugelassen ist.14 Obwohl Guaifenesin ein von der FDA zugelassenes Schleimlösungsmittel ist, hat es keine bronchienerweiternde Wirkung. Daher bringt es keinen zusätzlichen Nutzen zum Ephedrinprodukt bei einer akuten Exazerbation.17
Verwendung von rezeptfreien Asthmaprodukten
Eine 1999 durchgeführte Umfrage von Wyeth Consumer Healthcare (WCH) ergab, dass etwa sechs Millionen (30 %) Personen mit Asthma Epinephrin-Inhalatoren verwenden.6 Die Selbstauskünfte der Befragten lassen vermuten, dass etwa 20 % dieser sechs Millionen als Personen mit leichtem bis mittelschwerem anhaltendem Asthma eingestuft würden, was nicht der angegebenen Verwendung dieses Produkts entspricht.5 In den NAEPP-Leitlinien wird die Verwendung von kurzwirksamen Beta-Agonisten zumindest bei Bedarf für alle Asthmapatienten empfohlen; inhalatives Adrenalin wird in den Leitlinien jedoch nicht ausdrücklich als Behandlungsmöglichkeit genannt.
Im Jahr 2005 führte die WCH eine Internet-Umfrage unter 330 Personen über die Verwendung von rezeptfreien Bronchodilatatoren zur Behandlung ihrer Symptome durch. Die WCH stellte fest, dass bei 92 % der Personen, die rezeptfreie Bronchodilatatoren verwendeten, Asthma diagnostiziert worden war, 91 % inhalatives Epinephrin nur bei einer akuten Asthmaexazerbation verwendeten, 31 % nicht krankenversichert waren und 38 % keine Versicherung für verschreibungspflichtige Medikamente hatten.6 Die WCH extrapolierte diese Ergebnisse und schätzte, dass etwa 5 % bis 10 % der Personen mit Asthma rezeptfreie Bronchodilatatoren als Monotherapie verwenden.6 Die Hauptgründe für die Verwendung nicht verschreibungspflichtiger Produkte – einfacher Zugang und geringere Kosten – stehen in direktem Zusammenhang mit den Bedenken der Gesundheitsdienstleister, dass Personen, die nicht verschreibungspflichtige Asthmaprodukte verwenden, möglicherweise keine angemessene Behandlung ihrer Krankheit erhalten.6
Diskussion
Zu den Eigenschaften, die bei der Behandlung von akutem Asthma wünschenswert sind, gehören die Wirksamkeit als Bronchodilatator, die Sicherheit bei bestimmungsgemäßer Einnahme, der schnelle Wirkungseintritt und die lange Wirkungsdauer. Sowohl inhaliertes Epinephrin als auch orales Ephedrin haben sich in jahrzehntelangen Studien als wirksam erwiesen. In Anbetracht der gemischten kardiovaskulären Ergebnisse in klinischen Studien ist die Sicherheit der Einnahme nicht verschreibungspflichtiger Bronchodilatatoren durch Personen, die möglicherweise nicht medizinisch überwacht werden, ein wichtiges Anliegen der Gesundheitsdienstleister. Inhaliertes Epinephrin hat einen schnelleren Wirkungseintritt als orales Ephedrin, aber seine kurze Wirkungsdauer kann seine Wirksamkeit einschränken.
Die Verfügbarkeit von oralem Ephedrin ist seit 2006 durch seinen Hinter-dem-Tresen-Status eingeschränkt. Die Verfügbarkeit von inhaliertem Epinephrin hängt von der Entscheidung der FDA ab, ob diese Formulierung ihren Status als Arzneimittel für den wesentlichen Verwendungszweck behalten wird. Für die derzeit auf dem Markt befindlichen FCKW-haltigen nicht verschreibungspflichtigen Bronchodilatatoren gibt es keine rezeptfreien Alternativen.12 Ein Hersteller hat versucht, sein nicht verschreibungspflichtiges inhalatives Epinephrin-Produkt mit einem Hydrofluoralkan-Treibmittel neu zu formulieren, was unerwünschte Auswirkungen für den Anwender hatte; er hat sich für die Neuformulierung mit einem anderen Pharmaunternehmen zusammengetan, um bis 2011 einen Antrag bei der FDA einzureichen.6 Zu den wichtigsten Bedenken hinsichtlich alternativer Treibmittel gehören die Notwendigkeit einer effektiven Abgabe von Epinephrin sowie Daten zur Sicherheit und Wirksamkeit des neuen Produkts infolge der Änderungen.18
Bei der Entscheidung über die Aufhebung der Ausweisung als „Essential Use“ für inhalatives Epinephrin untersucht die FDA nicht die Sicherheit oder Wirksamkeit der derzeit vermarkteten FCKW-haltigen Produkte, sondern die Auswirkungen auf die öffentliche Gesundheit, sollte die Ausweisung aufgehoben werden. In Briefen der National Association of Chain Drug Stores und der American Pharmacists Association an die FDA zum Vorschlag, die Kennzeichnung für den wesentlichen Verwendungszweck zu streichen, wurden vor allem die potenziellen negativen Auswirkungen auf die derzeitigen Nutzer von rezeptfreien Inhalatoren angesprochen, wenn diese Produkte nicht mehr verfügbar wären.19,20 Die FDA hat erklärt, dass die Verbraucher ein Rezept für ein alternatives Produkt einholen müssen, wenn die vorgeschlagene Regelung zur Streichung der Kennzeichnung für den wesentlichen Verwendungszweck endgültig wird und es keine rezeptfreien Alternativen gibt.12 Viele Verbraucher, die inhalatives Epinephrin verwenden, entscheiden sich möglicherweise dafür, auf eine Asthmabehandlung zu verzichten oder eine alternative, nicht verschreibungspflichtige Therapie zu wählen.
Es ist zwingend erforderlich, dass die medizinische Gemeinschaft die Öffentlichkeit auf die Ernsthaftigkeit der Folgen von unkontrolliertem Asthma aufmerksam macht und dass jede Person, die unter Atembeschwerden leidet, einen Arzt zur Diagnose und Behandlung aufsuchen sollte. Einem Patienten, der sich für die Verwendung rezeptfreier Bronchodilatatoren entscheidet, sollte geraten werden, seinen Arzt darüber zu informieren; der Patient sollte auch über den Unterschied zwischen rezeptfreien und rezeptpflichtigen Inhalatoren aufgeklärt werden. Die derzeitige Zugänglichkeit rezeptfreier Bronchodilatatoren macht eine informierte Beratung der Patienten erforderlich, um eine unsachgemäße Verwendung dieser Produkte und die daraus resultierenden unerwünschten Wirkungen zu verhindern.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Expert Panel Report 3: Leitlinien für die Diagnose und Behandlung von Asthma. National Asthma Education and Prevention Program. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: United States, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Zugriff am 10. Dezember 2007.
4. W. Steven Pray. OTC-Produkte und Asthma-Therapie. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalers for asthma: report of the Council on Scientific Affairs. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Verwendung von ozonabbauenden Stoffen: Bestimmung des wesentlichen Verwendungszwecks von rezeptfreien Epinephrin-Dosieraerosolen (OTC). Briefing-Dokument. December 19, 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Zugriff am 30. Dezember 2007.
7. Kupec IF. Theophyllinhaltige Bronchodilatatoren und Ephedrinpräparate. Answers T95-40. July 27, 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Zugriff am 10. Dezember 2007.
8. Drug Enforcement Administration. Allgemeine Informationen über den Combat Methamphetamine Epidemic Act of 2005 . May 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Zugriff am 4. Februar 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistische Erkenntnisse helfen bei der Suche nach FCKW-Ersatzstoffen: Risikobewertung von HFCKW-123 als Beispiel. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of „essential use exemptions“ for metered-dose inhalers under the Montreal Protocol. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. FDA News. FDA schlägt Ausstieg aus FCKW in Dosieraerosolen für Epinephrin vor. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Abgerufen am 10. Dezember 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Zugriff am 6. Februar 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, International drug scheduling; Convention on Psychotropic Substances. April 16, 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Zugriff am 30. Dezember 2007.
15. Lexi-Comp Online. www.crlonline.com. Zugriff am 28. Dezember 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Doppelblind-Vergleich der akuten bronchialen und kardiovaskulären Wirkungen von oralem Terbutalin und Ephedrin. Chest. 1975;68:155-161.
17. Dulfano MJ. Die neuen oralen Bronchodilatatoren . Chest.1975;68:133-134.
18. Erkältungs-, Husten-, Allergie-, bronchienerweiternde und antiasthmatische Arzneimittel zur rezeptfreien Anwendung beim Menschen; Änderung der Monographie für rezeptfreie bronchienerweiternde Arzneimittel. Fed Regist. 1996; 61:25142-25147.
19. National Association of Chain Drug Stores. Betrifft: Verwendung von ozonabbauenden Treibmitteln; Aufhebung der Kennzeichnung für wesentliche Verwendungszwecke für rezeptfreie Epinephrin-Dosieraerosole. January 6, 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Zugriff am 6. Februar 2008.
20. Stellungnahme der American Pharmacists Association (APhA) an den Beratungsausschuss für nicht verschreibungspflichtige Arzneimittel der Food and Drug Administration und den Beratungsausschuss für Arzneimittel gegen Lungenallergien. Verwendung von ozonabbauenden Stoffen: Bestimmung des wesentlichen Verwendungszwecks von OTC-Epinephrin-Dosierinhalatoren. January 24, 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Zugriff am 6. Februar 2008.
Für Kommentare zu diesem Artikel wenden Sie sich bitte an [email protected].