EINLEITUNG
Nach Torrent-Guasp und anderen Autoren1-6 besteht das ventrikuläre Myokard aus einem durchgehenden Muskelband, das sich von der Pulmonalarterienwurzel bis zur Aortenwurzel erstreckt, eine spiralförmige Struktur mit zwei Spiralen bildet und die beiden ventrikulären Hohlräume abgrenzt. Dieses Herzmuskelband setzt sich aus der „basalen Schleife“ und der „apikalen Schleife“ zusammen. Die basale Schleife ist überwiegend horizontal und teilt sich in ein linkes und ein rechtes Segment; die apikale Schleife ist überwiegend vertikal und besteht aus dem absteigenden und dem aufsteigenden Segment (Abbildung 1). Der Auswurf würde durch die aufeinanderfolgende Kontraktion des rechten basalen und des linken basalen Segments erfolgen, was zu einer Verengung der Herzbasis führt, gefolgt von der Kontraktion des absteigenden apikalen Segments. Dies wiederum führt zu einer Verkürzung der Längsdimensionen des Herzens, wodurch sich die Basis dem Apex nähert. Die ventrikuläre Füllung würde mit der Kontraktion des aufsteigenden apikalen Segments beginnen, begleitet von einer Längsverlängerung und gefolgt von der Entspannung der Ventrikelwände. Während des Herzzyklus bleibt der Apex stationär, während sich die Basis nach unten bewegt, was die Hauptursache für die Längsverkürzung und das Ausstoßen des Blutes ist, gefolgt von einer weiteren Aufwärtsbewegung, die auf das Ansaugen des Blutes aus dem linken Vorhof zurückzuführen ist.7-9
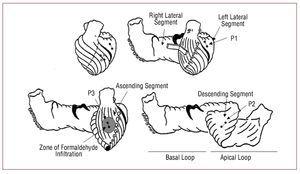
Abbildung 1. Diagramme mit den Segmenten des Herzmuskelbandes (Torrent-Guasp) und der Position der in das Herzmuskelgewebe implantierten Kristallpaare, dargestellt als kleine Kreise, die durch eine Linie verbunden sind. In der oberen linken Abbildung sind die Kristalle, die dem subendokardialen P2 (im absteigenden Segment der apikalen Schleife) entsprechen, durch offene Kreise dargestellt.
In der klassischen Lehre beginnt die Füllung des linken Ventrikels mit der ventrikulären Relaxation, einem aktiven, energieaufwendigen Prozess, der den intraventrikulären Druck auf weniger als den des linken Vorhofs reduziert. Der Druckunterschied bewirkt die Öffnung der Mitralklappe und den Beginn einer frühen schnellen Füllung. Als Faktoren, die diesen Mechanismus bestimmen, gelten die elastische Erholung, an der verschiedene Komponenten beteiligt sind, wie z. B. der Elastingehalt im Kollagen der extrazellulären Matrix10 oder das Protein Titin, das dem Sarkomer die Kraft für seine Erholung nach der während der Systole entstandenen Verformung zurückgibt11 , und die Entspannung der Myokardwand. Hämodynamisch gesehen macht dies 80 % des Füllungsvolumens aus und wird fast ohne Beteiligung atrialer Faktoren erzeugt.10
Schwer vorstellbar und nachzuweisen ist die Tatsache, dass die isovolumische Entspannungsphase und die anschließende schnelle Füllung eine Folge der Kontraktion des letzten Teils des Myokardbandes sind. Dies würde jedoch erklären, warum immer, wenn sich eine systolische Dysfunktion entwickelt, diese von einer diastolischen Dysfunktion begleitet wird, warum der Index T (die Zeitkonstante des Druckabfalls während der isovolumischen Kontraktionsphase) von der Kontraktilität abhängt und durch Isoproterenol verbessert wird,12 und sogar warum die diastolische Dysfunktion bei normaler oder „erhaltener“ systolischer Funktion eine Entität ist, deren Bedeutung, Identifizierung und Behandlung unklar bleibt.13-17
Die hier vorgestellten experimentellen Studien wurden mit dem Ziel durchgeführt, die myokardialen Mechanismen zu bestimmen, die am frühen diastolischen Transitralfluss beteiligt sind. Insbesondere wollten wir wissen, ob die Phase der schnellen ventrikulären Füllung ein Entspannungs- oder ein Kontraktionsprozess ist.18 Um diese Frage zu klären, werden wir untersuchen, ob die Kontraktion des aufsteigenden Segments der apikalen Schleife zeitlich mit der so genannten linksventrikulären isovolumischen Entspannungsphase zusammenfällt und ob die Induktion einer auf dieses Segment begrenzten Hypokinese oder Akinese einen negativen Einfluss auf den frühen transmitralen Fluss, die Geschwindigkeit des intraventrikulären Druckabfalls während der isovolumischen Phase und den im linken Ventrikel erreichten Mindestdruck hat.
METHODEN
Wir untersuchten 12 Schweine beiderlei Geschlechts mit einem Durchschnittsgewicht von 28,2 (5,1) kg. Sie waren in der Veterinärabteilung des Forschungszentrums unseres Krankenhauses gezüchtet worden. Die Experimente wurden in Übereinstimmung mit den spanischen und europäischen Richtlinien für den „Schutz von Tieren, die für Versuche und andere wissenschaftliche Zwecke verwendet werden“ (Königliches Dekret 223/1988 und Königliches Dekret 1201/2005) durchgeführt. Die chirurgischen Eingriffe wurden von Versuchsleitern durchgeführt, die im Besitz des europäischen Ausbildungszertifikats für Tierversuche sind (Königliches Dekret 1201/2005).
Vorbereitung der Versuche
Am Tag des Versuchs werden die Tiere in ihren Ställen durch intramuskuläre Injektion von Midazolam (0,5 mg/kg Körpergewicht) und Ketamin (10 mg/kg Körpergewicht) vornarkotisiert und sediert. Die Narkose wird im Operationssaal intravenös eingeleitet (Thiopental, 10 mg/kg Körpergewicht), und es werden eine endotracheale Intubation und eine Katheterisierung der Vena jugularis externa durchgeführt. Die Anästhesie wird mit Sevofluran (2,5 %) in einem Gemisch aus 40 % Sauerstoff und 60 % Lachgas aufrechterhalten, das über ein Beatmungsgerät (Temel VT3, Spanien) verabreicht wird. Analgesie und Entspannung werden mit Vecuroniumbromid (0,08 mg/kg Körpergewicht) und Morphinhydrochlorid (0,7 mg/kg Körpergewicht) eingeleitet und mit Vecuroniumbromid (0,08 mg/kg Körpergewicht) und 20 mg Morphinhydrochlorid in 50 ml Serum in einer Infusionspumpe mit einer Rate von 12 ml/h aufrechterhalten. Es wird eine mediane Sternotomie durchgeführt, gefolgt von einer Perikardektomie. Die mechanische Beatmung wird auf eine Frequenz zwischen 16 und 20 Atemzügen pro Minute und auf einen Gasfluss von etwa 5 l/min eingestellt, je nach den Oximetriewerten im Blut. Das periphere Elektrokardiogramm, der pH-Wert des Blutes, die Blutgase, der Hämatokrit und die Rektaltemperatur werden während des gesamten Experiments überwacht. Die Temperatur wird mit einer Heizdecke aufrechterhalten.
Segmentale Funktion
Drei Paare von Ultraschall-Mikrokristallen (Biopac Systems, Santa Barbara, Kalifornien, USA) werden in das Myokard implantiert: ein Paar im Mesokard (in einer Tiefe von ca. 4 bis 5 mm) des seitlichen Aspekts der linken Herzkammer entsprechend der basalen Schleife, linkes Seitensegment (P1), in Richtung der Längsachse des Herzens; ein weiteres Paar im Subendokard des vorderen Aspekts des mittleren Drittels der linken Herzkammer, zwischen dem ersten und zweiten diagonalen Ast der vorderen absteigenden Arterie und tangential dazu, eine Zone entsprechend dem absteigenden Segment der apikalen Schleife (P2); und schließlich ein weiteres Paar im Subepikard (in einer Tiefe von 1 bis 2 mm) der vorderen Seite des linken Ventrikels, zwischen dem ersten und zweiten diagonalen Ast der Arteria descendens anterior und parallel zur Arteria descendens anterior in Richtung Aortenwurzel, in einem Bereich, der dem aufsteigenden Segment der apikalen Schleife entspricht (P3) (Abbildung 1). Die Mikrokristallpaare sind in der Richtung der Muskelfasern des Bereichs, in dem sie platziert sind, ausgerichtet. Sie haben einen Abstand von etwa 2 cm. Die P2-Paare werden mittels transseptaler Punktion im Subendokard verankert, wobei sie in die Herzkammer gelangen und zurückgezogen werden, um sie im Subendokard zu deponieren und mit den P3-Paaren im Subepikard ein Kreuz zu bilden. Die Kristallpaare ermöglichen es uns, die relative Verschiebung der beiden Punkte im Myokard, an denen sie befestigt sind, und somit die dynamischen Eigenschaften des dazwischen liegenden Segments zu erkennen. Die Erfassung der regionalen Myokardkontraktilitätskurven erfolgt mit dem digitalen Ultraschallmesssystem der Sonometrics Corporation (London, Ontario, Kanada).
Intrakavitäre Drücke
Zur Überwachung des linksventrikulären Drucks wird ein Katheter durch die freie Wand des linken Ventrikels und zur Messung des linksatrialen Drucks ein weiterer Katheter durch die Auricula eingeführt; beide Katheter sind an Druckwandler (Transpac IV, USA) angeschlossen.
Aortenfluss
Die Aortenwurzel wird präpariert und ein elektromagnetischer Flussmesser platziert (Transonic Systems, New York, USA).
Transmitraler Fluss
Ein Doppler-Echokardiogramm wurde mit einer 5-MHz-Sonde direkt über dem Epikard durchgeführt (Interspec XL Doppler, USA), um den transmitralen Fluss aus der apikalen Vier-Kammer-Ansicht aufzuzeichnen, zunächst unter Ausgangsbedingungen und dann nach Injektion von verdünntem Formaldehyd in die Myokardwand.
Induktion der segmentalen Akinese
Dazu wird mit einer atraumatischen Nadel 2,5 % verdünntes Formaldehyd19 in das Subepikard (in einer Tiefe von 1 bis 2 mm) des aufsteigenden Segments der apikalen Schleife injiziert, wo sich die P2-Kristallpaare befinden. Es werden maximal 0,8 ml der angegebenen Verdünnung injiziert, verteilt auf 3 und 4 Injektionen. Nach jeder Injektion wird die Wirkung auf den Anteil der Segmentverkürzung überwacht, bis eine Akinese oder Dyskinesie in dem betreffenden Segment erreicht ist.
Datensammlung
Die Datensätze entsprechen: EKG (I, II oder III), linksventrikulärer Druck in mm Hg, linksatrialer Druck in mm Hg, Aortenfluss (ml/min) und sonometrische Daten der drei angegebenen Myokardbandsegmente werden digitalisiert und in einem elektronischen Speicher (BIOPAC Systems Inc, Santa Barbara, Kalifornien, Vereinigte Staaten) gespeichert. Die Kurven der transmortalen Flussgeschwindigkeit und die mit der Doppler-Echokardiographie erhaltenen Werte (m/s) werden separat gespeichert.
Nach Abschluss der Experimente werden die Tiere in Narkose durch eine intravenöse Injektion von Kaliumchlorid getötet. Nach der Entfernung der anatomischen Struktur (des Herzens) wird die anatomische Lage der drei Kristallpaare überprüft, die vordere linke Ventrikelwand wird entlang des Verlaufs der Arteria interventricularis aufgeschnitten, und die Tiefe, in der jeder Kristall implantiert ist, wird überprüft, ebenso wie der Bereich des mit Formaldehyd infiltrierten Muskels.
Analysierte Parameter
Im Doppler-Echokardiogramm werden die maximalen transitorischen Flussgeschwindigkeiten zu Beginn (E) und am Ende (A) der Diastole sowie das E/A-Verhältnis untersucht. Die intrakavitären Druckkurven liefern den maximalen linksventrikulären systolischen Druck, den minimalen linksventrikulären Druck, den linksventrikulären enddiastolischen Druck (LVEDP), die Zeit, die vom Schließen der Aortenklappe bis zum Überschreiten des intraventrikulären Drucks über den enddiastolischen Druck um 10 mm Hg vergeht, was der isovolumischen Relaxationszeit12 entspricht; an diesem Punkt können wir sicher sein, dass es sich um die isovolumische Phase mit noch geschlossener Mitralklappe handelt. Die Segmentfunktionskurven geben Aufschluss über die Verkürzungsfraktion, und die Aortenflusskurven zeigen den mittleren Aortenfluss und die zeitliche Beziehung zwischen dem Ende der Kontraktion jedes der drei Segmente (P1, P2 und P3) und der Einstellung des Aortenflusses (Zeit Aortenverschluss-Kontraktion P1, P2, P3). Alle diese Parameter werden vor und nach der Injektion von Formaldehyd in das aufsteigende Segment analysiert. Die Verkürzungsfraktion wird nach jeder Formaldehydinjektion gemessen, bis eine adäquate Veränderung im injizierten Segment nachgewiesen ist.
Analyse der Ergebnisse
Die untersuchten Variablen sind kontinuierlich, und die Ergebnisse werden als Mittelwert plus oder minus der Standardabweichung angegeben. Es wurden die Veränderungen der Variablen nach der Blockade mit Formaldehyd im Vergleich zu den Ausgangsbedingungen untersucht. Der Vergleich der Mittelwerte erfolgte mit dem Student-t-Test für gepaarte Stichproben oder dem nichtparametrischen Mann-Whitney-Test für Daten, die keine Normalverteilung aufwiesen. Ein P-Wert von weniger als 0,05 wurde als signifikant angesehen. Es wurde das Statistikpaket SPSS (Version 9.0) verwendet.
ERGEBNISSE
Hämodynamische Veränderungen (Tabelle 1)
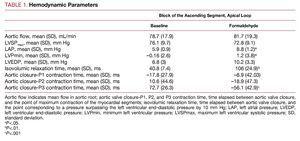
Die Injektion von Formaldehyd verlängert signifikant die Zeit, die erforderlich ist, um den linksventrikulären enddiastolischen Druck nach dem Aortenklappenverschluss um 10 mm Hg zu überschreiten, erhöht den minimalen linksventrikulären Druck, der in der frühen Diastole erreicht wird, indem von negativen zu positiven Drücken gewechselt wird, erhöht – wenn auch nicht in sehr signifikanter Weise – den LVEDP und erhöht signifikant den mittleren Vorhofdruck. Es gibt keine unmittelbaren signifikanten Veränderungen des Aortenflusses oder des linksventrikulären Drucks während der Systole (Abbildung 2).
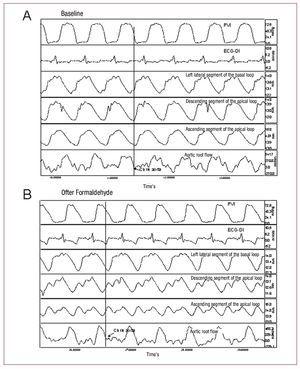
Abbildung 2. Aufzeichnung des linksventrikulären Drucks (PVI); Elektrokardiogramm (EKG-DI); segmentale Kontraktilität im linken lateralen Segment der basalen Schleife, im absteigenden Segment der apikalen Schleife und im aufsteigenden Segment der apikalen Schleife; und Aortenwurzelfluss unter Ausgangsbedingungen (A) und nach Formaldehyd-Injektion (B). Die Pfeile zeigen die Punkte an, die dem Aortenklappenschluss entsprechen. Die durch die Injektion von Formaldehyd induzierten Veränderungen werden im Text beschrieben.
Ende der Myokardkontraktion und Beginn der Diastole
Um den Beginn der isovolumischen Entspannungsphase zu bestimmen, haben wir den Zeitpunkt ermittelt, an dem der Blutauswurf in der Aortenflusskurve und die segmentale Kontraktionsphase in den entsprechenden sonometrischen Kurven aufhört (Abbildung 2).
In allen Experimenten befand sich das aufsteigende Segment (P3) in der Kontraktionsphase, nachdem der Aortenfluss aufgehört hatte und die Aortenklappe geschlossen war. Die Kontraktion des letzten Myokardsegments endete im Mittel 72,7 (26,3) ms nach dem Schließen der Aortenklappe, was mit der so genannten isovolumischen Relaxationsphase in der frühen Diastole zusammenfiel (Abbildung 2), während das absteigende Segment (P2) die maximale Kontraktion 10,6 (44,6) ms nach dem Schließen der Aortenklappe erreichte und das Ende der Kontraktion des P1-Segments (basale Schleife) dem Schließen der Aortenklappe vorausging (Tabelle 1).
Transmitralfluss
Tabelle 2 zeigt den Effekt, den die Injektion von Formaldehyd in das aufsteigende Segment der apikalen Schleife auf die Verkürzungsfraktion des überwachten Segments hat. Im injizierten Segment (P3, aufsteigendes Segment) kommt es zu einem Rückgang der Dyskinesie (gemäß Protokoll) und im benachbarten Segment, dem absteigenden Segment (P2) der apikalen Schleife, zu einer Hypokinesie. Die Zonen, die dem linken lateralen Segment der basalen Schleife (P1) entsprechen, sind nicht verändert. Parallel dazu ist der transitorische Fluss betroffen, mit Veränderungen der ventrikulären Füllungsraten in der frühen Diastole und des E/A-Verhältnisses; die E-Welle nimmt ab, während die A-Welle zunimmt, wobei das E/A-Verhältnis signifikant reduziert ist (P
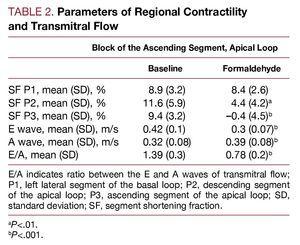
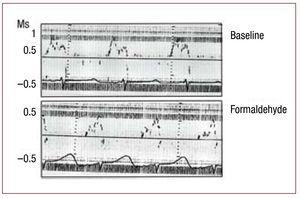
Abbildung 3. Unmittelbare Veränderungen der transmitralen Flussrate, gemessen mittels Doppler-Echokardiographie, sekundär zur Infiltration mit 2,5%igem Formaldehyd im aufsteigenden Segment der apikalen Schleife. Abbildung zur Reproduktion korrigiert.
DISKUSSION
Wenn der Ventrikel aufhört, das Blut auszustoßen, endet die Systole und die Diastole beginnt. Von diesem Moment an und bis zur Öffnung der Mitralklappe gibt es einen Zeitraum, in dem beide Klappen geschlossen sind, was als isovolumische Entspannungsphase bezeichnet wird. Während dieser Phase fällt der intraventrikuläre Druck mit einer konstanten Rate12 und führt zu transmuralen und transvalvulären Druckgradienten zum Kammerinneren. Es entsteht ein Saugeffekt, auf den die Schnelligkeit der frühen ventrikulären Füllung unmittelbar zurückgeführt wird und dessen vollständiger oder teilweiser Verlust eine Ursache der linksventrikulären diastolischen Dysfunktion ist, dem pathophysiologischen Substrat der Herzinsuffizienz mit erhaltener systolischer Funktion.
In der klinischen Praxis16,20,21 hängt die Diagnose einer Herzinsuffizienz aufgrund einer diastolischen Dysfunktion von drei Bedingungen ab: dem Vorhandensein von Anzeichen oder Symptomen einer Herzinsuffizienz, einer normalen oder leicht verringerten linksventrikulären Auswurffraktion und einem erhöhten linksventrikulären Füllungsdruck. Der letztgenannte Faktor wirkt sich aus und kann in der linksventrikulären Füllungskurve des Doppler-Echokardiogramms, in der Verlängerung der isovolumischen Relaxationsperiode, in der Abnahme der frühen diastolischen Geschwindigkeit (E), in der Verlängerung der Verzögerungszeit, in der Zunahme der enddiastolischen Geschwindigkeit (A) und in der Verringerung des E/A-Verhältnisses gemessen werden.
Die Herzkammerfüllung, die die diastolische Zeit bestimmt, wurde bis 1954 der Vorhofkontraktion zugeschrieben.3,4 Heute ist anerkannt, dass der linke Ventrikel aktiv an der oben erwähnten Saugkraft beteiligt ist. Es handelt sich um einen aktiven Prozess22,23 , der Energie verbraucht und einen Ca2+-Austausch beinhaltet. Einige Autoren betrachten die Diastole als eine Folge der Dehnung der Herzmuskelfasern an den Wänden einer geschlossenen Kammer. Es handelt sich um ein Phänomen, das mit der Muskelentspannung (Trennung der Myosinfilamente) und der elastischen Erholung der Fasern zusammenhängt, wobei das in einem Kollagennetz enthaltene Elastin, das das extrafibrilläre Bindegewebe bildet, sowie das Protein Titin als Element der Erholung des während der Systole verformten Sarkomers eingreifen.10,11 Die ventrikuläre mechanische Aktivierung während der Diastole ist heterogen, mit subendokardialen-subepikardialen Entspannungsgradienten zu Beginn der Diastole.22,24,25
In der Theorie von Torrent-Guasp handelt es sich um ein systolisches Phänomen, das mit der Muskelkontraktion zusammenhängt.23,26 Der Auswurf des Blutes ist eine Folge der Kontraktion des absteigenden Segments der apikalen Schleife; seine Kontraktion „schraubt“ die Basis über den Apex und zieht die beiden Teile näher zusammen. Das nächste und letzte Segment des Muskelbandes ist das aufsteigende Segment der Scheitelschleife, das das absteigende Segment bedeckt und das Epikard des vorderen Aspekts bis zur Aortenwurzel bildet, und das durch die Kontraktion des vorhergehenden Segments „gestreckt und aufgerollt“ worden ist. Wenn es sich zusammenzieht, macht das aufsteigende Segment eine Bewegung, die die Basis „abschraubt“ und sie vom Apex wegbewegt, wodurch sich die Längsachse des Herzens vergrößert und ein Sog entsteht, wie er im Inneren eines Zylinders auftritt, der sich von seinem Kolben wegbewegt, eine Dynamik, die beim Menschen in Magnetresonanzbildern beobachtet wurde.27
In dieser Studie haben wir Daten beigesteuert, die zeigen, dass die Saugkraft, die während der isovolumischen Entspannungsphase erzeugt wird, von der Kontraktion abhängt, weil sie während der Phase der segmentalen Kontraktion erzeugt wird, und außerdem, dass ihre Funktionsweise stark mit der Kontraktion des aufsteigenden Segments der apikalen Schleife verbunden ist, speziell:
1. Wir haben gezeigt, dass zu Beginn und während der linksventrikulären isovolumischen Entspannungsphase das aufsteigende Segment der apikalen Schleife kontrahiert.
2. Die Infiltration des aufsteigenden Segments der apikalen Schleife mit verdünntem Formaldehyd wirkt sich direkt auf die Fähigkeit zur Senkung des intraventrikulären Drucks oder, mit anderen Worten, auf die Saugkraft aus. Dieser Aspekt wurde durch die Verlängerung der Zeit nachgewiesen, die der intraventrikuläre Druck benötigt, um auf 10 mm Hg über dem enddiastolischen Druck zu fallen, ein Niveau, das es uns ermöglicht, sicherzustellen, dass die Mitralklappe noch geschlossen ist und dass die geringere Geschwindigkeit (d. h. mehr Zeit verstrichen ist) beim Druckabfall in einer geschlossenen (isovolumischen) Kammer liegt. Es wurde auch durch den niedrigeren minimalen intraventrikulären Druck in der frühen Diastole erreicht, die erheblich beeinträchtigt wird, wenn wir das aufsteigende Segment infiltrieren.
3 Als Folge einer geringeren Fallgeschwindigkeit und eines weniger ausgeprägten Endabfalls des intraventrikulären Drucks während der isovolumischen Phase ist der Saugeffekt geringer und die ventrikuläre Füllungsrate nimmt während der frühen Diastole ab und steigt zum Ausgleich während der Enddiastole als Folge einer Kontraktion des „volleren“ linken Vorhofs. Dies wurde durch die Veränderungen der Werte von E, A und des E/A-Verhältnisses sowie durch den progressiven Anstieg des Vorhofdrucks, der in der frühen Diastole beginnt, nachgewiesen.
Grenzen der Studie
Die Verwendung von Ultraschallkristallen ist geeignet, wenn man davon ausgeht, dass die Struktur des Herzmuskels teilweise oder ganz in einem Band organisiert ist und dass wir die Ultraschallkristalle in derselben Linie implantiert haben, die die Bewegungsrichtung der Fasern markiert. Diese Methode ist nicht in der Lage, die Funktion eines einzelnen Segments zu isolieren, da es Teil desselben Kontinuums wie die anderen ist. So würde die Veränderung eines bestimmten Segments die Kontraktion im gesamten Band verändern, wie es in unserem Modell der Fall ist, in dem die Injektion in das aufsteigende Segment auch die Kontraktion der in P2 enthaltenen Fasern signifikant verändert, die als zum absteigenden Segment gehörend identifiziert wurden, das dem injizierten Segment benachbart ist.
Für die Identifizierung der Segmente und der Richtung ihrer Fasern sowie die postmortale Bestätigung in den anatomischen Proben wurden wir von Dr. Torrent-Guasp beraten. Die subendokardialen Fasern des absteigenden Segments in der Zone des vorderen Aspekts des linken Ventrikels durchqueren das Mesokard in einer bestimmten Tiefe und kreuzen sich senkrecht mit denen des aufsteigenden Segments,28 ein Umstand, den wir in den anatomischen Präparaten bestätigt haben. Aus diesem Grund folgten die im Subendokard verankerten Kristalle einer Richtung, die das im entsprechenden Epikard (aufsteigendes Segment) implantierte Paar senkrecht kreuzte.
Die durch die Injektion von verdünntem Formaldehyd hervorgerufene Muskelbeteiligung ist schwer zu standardisieren und wirkt sich natürlich auf alle aktiven und passiven Eigenschaften der Fasern aus, indem sie die Kontraktion, die Relaxation und die Elastizität bis an ihre Grenzen reduziert. Es wurde versucht, die durch das Formaldehyd hervorgerufenen Veränderungen zu minimieren, indem die Menge und die Anzahl der Injektionen in allen Experimenten begrenzt wurden und die Wirkung in Abhängigkeit von der Veränderung der Kontraktilität des injizierten Segments und der Überprüfung der Veränderung des Transitralflusses überwacht wurde. Für viele Forscher haben die Theorien von Dr. Torrent-Guasp Wege eröffnet, die sie zum besseren Verständnis der Physiologie des Herzmuskels beschreiten können. Andere Punkte sind nach wie vor schwer mit den bisherigen Daten in Einklang zu bringen.18
SCHLUSSFOLGERUNGEN
In diesem neuen Konzept der diastolischen Funktion würden die 3 Eigenschaften der Herzmuskelfasern in einer bestimmten Reihenfolge und gleichzeitig überlappend mitwirken. Der anfängliche Sog bei geschlossener Kammer wäre eine Folge der Kontraktion des letzten Segments des Bandes, wie wir mit den hier vorgestellten Experimenten zu zeigen versucht haben; die Entspannung der Fasern der aufeinanderfolgenden Segmente bei geöffneter Mitralklappe würde eine rasche Füllung ermöglichen, und schließlich würde die Dehnbarkeit das Nachgeben der Myokardwand als Reaktion auf den durch die Injektion in den Vorhof erzeugten Druck-/Volumenanstieg ermöglichen.
HINWEISE
Diese Studie wurde zum Gedenken an Dr. Francisco Torrent-Guasp durchgeführt.
Diese Studie wurde mit dem Zuschuss Nr. 99/1002 des spanischen Fondo de Investigaciones Sanitarias (FIS) finanziert.