Einführung
Intrakranielle Elektroenzephalographie (IEEG) überwindet viele physikalische Grenzen der Kopfhaut-Elektroenzephalographie (EEG) und der Magnetenzephalographie (MEG), indem sie Signale direkt vom Hirngewebe aufzeichnet. Die rasanten Fortschritte bei der Computerverarbeitung in den letzten Jahrzehnten haben die Software- und Hardwarekapazitäten erweitert und ermöglichen die gleichzeitige Aufzeichnung von Hunderten von intrakraniellen Stellen mit einer Genauigkeit von Mikrosekunden. Diese Steigerung der zeitlichen und räumlichen Auflösung hat die diagnostische Präzision bei der Lokalisierung von Anfällen verbessert (Andrews et al., 2019; Cuello Oderiz et al., 2019) und zu einer Beschleunigung der intrakraniellen neurophysiologischen Forschung am Menschen geführt (Chang, 2015; Parvizi und Kastner, 2018).
In Verbindung mit den aufkommenden computergestützten Werkzeugen und Kapazitäten für die Analyse großer Datensätze ist die Fülle an neurowissenschaftlichen Möglichkeiten und potenziellen Entdeckungen vielversprechend. Die Signalanalyse menschlicher intrakranieller Aufzeichnungen birgt jedoch inhärente Fallstricke, die in vielen neurophysiologischen Studien an menschlichen Patienten vermutlich angesprochen, aber kaum beachtet werden – nämlich interiktale epileptiforme Entladungen (IEDs). IEDs sind vorübergehende Aktivitätsschübe, die von Gruppen von Neuronen erzeugt werden, die aufgrund von Epilepsie pathologisch miteinander verbunden sind, und die bei IEEG-Aufzeichnungen zu deutlichen und auffälligen Wellenformen führen (Abbildung 1A). In dieser Perspektive wird auf die Gefahren von IEDs und ihre möglichen Auswirkungen auf gängige Analysestrategien aufmerksam gemacht und es werden gängige Strategien zu ihrer Vermeidung beschrieben, damit die wachsende Welle von Entdeckungen in der menschlichen Neurophysiologie hoffentlich ohne Fehltritte weiter voranschreitet.
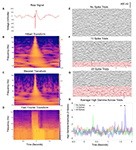
Abbildung 1. Interiktale epileptiforme Entladungen (IED) in Verbindung mit Datenkontamination. (A) Beispiel für eine IED aus einem einzelnen Kanal während einer 2-s-Aufzeichnung der intrakraniellen Elektroenzephalographie (IEEG). Es sind klassische Merkmale zu erkennen, einschließlich einer scharfen, großamplitudigen Spannungsverschiebung und einer anschließenden langsamen Welle, ansonsten mit einer relativ normalen Grundlinienmischung von Frequenzen davor und danach. (B) Hilbert-Transformations-Spektrogramm der Daten in (A). Man beachte den vorübergehenden, aber beträchtlichen Anstieg der Leistung bei fast allen Frequenzen, der auf die scharfe Komponente der Wellenform zurückzuführen ist, und einen subtilen, anhaltenden Anstieg der Leistung bei niedrigen Frequenzen, der mit der langsamen Welle nach dem Übergang zusammenhängt. (C) Wavelet-Transformations-Spektrogramm der Daten in (A), mit ähnlichen Ergebnissen wie in (B). (D) Fourier-Transformation von A (Mitra und Bokil, 2007; Chronux Home, 2019) mit 0,25-s überlappenden Fenstern, die Punkt für Punkt verschoben werden, um eine ähnliche zeitliche Auflösung wie in (B,C) zu erreichen. Ähnliche Ergebnisse wie in (B,C), mit einer zusätzlichen Dauer des Leistungsanstiegs bei den schnelleren Frequenzen aufgrund der Art des konsistenten Zeitfensters über die Frequenzen hinweg für die FFT-Berechnung. Die Felder (E-G) zeigen jeweils IEEG-Daten von 50 Versuchen, die von einem einzigen Kanal während einer Sprachhöraufgabe aufgezeichnet wurden (ein vorher aufgezeichneter Satz wurde für jeden Versuch ab dem Zeitpunkt Null laut abgespielt). In Panel (F) wurden 10 Trials mit Trials ausgetauscht, die IEDs enthielten (in rot dargestellt). Es wurde eine Mischung aus manuellen und automatisierten Ansätzen verwendet (Baud et al., 2018). Panel (G) erhöht dies auf 20 Trials mit IEDs. Panel (H) zeigt das durchschnittliche hohe Gamma über Trials in jeder Gruppe (Hilbert-Transformation, 50-200 Hz) von einer Elektrode, die den inferioren temporalen Gyrus kontaktiert, der nicht wirklich durch die Satz-Hör-Aufgabe moduliert wurde. Sternchen kennzeichnen Zeitpunkte, in denen eine der beiden Gruppen signifikant vom Ausgangswert abweicht (zweifache ANOVA mit wiederholten Messungen, p < 0,05). Mit zunehmendem Anteil an Trials mit IEDs treten zusätzliche falsch positive Zeitpunkte auf.
Die Natur der IED-Gefahren in der menschlichen IEEG-Neurophysiologie
Der Kernpunkt unserer Ansicht ist, dass das Paradigma der menschlichen intrakraniellen Neurophysiologie wohlmeinende Wissenschaftler aufgrund von zwei Hauptfaktoren dem Risiko falscher Ergebnisse aussetzt:
(1) Die Elektroden werden in Regionen des menschlichen Gehirns implantiert, von denen man annimmt, dass sie neurophysiologische Signaturen der Epilepsie sowohl im iktalen als auch im interiktalen Kontext erkennen lassen – und das sind oft scharfe Wellenformen mit großer Amplitude.
(2) Signalverarbeitungsanalysen, die üblicherweise für die menschliche Neurophysiologie verwendet werden, sind äußerst empfindlich für die in Nr. 1 beschriebenen scharfen Wellenformen mit großen Amplituden, die zu falschen Ergebnissen führen.
Daher enthalten IEEG-Datensätze üblicherweise elektrische Signaturen von Epilepsie, die das Risiko für verzerrte Ergebnisse bergen, wenn sie in gängige Signalanalysen wie Leistungs- und Kohärenzmessungen und verwandte Methoden wie die Leistungs-Phasen-Ko-Modulation einbezogen werden (Kramer et al, 2008). Eine Möglichkeit, diesem Problem Rechnung zu tragen, besteht darin, dass viele Methoden zur Verarbeitung neuronaler Signale wie Fourier-, Wavelet- und Hilbert-basierte Analysen von einem sinusförmigen Datensubstrat ausgehen (van Drongelen, 2018). Die Faltung von Wellen mit großer Amplitude oder scharfen Ausschlägen (mit großer oder sogar kleiner Amplitude) führt daher zu Repräsentationen vieler Frequenzen, die weitgehend unecht sein können, da viele aufeinanderfolgende Sinusfunktionen zu diesen Elementen der Wellenform passen können. In den Abbildungen 1B-D zeigen wir Beispiele dafür, wie IEDs neurophysiologische Signale auf diese Weise mit den gängigen Spektralmethoden der Hilbert-, Wavelet- und Fourier-Transformationen leicht falsch darstellen können. In niedrigeren Frequenzbändern können sowohl die scharfen als auch die langsamen Wellenkomponenten von IEDs einen Leistungsanstieg in jeder Frequenz hervorrufen, die zu diesen Merkmalen passt. In höheren Frequenzbändern wird dieser auffällige Leistungsanstieg über weite Strecken kontinuierlicher Frequenzniveaus noch deutlicher und kann als Ringing oder spektrales Leck bezeichnet werden (Scheffer-Teixeira et al., 2013). Dies kann sich über das gesamte hohe Gamma-Band (50-200 Hz oder einen ähnlichen Bereich) erstrecken, was insofern problematisch ist, als viele neurophysiologische Labors hohe Gamma-Aktivitäten verwenden, da sie als Surrogat für lokale neuronale Aktivität dienen können (Ray et al., 2008). Das Beispiel in Abbildung 1H veranschaulicht, wie die kumulative Einbeziehung (Abbildungen 1E-G) von Studien mit Spikes eine falsche Variabilität hinzufügt (Risiko eines falsch negativen Ergebnisses) oder auf andere Weise die statistische Signifikanz beeinflusst (Risiko eines falsch positiven Ergebnisses).
Dieses Problem könnte aufgrund des direkten Kontakts mit dem Nervengewebe, der größere Spike-Amplituden und schärfere Ausschläge vermitteln kann, insbesondere im Fall von IEDs, die neurophysiologischen Analysen verunreinigen, weitreichender sein als bei EEG- oder MEG-Aufzeichnungen. Darüber hinaus werden intrakranielle Elektroden speziell in Regionen platziert, die wahrscheinlich klinisch mit dem epileptischen Anfallsherd assoziiert sind, was zu starken und/oder häufigen IEDs in einigen IEEG-Datensätzen führt.
Anekdotisch würden die meisten Forscher im Bereich der Humanneurophysiologie zustimmen, dass die Datenkontamination durch IEDs allgemein bekannt ist, obwohl die Auswirkungen für bestimmte Arten von Analysen unterschiedlich sein können (Meisler et al., 2019). In der Tat würde man erwarten, dass viele Forschungslabors über Strategien verfügen, um dieses Problem zu umgehen oder zumindest zu minimieren. Bei einer praktischen Bewertung könnten dieses Problem und seine potenziellen Auswirkungen jedoch viel weitreichender sein als angenommen. Ein dritter erschwerender Faktor kann veranschaulichen, warum dies so sein kann:
(3) Neurophysiologie-Forscher (insbesondere Nachwuchswissenschaftler wie Studenten und Postdocs) erhalten möglicherweise keine direkte Ausbildung in der Identifizierung von IEDs oder elektrischen Artefakten. Darüber hinaus ist das Spektrum potenzieller IED-Morphologien und die Art und Weise, wie ihre unterschiedlichen Merkmale die Signalanalysen verunreinigen können, möglicherweise nicht in der Standardausbildung verankert.
Als weitere Komplikation ist die Übereinstimmung zwischen den Beurteilern bei der IED-Erkennung überraschend schlecht, selbst unter voll ausgebildeten Epileptologen (Barkmeier et al., 2012; Janca et al., 2015).
Strategien für den Umgang mit IEDs
Es gibt eine Vielzahl von Ansätzen, wenn man auf IEDs in Daten stößt, die von ihrer Häufigkeit und räumlichen Ausdehnung abhängen können oder auch nicht (z. B. ist ein Forscher vielleicht nicht geneigt, einen Datensatz für einen Spike pro Minute zu kuratieren und zu „bereinigen“, wohl aber für 10 Spikes pro Minute). Wir haben die möglichen Ansätze der Forscher in vier Hauptstrategien unterteilt. Die erste besteht darin, alle Versuche oder Zeiträume, in denen IEDs auftreten, manuell zu identifizieren und zu entfernen, was hier als Strategie 1 bezeichnet wird. Die Daten werden durchgesehen, indem Diagramme der aufgezeichneten Daten mit oder ohne Vorverarbeitung (Kerb- und/oder Bandpassfilterung) untersucht werden, und Datensegmente, die IEDs enthalten, werden markiert, so dass alle Studien, die sich mit diesen Segmenten überschneiden, aus den Analysen herausgenommen oder in fehlende Werte umgewandelt werden können.
Einige Forscher haben eine formale klinische Ausbildung im Lesen von EEG/iEEG erhalten, obwohl dies bei vielen nicht-klinischen Forschern, die durch akademische Studiengänge ausgebildet werden, weniger üblich ist. Viele haben entweder eine didaktische Schulung und/oder eine Einzelschulung erhalten, wie man IED-Studien aus Datensätzen identifiziert und entfernt, aber manche haben das nicht. Erschwerend kommt hinzu, dass IEEG-Datensätze aufgrund von Unterschieden bei der Aufzeichnung bei weitem nicht standardisiert sind: Der Aufbau der anfallsauslösenden Netzwerke ist bei jedem Patienten anders, was zu einer unterschiedlichen Anzahl von Elektroden führt, ganz zu schweigen von den individuellen Unterschieden in der Neuroanatomie und der Lateralität der Implantation. Es gibt gemischte Kontaktarten (Gitter, Streifen, Tiefen) mit unterschiedlicher Dichte sowie eine individuelle Anordnung der Kanäle (Montagen). All diese Faktoren führen zu größeren Schwierigkeiten bei der Interpretation von IEEG-Analysen, insbesondere für diejenigen, die keine angemessene (formelle oder informelle) Ausbildung für die Identifizierung von IED in diesen Aufzeichnungslayouts erhalten haben. Schließlich wird Strategie 1 mit zunehmender Dauer der Aufzeichnungen aus Zeit- und Arbeitsgründen immer weniger praktikabel.
In den letzten Jahrzehnten wurden computergestützte Algorithmen zur Spike-Detektion entwickelt, um die nächste Generation von Wissenschaftlern mit effektiven und standardisierten Fähigkeiten zur Spike-Detektion auszustatten, Zeit zu sparen und menschliche Fehler zu vermeiden. Die Verwendung von IED-Detektoren und die automatische Entfernung der betroffenen Studien/Daten ist ein weiterer Ansatz, den wir als Strategie 2 bezeichnen. Glücklicherweise weisen IEDs in der Regel die Merkmale auf, die für viele Algorithmen wichtig sind: große Amplitude, scharfe Komponenten und manchmal mit pathophysiologischen hochfrequenten Oszillationen, die im normalen Gehirn seltener vorkommen (siehe jedoch Frauscher et al., 2018b). Im Idealfall maximiert ein Algorithmus sowohl die Sensitivität als auch die Spezifität, während der Beitrag des Benutzers (Überwachung, z. B. Schwellenwerteinstellung) verringert oder aufgehoben wird. Es ist jedoch schwierig, diese Wunschliste vollständig zu erfüllen, und daher wurden viele Algorithmen mit einer Vielzahl von automatisierten und nicht überwachten Ansätzen entwickelt. Dazu gehören EEG-Ableitungen (White et al., 2006), Linienlängen- und Leistungstransformationen (Esteller et al., 2001; Bergstrom et al., 2013), adaptive gerichtete Übertragungsfunktionen (Wilke et al., 2009), räumliche Filter (Liu et al., 2015) und Spike-Template-Matching-Algorithmen wie räumlich-zeitliche Regression (Tousseyn et al., 2014) und nicht-negative Matrixfaktorisierung (Baud et al., 2018) sowie viele andere Ansätze. Alle Instrumente weisen Kompromisse bei der Sensitivität und Spezifität auf; kein Ansatz bietet 100 %ige Sicherheit, und dies wird durch das Fehlen eines verlässlichen menschlichen Goldstandards weiter erschwert. Insbesondere die oben erwähnte schlechte Übereinstimmung zwischen den Beurteilern bei der manuellen Erkennung durch hochqualifizierte Personen und die „quantitative Grauzone“ kleiner fragwürdiger IEDs, die sie möglicherweise ignorieren, sind grundlegende Vorbehalte bei der Prüfung von Algorithmen. Schließlich werden zwar fast alle neuen Methoden mit der manuellen Erkennung oder einer anderen automatisierten Methode verglichen, aber ein umfassender Vergleich der meisten oder aller automatisierten Methoden ist aufgrund der technischen Herausforderungen bei der Implementierung der einzelnen Methoden in einem ausreichend großen Datensatz schwierig (Westover et al., 2017). Nichtsdestotrotz kann die automatisierte Entfernung von interiktalen Spikes mit unüberwachten und/oder überwachten Ansätzen Zeit sparen, eine Standardisierung anstreben und die Qualität der neurophysiologischen Daten verbessern.
Aufgrund der Vorbehalte (und potenziellen Irrtümer) automatisierter Erkennungsalgorithmen zögern einige Forscher, die sie einsetzen, möglicherweise, diesem Mechanismus volle Diskretion zu gewähren. Da automatisierte Erkennungsansätze die Effizienz für den Großteil der offensichtlichen Erkennungen drastisch erhöhen können, ist eine dritte Strategie (Strategie 3) ein hybrider Ansatz der Strategien 1 und 2, bei dem die automatisierten Erkennungen auch manuell überprüft werden (oft in dieser Reihenfolge, obwohl auch die umgekehrte Reihenfolge oder mehrere Iterationen möglich sind). Ein Beispiel für diese Mischform ist die Verwendung von Verteilungen morphologischer Merkmale (z. B. Steigung, Leistungsmaße usw.), auf die ein Schwellenwert angewendet werden kann, gefolgt von einer manuellen Überprüfung auf potenzielle falsch positive und/oder negative Ergebnisse.
Angesichts der Komplexität der Erfassung dieser wertvollen Daten und der damit verbundenen Knappheit besteht ein gemeinsamer Nachteil der Strategien 1, 2 oder 3 darin, dass die Entfernung von Versuchen die statistische Aussagekraft verringert. Dementsprechend führt eine weitere Verzerrung – die Beibehaltung von mehr Studien – dazu, dass mehr potenzielle falsche Signalergebnisse eingeführt werden, was das Risiko falscher negativer und positiver Ergebnisse, wie oben beschrieben, erhöht.
Die Präferenz, so viele Studien wie möglich beizubehalten, führt eine andere Strategie für den Umgang mit IEDs ein: Agnostizismus, bei dem IEDs ignoriert (nicht bewertet) und keine Studien entfernt werden (Strategie 4). Man könnte natürlich davon ausgehen, dass Daten, die von IEDs betroffen sind, selten und zufällig genug sind, so dass die betroffenen Zeitpunkte im Hintergrund eines gemittelten Signals verschwinden, was die Variabilität erhöht, aber die Ergebnisse nicht wesentlich verzerrt. In der Zwischenzeit würden aufgabenbezogene neurophysiologische Signaturen hoffentlich aus der Analyse hervorgehen und sich, falls vorhanden, aufgrund ihrer Konsistenz über alle Versuche hinweg durchsetzen. Als Signal-Rausch-Problem kann diese Annahme für seltene IEDs gültig sein, insbesondere bei einer starken experimentellen Effektgröße (obwohl eine zusätzliche Sicherheitsebene durch die Verwendung nichtparametrischer Statistiken angeraten sein könnte). Häufigere (Abbildungen 1E-H) und/oder größere oder schärfere IEDs können diesen Ansatz jedoch untergraben. Nichtsdestotrotz ist eine robuste statistische Aussagekraft immer vorzuziehen und erfordert oft eine große Anzahl von Studien, die mit dem agnostischen Ansatz der Strategie 4 eher erreicht werden kann, insbesondere bei subtilen Effektgrößen. In einer kürzlich durchgeführten Studie (Meisler et al., 2019) wurde formell untersucht, ob die manuelle, automatische oder gar keine Entfernung von IEDs die neurophysiologischen Ergebnisse in einer Aufgabe des episodischen Gedächtnisses beeinflusst – sie fanden keinen eindeutigen Effekt irgendeines Ansatzes, betonten aber die Bedeutung einer ausreichenden Anzahl von Studien. In diesem Zusammenhang ist zu erwähnen, dass neuere Analysen des maschinellen Lernens große Mengen an Trainingsdaten benötigen, um genaue Modelle zu erstellen. Diese können zusammen mit Deep-Learning-Ansätzen lernen, zwischen normalen neurophysiologischen Signalen und pathologischen IED-Wellenformen zu unterscheiden, vorausgesetzt, die vorherigen Trainingsdaten sind genau beschriftet (oft manuell). Daher hat die agnostische Strategie eine gewisse Anziehungskraft (einschließlich des geringen Aufwands) und könnte ein guter Standard für einige Studien sein, vorausgesetzt, es gibt genügend Daten, um sie anzuwenden.
Gegenwärtige Praktiken unter IEEG-Forschern
Mit diesen verschiedenen allgemeinen Strategien im Hinterkopf, wie werden IEDs derzeit von Forschern im Bereich der menschlichen Neurophysiologie behandelt? Wir untersuchten diese Frage der „aktuellen Praktiken“, indem wir zunächst zusammenfassten, wie Forscher ihre Methoden in der veröffentlichten Literatur beschreiben. Wir durchsuchten PubMed mit zwei breit angelegten Suchanfragen: (intrakraniell UND EEG; Elektrokortikografie) und filterten die Ergebnisse so, dass nur im Jahr 2018 veröffentlichte Studien berücksichtigt wurden. Wir schränkten die Suchergebnisse ein, indem wir jeden einzelnen Artikel untersuchten (613 eindeutige Artikel) und nur solche einschlossen, die intrakranielle neurophysiologische Signale beim Menschen maßen und Schlussfolgerungen hinsichtlich der normalen Neurophysiologie zu ziehen schienen (insgesamt 91). Obwohl diese Suchbedingungen nicht erschöpfend sind, bieten sie eine aktuelle Momentaufnahme verschiedener Gruppen weltweit, die normale menschliche Neurophysiologie in vivo untersuchen. Wir fanden heraus, dass die Mehrheit dieser Veröffentlichungen auf die Verwendung manueller Methoden (Abbildung 2A) anspielte, einschließlich der direkten Identifizierung von IEDs oder eines ähnlichen (jedoch konservativeren) Ansatzes der Identifizierung und des Ausschlusses von Elektroden, die die Anfallsherde verdeckten. Weniger als 5 % der Manuskripte verwendeten vollautomatische Methoden, und keiner der eingeschlossenen Artikel verwendete den agnostischen Ansatz (Strategie 4). Auch hier war unsere Stichprobe der eingeschlossenen Artikel begrenzt und diese Ergebnisse sind möglicherweise nicht vollständig repräsentativ für das Feld.
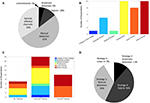
Abbildung 2. Aktuelle Praktiken im Umgang mit IEDs unter IEEG-Forschern. (A) Methoden des Umgangs mit IEDs, wie sie in Manuskripten aus dem Jahr 2018 berichtet wurden, die unseren PubMed-Such- und Screening-Kriterien entsprachen. (B) Karrierestufen der Umfrageteilnehmer. (C) Ausbildung der Umfrageteilnehmer in Bezug auf die Identifizierung und/oder Entfernung von IEDs. (D) Strategie der Befragten im Umgang mit IEDs.
Da die Methoden des Umgangs mit IEDs in vielen Artikeln nicht detailliert beschrieben zu sein schienen, haben wir unsere Frage nach den „aktuellen Praktiken“ durch eine anonyme Umfrage weiter bewertet. Diese Umfrage (ca. 2 Minuten) bestand aus Fragen zur beruflichen Stellung, ob sie mit IEDs in IEEG vertraut waren und ob sie eine formelle oder informelle oder keine Ausbildung zur Identifizierung und Entfernung von IEDs hatten, sowie einer Auswahl der oben genannten Strategien (1-4), die sie tendenziell anwenden (oder andere). Wir schickten eine E-Mail an die aufgelisteten korrespondierenden Autoren der oben beschriebenen Artikel (insgesamt 79, da sich einige Artikel überschnitten oder mehrere korrespondierende Autoren hatten) und baten sie um ihre freiwillige Teilnahme, die anonymisiert werden sollte (ausgenommen von den IRB-Anforderungen des UCSF IRB Office). Wir baten diese Personen, die Umfrage auch an andere Kollegen und Mitarbeiter weiterzuleiten.
Wir erhielten eine Rücklaufquote von 44 %, wobei der Schwerpunkt der Umfrageteilnehmer auf promovierten Mitgliedern und Fakultätsmitgliedern lag, was wahrscheinlich auf eine Verzerrung der Stichprobe durch das Versenden einer E-Mail an eine Gruppe von korrespondierenden Autoren zurückzuführen ist (Abbildung 2B). Bemerkenswert ist, dass die Antworten dieser leitenden Labormitglieder wahrscheinlich die Praxis ihres Labors als Ganzes in Bezug auf ihre IED-Strategie repräsentieren, obwohl dies für die Fragen zur Vertrautheit mit IED und zur Schulung weniger zutrifft. Alle Befragten gaben an, mit IEDs vertraut zu sein, ein beruhigendes Ergebnis, das jedoch möglicherweise durch die Art der Befragung beeinflusst wurde. Was die Schulung zur Erkennung von IEDs und zur Handhabung von IEDs betrifft, so wurde die Mehrheit informell geschult (Abbildung 2C), und einige waren überhaupt nicht geschult. Es überrascht nicht, dass diejenigen, die sich als formell geschult bezeichneten, zu den jüngeren und älteren Lehrkräften gehörten, was den klinischen Anforderungen für formelle EEG-Schulungen in den meisten Kontexten entspricht. Die Mehrheit der Befragten verwendete entweder einen manuellen Ansatz, entweder isoliert oder als Hybrid aus manueller und automatisierter Methode (Strategien 1 und 3; Abbildung 2D), was erwartungsgemäß im Allgemeinen mit der Literaturübersicht (Abbildung 2A) vergleichbar ist. Interessanterweise fanden wir keinen Artikel, der ausdrücklich auf die Verwendung von Strategie 4 („agnostisch“) hinwies, obwohl 9 % der Befragten sich als solche bezeichneten, und die Einbeziehung automatisierter Methoden (Strategien 2 und 3) war in den Umfrageantworten stärker vertreten (55 %) als in der Literaturübersicht (14 %). Diese Diskrepanzen könnten jedoch durch eine Verzerrung der Berichterstattung angesichts der unterschiedlichen Kontexte von Manuskriptmethoden im Vergleich zu einer direkten Umfrage und durch eine Verzerrung der Stichprobe (Rücklaufquote der Umfrage) erklärt werden.
Weitere Überlegungen
Während sich dieser Artikel in erster Linie auf IEDs konzentriert, können und sollten die hier beschriebenen Gefahren und Strategien auf andere elektrische oder nichtphysiologische Artefakte (Kabelbewegungen, Elektrodensprünge, Verstärkersättigung usw.) ausgedehnt werden, da sie ähnliche scharfe Ausschläge mit großer Amplitude beinhalten können. Was den Ausschluss von Kanälen betrifft, so sind Kanäle mit reichlich IEDs besonders problematisch für automatisierte Methoden, die auf Hintergrundschätzungen beruhen. Wenn normale Neurophysiologie untersucht werden soll, sollten diese Kanäle und alle Kanäle, von denen bekannt ist, dass sie sich in läsionellem Gewebe befinden, vollständig ausgeschlossen werden (Frauscher et al., 2018a); diese Praxis spiegelte sich in etwa einem Drittel der Manuskripte in unserer Literaturübersicht wider (Abbildung 2A).
Im Hinblick auf eine ordnungsgemäße experimentelle Kontrolle ist es oft von entscheidender Bedeutung, dass die IED-Markierung durchgeführt wird, während die Aufgabenereignisse und experimentellen Bedingungen verblindet sind (am relevantesten für die manuellen Strategien 1 und 3), um Verzerrungen zu vermeiden, die die Studienergebnisse beeinflussen könnten (z. B. das Entfernen von Studien mit IEDs, die in einer Bedingung häufiger auftreten als in einer anderen). In Bezug auf potenzielle Störfaktoren in studienbasierten Studien wird häufig angenommen, dass IEDs unvorhersehbar, ja sogar zufällig auftreten: Diese Annahme ist günstig, wenn IEDs in den Daten belassen werden (Strategie 4), da falsch-positive und -negative Ergebnisse durch die Mittelung von Studien verringert würden, was das neurophysiologische Signal-Rausch-Verhältnis verbessert. Es ist jedoch zu beachten, dass das Timing von IEDs in einer Verhaltensaufgabe nicht unbedingt zufällig sein muss. Es wurde eine aufgabenabhängige Modulation des Zeitpunkts oder der Menge der IEDs beschrieben (Matsumoto et al., 2013), die möglicherweise die Ergebnisse verfälschen könnte, indem falsche Ergebnisse in bestimmten Versuchsabschnitten stärker gewichtet werden als in anderen. Dies würde gegen die Verwendung von Strategie 4 sprechen, obwohl auch hier das Problem der Versuchsanzahl und der statistischen Aussagekraft problematisch sein kann, wie oben erwähnt.
Abgesehen von den Auswirkungen auf die Signalverarbeitung ist es erwähnenswert, dass IEDs auch die lokale neuronale Dysfunktion der Region, in der sie auftreten, vorübergehend stören können (Krauss et al., 1997; Kleen et al., 2013; Horak et al., 2017; Ung et al., 2017). Dies könnte zu kognitiven Fehlern führen, die studienbasierte und andere Analysen beeinflussen könnten, was ein weiteres Argument für den Ausschluss von Studien mit IEDs darstellt, wenn es darum geht, Rückschlüsse auf die „normale“ kognitive Verarbeitung zu ziehen.
Schlussfolgerungen
Die Beschleunigung der menschlichen intrakraniellen Neurophysiologie vermittelt große Begeisterung für bevorstehende Entdeckungen und Fähigkeiten, einschließlich der Erweiterung der grundlegenden Neurowissenschaften, der Verbesserung klinischer Therapien und der Entwicklung von Gehirn-Maschine-Schnittstellen. Allerdings bergen IEDs die Gefahr falscher Ergebnisse, die aufgrund der Beschaffenheit des epileptischen Gewebes, von dem die Daten aufgezeichnet werden, schwer zu vermeiden sind. Erhöhte Wachsamkeit ist erforderlich, um IEDs in Daten zu vermeiden, wenn/falls dies angebracht ist, was durch die Berücksichtigung und Anwendung der oben aufgeführten Strategien möglich ist. Wir schlagen außerdem vor, dass Forscher auf mittlerer und höherer Ebene versuchen sollten, in ihren Labors standardisierte Schulungspräsentationen oder Simulationen zur Identifizierung, Erkennung und Entfernung von IEDs anzubieten. Dies wird jüngeren Forschern wichtige Fähigkeiten vermitteln, um ihre eigenen Daten und die von anderen zu verstehen und konstruktiv zu hinterfragen. Darüber hinaus sind Verbesserungen in der wissenschaftlichen Kommunikation erforderlich (Suthana et al., 2018), so dass in Manuskripten über normale menschliche Neurophysiologie der für den Umgang mit IEDs verwendete Ansatz und seine Rechtfertigung im Kontext ihrer Studie klar dargestellt werden sollten. Solche Praktiken erhöhter Wachsamkeit und klarer Kommunikation werden hoffentlich die Reproduzierbarkeit verbessern, so dass das Feld seine Beschleunigung ohne vorhersehbare Rückschläge fortsetzen kann.
Data Availability Statement
Die Umfragedaten in diesem Artikel können heruntergeladen werden von doi: 10.5281/zenodo.3626105.
Ethics Statement
Die Studien mit menschlichen Teilnehmern wurden vom University of California San Francisco Institutional Review Board geprüft und genehmigt. Eine schriftliche Einwilligung zur Teilnahme war für diese Studie gemäß der nationalen Gesetzgebung und den institutionellen Anforderungen nicht erforderlich.
Beiträge der Autoren
SA und JK entwickelten das Konzept des Manuskripts, erstellten und verteilten die Umfrage, führten die Literatursuche durch und schrieben das Manuskript. ML und EC lieferten wichtige Rückmeldungen und Korrekturen zum Manuskript. Alle Autoren lasen und genehmigten das eingereichte Manuskript.
Finanzierung
SA wurde durch ein NIH Diversity Supplement unter R01-DC012379 finanziert. JK wurde von den National Institutes of Health/National Institute of Neurological Disorders and Stroke (NIH/NINDS) mit den Zuschüssen R25NS070680 und K23NS110920 gefördert. ML wurde durch die NIH-Zuschüsse R01-DC015504 und F32-DC013486 sowie durch das Kavli Institute for Brain and Mind und den DARPA-Vertrag N66001-17-2-4008 finanziert. EC wurde durch NIH Grants (R01-DC012379, R00-NS065120 und DP2-OD00862) und den Esther A. and Joseph Klingenstein Fund finanziert.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Maxime Baud und Han Yi für ihre hilfreichen Diskussionen und Kommentare während der Entwicklung dieses Manuskripts.
Andrews, J. P., Gummadavelli, A., Farooque, P., Bonito, J., Arencibia, C., Blumenfeld, H., et al. (2019). Assoziation von Anfallsausbreitung mit chirurgischem Versagen bei Epilepsie. JAMA Neurol. 76, 462-469. doi: 10.1001/jamaneurol.2018.4316
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkmeier, D. T., Shah, A. K., Flanagan, D., Atkinson, M. D., Agarwal, R., Fuerst, D. R., et al. (2012). Hohe Inter-Reviewer-Variabilität bei der Spike-Erkennung im intrakraniellen EEG durch einen automatisierten Mehrkanal-Algorithmus. Clin. Neurophysiol. 123, 1088-1095. doi: 10.1016/j.clinph.2011.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Baud, M. O., Kleen, J. K., Anumanchipalli, G. K., Hamilton, L. S., Tan, Y.-L., Knowlton, R., et al. (2018). Unüberwachtes Lernen von raum-zeitlichen interiktalen Entladungen bei fokaler Epilepsie. Neurosurgery 83, 683-691. doi: 10.1093/neuros/nyx480
PubMed Abstract | CrossRef Full Text | Google Scholar
Bergstrom, R. A., Choi, J. H., Manduca, A., Shin, H.-S., Worrell, G. A., and Howe, C. L. (2013). Automatisierte Identifizierung mehrerer anfallsbezogener und interiktaler epileptiformer Ereignistypen im EEG von Mäusen. Sci. Rep. 3:1483. doi: 10.1038/srep01483
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, E. F. (2015). Auf dem Weg zu groß angelegten, menschenbasierten, mesoskopischen Neurotechnologien. Neuron 86, 68-78. doi: 10.1016/j.neuron.2015.03.037
PubMed Abstract | CrossRef Full Text | Google Scholar
Chronux Home. (2019). Chronux Analysis Software. Online verfügbar unter: http://chronux.org/. Accessed September 25, 2019.
Cuello Oderiz, C., von Ellenrieder, N., Dubeau, F., Eisenberg, A., Gotman, J., Hall, J., et al. (2019). Assoziation von durch kortikale Stimulation induzierten Anfällen mit dem Operationsergebnis bei Patienten mit fokaler medikamentenresistenter Epilepsie. JAMA Neurol. 76, 1070-1078. doi: 10.1001/jamaneurol.2019.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Esteller, R., Echauz, J., Tcheng, T., Litt, B., and Pless, B. (2001). „Line length: an efficient feature for seizure onset detection,“ in Proceedings of the 2001 Conference 23rd Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Istanbul, Turkey: IEEE, 1707-1710.
Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Doležalová, I., Minotti, L., Olivier, A., et al. (2018a). Atlas des normalen intrakraniellen Elektroenzephalogramms: Neurophysiologische Wachaktivität in verschiedenen kortikalen Arealen. Brain 141, 1130-1144. doi: 10.1093/brain/awy035
PubMed Abstract | CrossRef Full Text | Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Rogers, C., Khoa Nguyen, D., Kahane, P., et al. (2018b). Hochfrequente Oszillationen im normalen menschlichen Gehirn. Ann. Neurol. 84, 374-385. doi: 10.1002/ana.25304
PubMed Abstract | CrossRef Full Text | Google Scholar
Horak, P. C., Meisenhelter, S., Song, Y., Testorf, M. E., Kahana, M. J., Viles, W. D., et al. (2017). Interiktale epileptiforme Entladungen beeinträchtigen den Wortabruf in mehreren Hirnarealen. Epilepsia 58, 373-380. doi: 10.1111/epi.13633
PubMed Abstract |Ref Full Text | Google Scholar
Janca, R., Jezdik, P., Cmejla, R., Tomasek, M., Worrell, G. A., Stead, M., et al. (2015). Detection of interictal epileptiform discharges using signal envelope distribution modelling: application to epileptic and non-epileptic intracranial recordings. Brain Topogr. 28, 172-183. doi: 10.1007/s10548-014-0379-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kleen, J. K., Scott, R. C., Holmes, G. L., Roberts, D. W., Rundle, M. M., Testorf, M., et al. (2013). Hippocampale interiktale epileptiforme Aktivität stört die Kognition beim Menschen. Neurology 81, 18-24. doi: 10.1212/wnl.0b013e318297ee50
PubMed Abstract | CrossRef Full Text | Google Scholar
Kramer, M. A., Tort, A. B. L., and Kopell, N. J. (2008). Scharfe Kantenartefakte und störende Kopplung in EEG-Frequenzkomodulationsmessungen. J. Neurosci. Methods 170, 352-357. doi: 10.1016/j.jneumeth.2008.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Krauss, G. L., Summerfield, M., Brandt, J., Breiter, S., and Ruchkin, D. (1997). Mesial-temporale Spikes stören das Arbeitsgedächtnis. Neurology 49, 975-980. doi: 10.1212/wnl.49.4.975
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Coon, W. G., de Pesters, A., Brunner, P., and Schalk, G. (2015). Die Auswirkungen von räumlicher Filterung und Artefakten auf elektrokortikographische Signale. J. Neural Eng. 12:056008. doi: 10.1088/1741-2560/12/5/056008
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsumoto, J. Y., Stead, M., Kucewicz, M. T., Matsumoto, A. J., Peters, P. A., Brinkmann, B. H., et al. (2013). Network oscillations modulate interictal epileptiform spike rate during human memory. Brain 136, 2444-2456. doi: 10.1093/brain/awt159
PubMed Abstract | Querverweis Volltext | Google Scholar
Meisler, S. L., Kahana, M. J., and Ezzyat, Y. (2019). Verbessert die Datenbereinigung die Klassifizierung von Gehirnzuständen? J. Neurosci. Methods 328:108421. doi: 10.1016/j.jneumeth.2019.108421
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitra, P., and Bokil, H. (2007). Observed Brain Dynamics. New York, NY: Oxford University Press.
Google Scholar
Parvizi, J., and Kastner, S. (2018). Versprechen und Grenzen der menschlichen intrakraniellen Elektroenzephalographie. Nat. Neurosci. 21, 474-483. doi: 10.1038/s41593-018-0108-2
PubMed Abstract |Ref Full Text | Google Scholar
Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., and Hsiao, S. S. (2008). Neuronale Korrelate von Hoch-Gamma-Oszillationen (60-200 Hz) in lokalen Feldpotentialen von Makaken und ihre möglichen Auswirkungen auf die Elektrokortikographie. J. Neurosci. 28, 11526-11536. doi: 10.1523/JNEUROSCI.2848-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Scheffer-Teixeira, R., Belchior, H., Leão, R. N., Ribeiro, S., and Tort, A. B. L. (2013). Über hochfrequente Feldoszillationen (>100 Hz) und die spektrale Leckage von Spiking-Aktivität. J. Neurosci. 33, 1535-1539. doi: 10.1523/JNEUROSCI.4217-12.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Suthana, N., Aghajan, Z. M., Mankin, E. A., and Lin, A. (2018). Berichterstattungsrichtlinien und zu berücksichtigende Aspekte bei der Verwendung von intrakranieller Hirnstimulation in Studien zum deklarativen Gedächtnis des Menschen. Front. Neurosci. 12:905. doi: 10.3389/fnins.2018.00905
PubMed Abstract | CrossRef Full Text | Google Scholar
Tousseyn, S., Dupont, P., Robben, D., Goffin, K., Sunaert, S., and Van Paesschen, W. (2014). Eine zuverlässige und zeitsparende halbautomatische Spike-Template-basierte Analyse von interiktalem EEG-FMRI. Epilepsia 55, 2048-2058. doi: 10.1111/epi.12841
PubMed Abstract |Ref Full Text | Google Scholar
Ung, H., Cazares, C., Nanivadekar, A., Kini, L., Wagenaar, J., Becker, D., et al. (2017). Interiktale epileptiforme Aktivität außerhalb der Zone des Anfallsbeginns beeinflusst die Kognition. Brain 140, 2157-2168. doi: 10.1093/brain/awx143
PubMed Abstract | CrossRef Full Text | Google Scholar
van Drongelen, W. (2018). Signal Processing for Neuroscientists. London: Elsevier Academic press.
Google Scholar
Westover, M. B., Halford, J. J., and Bianchi, M. T. (2017). Was es für einen Algorithmus bedeuten sollte, einen statistischen Turing-Test zur Erkennung epileptiformer Entladungen zu bestehen. Clin. Neurophysiol. 128, 1406-1407. doi: 10.1016/j.clinph.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
White, A. M., Williams, P. A., Ferraro, D. J., Clark, S., Kadam, S. D., Dudek, F. E., et al. (2006). Effiziente unüberwachte Algorithmen zur Erkennung von Krampfanfällen in kontinuierlichen EEG-Aufzeichnungen von Ratten nach Hirnverletzungen. J. Neurosci. Methods 152, 255-266. doi: 10.1016/j.jneumeth.2005.09.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilke, C., van Drongelen, W., Kohrman, M., and He, B. (2009). Identifizierung epileptogener Herde durch kausale Analyse der interiktalen EKG-Spitzenaktivität. Clin. Neurophysiol. 120, 1449-1456. doi: 10.1016/j.clinph.2009.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar