Die Koloskopie zur Darmkrebsvorsorge ist sowohl zur Senkung der Sterblichkeit durch Früherkennung als auch zur Vorbeugung durch Entfernung präkanzeröser Polypen wirksam (1-8). Dieser Nutzen könnte jedoch durch unzureichende Qualität der Koloskopie und Komplikationen aufgehoben werden (9-17). Übersehene Polypen und unvollständige Polypektomie können zur Entwicklung von Intervallkrebs (Krebs, der nach der Koloskopie entdeckt wird) beitragen (10-14, 18, 19). Obwohl Blutungen nach der Koloskopie mit einer Häufigkeit von 1-6/1000 relativ selten sind (15-17), stellen sie die häufigste Komplikation dar, die zu ungeplanten Krankenhausaufenthalten innerhalb von 7 Tagen nach der Koloskopie führt (20). Die Polypektomie ist der überwiegende Grund dafür (21-26). Zu den Risikofaktoren, die eine Blutung nach Polypektomie begünstigen, gehören die Größe der Polypen, die Anzahl der Polypen, die Antikoagulationstherapie und die Histologie der Polypen (17, 21, 27, 28). Fortgeschrittene Polypektomietechniken wie die endoskopische Mukosaresektion (EMR) und die endoskopische Submukosadissektion (ESD) scheinen Polypen vollständiger zu entfernen, erhöhen aber auch die Verfahrensdauer, die Kosten und das Blutungsrisiko (17, 29-31).
Abgesehen von der EMR und der ESD wurde der Polypektomietechnik als Risikofaktor für Blutungen nach der Polypektomie bisher wenig Aufmerksamkeit geschenkt. In der Tat hat sich die allgemein akzeptierte und weit verbreitete traditionelle Schlingenpolypektomietechnik, bei der der umschlungene Polyp mit oder ohne Hitzekoagulation abgeschnitten wird, seit fast 5 Jahrzehnten nicht wesentlich verändert (32-37). Um Blutungen nach der Polypektomie zu verhindern, entwickelte einer der Autoren (ZJC) das endoskopische Mukosastripping (EMS) als Abwandlung der traditionellen Kaltschlingenpolypektomie (TCSP), um zu vermeiden, dass in die blutgefäßreiche Submukosa geschnitten wird, da alle nicht krebsartigen Polypen, die bei der Screening-Koloskopie am häufigsten vorkommen, definitionsgemäß auf die Mukosa beschränkt sind und nicht in die Submukosa hineinreichen. Am 31. Dezember 2012 wurde beschlossen, die technische Innovation systematisch einzuführen, da EMS schon früh Erfolge bei der vollständigen Entfernung von nicht-pedunzierten Polypen ohne wesentliche Verletzung der Submukosa zeigte. In diesem Bericht wurde die Wirksamkeit von EMS bei der Verhinderung von Blutungen nach der Polypektomie und der Erleichterung der vollständigen Entfernung von Polypen, insbesondere bei fortgeschrittenen Hochrisikopolypen, analysiert.
- Methoden
- Patienten und Studiendesign
- Endoskopisches Mukosastripping (EMS)
- Ergebnisbewertung
- Koloskopieuntersuchung
- Statistische Analyse
- Ergebnisse
- EMS verhinderte hospitalisierungspflichtige Nachpolypektomie-Blutungen
- EMS-unterstützte vollständige Polypektomie
- Diskussion
- Ethikerklärung
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagung
- Supplementary Material
- Abkürzungen
Methoden
Patienten und Studiendesign
Es handelte sich um eine retrospektive Untersuchung von Daten, die elektronische Krankenakten und Pathologie-Objektträger bei Minnesota Gastroenterology, PA (MNGI) umfassten. Für die Untersuchung wurde eine Ausnahmegenehmigung des Internal Review Board erteilt. Bei den Patienten handelte es sich um diejenigen, die in den ambulanten Endoskopiezentren von MNGI in einem Zeitraum von 12 Jahren eine Koloskopie mit Schlingenpolypektomie unter dem CPT-Kode 45385 (Current Procedural Terminology) durch ZJC erhielten, wobei zwischen der Prä-EMS-Ära (2005-2012) und der EMS-Ära (2013-2016) unterschieden wurde. Es wurde eine Datenbanksuche nach Postpolypektomie-Blutungen, die einen Krankenhausaufenthalt erforderten, und nach fortgeschrittenen Polypen durchgeführt, die als Polypen mit villösen Merkmalen, hochgradiger Dysplasie, sessilem serrierten Adenom mit zytologischer Dysplasie (SSACD) sowie allen adenomatösen Polypen von 10 mm oder mehr definiert wurden. Da MNGI über eine umfassende lokale Praxisabdeckung und eine rund um die Uhr besetzte Telefonleitung für Komplikationen verfügte, wurden fast alle Komplikationen erfasst, die von Fachkollegen geprüft und zur Qualitätsverbesserung an die beteiligten Endoskopiker zurückgemeldet wurden.
Endoskopisches Mukosastripping (EMS)
Das endoskopische Mukosastripping (EMS) ist die endoskopische Entfernung von polyphaltiger Schleimhaut durch mechanisches Stripping mit einer kalten Schlinge. Es handelt sich dabei um eine Abwandlung des TCSP, bei der die Schleimhaut von der umschlungenen Submukosa am potenziellen Zwischenraum abgezogen wird (Abbildung 1, ergänzendes Video), anstatt das gesamte umschlungene Gewebe zu guillotinieren, wie ursprünglich für das TCSP beschrieben (36, 37). Es wird daher erwartet, dass EMS die Verletzung der Submukosa und die damit verbundenen sofortigen und verzögerten Blutungen minimiert. Bei den seltenen gestielten Polypen verwenden wir nach wie vor die Hot-Snare-Polypektomie, da die kauterisationsbedingte Gewebeschädigung weitgehend auf den intraluminalen Stiel beschränkt sein kann und nicht tief in die Kolonwand hineinreicht. Daher haben wir die EMS ausschließlich bei nicht-pedunkulierten Polypen angewandt, die keine Anzeichen von Malignität aufweisen. Im Folgenden werden die Besonderheiten der EMS-Techniken in Abhängigkeit von der Polypengröße erläutert.
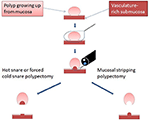
Abbildung 1. Diagramm zur Veranschaulichung des entscheidenden Unterschieds zwischen EMS und traditioneller Schlingenpolypektomie. Nachgedruckt aus Chen und Batts (38), Copyright (2017) mit Genehmigung von Elsevier zur Verwendung als Open-Access-Inhalt unter CC-BY-Nutzerlizenz.
Bei kleinen Polypen (≤ 5 mm) funktioniert die TCSP im Allgemeinen gut. Um eine vollständige Resektion zu gewährleisten, ziehen wir die Schlinge der Biopsiezange vor, außer bei kleinen Polypen von 2 mm oder weniger (25), und entfernen bei der Polypektomie routinemäßig 2-3 mm angrenzende Mukosa. Es kann jedoch immer noch vorkommen, dass Submukosa in der Schlinge eingeklemmt wird, was einen vollständigen Verschluss der Schlinge ohne brachiale Guillotine oder Hitzekoagulation (heiße Schlinge) verhindert. Wenn dies der Fall ist, führt ein gleichmäßiges, sanftes Ziehen der Schlinge in das Endoskop, während die Schlinge fest, aber nicht fest verschlossen gehalten wird, in der Regel dazu, dass die polyphaltige Schleimhaut abgestreift/abgenadelt wird und die eingeklemmte Submukosa zurückbleibt, die einen vorübergehend erhöhten Pseudostiel bildet (Abbildung 2A). Endoskopisch ist die abgezogene Schleimhaut in der Regel in einem Stück, während die Submukosa weitgehend intakt bleibt, ohne dass Blutgefäße beschädigt werden (Abbildung 2B). Der durch EMS verursachte Schleimhautriss führt im Allgemeinen zu einer etwas größeren, aber weniger blutigen Polypektomiestelle als bei der TCSP. Für eine effektive EMS ist es entscheidend, die Schlinge während des Strippens fest, aber nicht zu fest zu schließen. Wenn die Schlinge nicht fest genug geschlossen wird, kommt es zu einem Verrutschen der Schlinge, während ein zu festes Schließen der Schlinge zu submukösen Schäden wie Hämatombildung und zum Scheitern des Strippings führt. Ein erfahrener Endoskopiker kann die Feinheiten leicht erkennen und die assistierende Endoskopieschwester anweisen, die angemessene Festigkeit des Griffs beim Ziehen der Schlinge einzustellen.
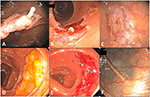
Abbildung 2. EMS-Polypektomien. (A) Submuköser Pseudostiel nach Polypektomie eines 10 mm großen sessilen zökalen tubulären Adenoms. (B) Ein intaktes Stück polyphaltiger Schleimhaut nach der Entfernung (oben rechts) und die polypfreie Polypektomiestelle mit sichtbarem Pseudostiel (unten links). (C) Eine saubere Polypektomiestelle ohne Deformierung trotz leichter vorübergehender kapillarer Nässung unmittelbar nach der Polypektomie. Das Anheben der eingeschlossenen Schleimhaut verhinderte die Entwicklung von Pseudostielen. (D) Ein 30 mm großes, sessiles, gezacktes Adenom im Querkolon. (E) Polypektomiestelle von (D) nach stückweiser Polypektomie. (F) Dieselbe tätowierte Polypektomiestelle wie (E) 1 Jahr später.
Während bei kleineren Polypen eine submuköse Einklemmung durch optimale Platzierung der Schlinge und sanftes Anheben des Polypen vermieden werden kann, kann dies bei der Entfernung größerer Polypen unvermeidlich werden. Obwohl die oben beschriebene Technik nach wie vor anwendbar ist, verhindert die eingeklemmte Submukosa häufig die Trennung der Schlinge von der Polypektomiestelle, selbst nachdem die polypentragende Schleimhaut bereits abgetragen wurde. Unter diesen Umständen besteht keine Notwendigkeit, die Schlinge mit roher Gewalt weiter zu ziehen. Stattdessen kann die Schlinge durch leichtes Öffnen und Gleiten über die eingeklemmte Submukosa von der Polypektomiestelle gelöst und die abgezogene, aber scheinbar noch anhaftende polypentragende Schleimhaut entfernt werden. Die eingeschlossene Submukosa dieser größeren Polypen bildet häufig einen dickeren Pseudostiel, aber die submuköse Verletzung bleibt minimal.
Bei noch größeren Polypen, die nicht in einem Stück entfernt werden können, kann die EMS-Polypektomie in Teilen durchgeführt werden. Da die EMS-Polypektomie ohne submuköse Verletzung eine weniger blutige oder deformierte Polypektomiestelle im Vergleich zur traditionellen Kalt- oder Heißschlingenpolypektomie erzeugt, wird das restliche Polypengewebe besser sichtbar gemacht, was eine vollständige Polypenentfernung erleichtert (Abbildung 2).
Ergebnisbewertung
1. Krankenhausaufenthalt erfordernde Blutungsraten nach Polypektomie aller und nicht-pedunkulierter Dickdarmpolypen vor und nach der EMS-Anwendung.
2. Vollständigkeit der EMS-Polypenentfernung durch Biopsie an der Polypektomiestelle und Untersuchung bei der Nachfolgekoloskopie in den von den nationalen Leitlinien der Gesellschaft empfohlenen Intervallen (13, 14).
Koloskopieuntersuchung
Die Koloskopien wurden in den meisten Fällen mit Koloskopen mit variabler Steifigkeit (PCF 160, CF 160, PCF 180 und CF 180; Olympus Corp. Tokio, Japan) und in einigen wenigen Fällen mit FUSE-Vollspektrum-Koloskopen (EndoChoice, Alpharetta, Georgia) im Rahmen einer Studie durchgeführt. Polypektomien wurden meist mit ovalen Schlingen (100600 bis 100602, ConMed, Utica, NY) und in einigen wenigen Fällen mit Spiralschlingen (SD-230U-20, Olympus Corp, Tokio, Japan) und Exacto-Schlingen (BX00711115, US Endoscopy, Mentor, OH) durchgeführt.
Im Rahmen der MNGI-Qualitätsmessung wurden die folgenden jährlichen Koloskopiestatistiken für ZJC für 2014 und 2016 gemeldet: Zökum-Erreichungsrate 99,5-100%, Screening-Koloskopie-Erkennungsraten für adenomatöse Polypen 50,3-60,1% für Männer und 42.1-54,0% für Frauen.
Statistische Analyse
Die statistische Analyse wurde mit dem exakten Test von Fisher durchgeführt.
Ergebnisse
EMS verhinderte hospitalisierungspflichtige Nachpolypektomie-Blutungen
Insgesamt 5.142 Koloskopien mit Schlingenpolypektomie, die von ZJC in ambulanten Endoskopiezentren von MNGI innerhalb von 12 Jahren durchgeführt wurden, wurden in die Prä-EMS-Ära (2005-2012, n = 2973) und die EMS-Ära (2013-2016, n = 2169) unterteilt (Tabelle 1). Die letzte Blutung nach einer Polypektomie, die einen Krankenhausaufenthalt erforderlich machte, trat im September 2012 auf. In der EMS-Ära wurde keine gefunden (Rate 0 %), während in der Prä-EMS-Ära zehn Polypen (darunter 2 gestielte Polypen) gefunden wurden (Rate 0,336 %). Die Krankenhauseinweisung erfolgte 1-16 Tage nach der Koloskopie. Dieser Unterschied war statistisch signifikant (P = 0,0055) und blieb auch nach Ausschluss der 2 Fälle mit gestielten Polypen bestehen (P = 0,012).
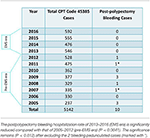
Tabelle 1. Nachpolypektomie-Blutungsfälle und totale Schlingenpolypektomie (CPT-Code #45385) in 12 Jahren.
Von den 12 Blutungsfällen wurden insgesamt 18 Polypen entfernt. Mit Ausnahme von zwei 2-3 mm großen tubulären Adenomen (TA), die mit einer kalten Schlinge entfernt wurden, wurden alle mit einer heißen Schlinge entfernt. Dazu gehörten zehn 8-40 mm große TA (darunter zwei gestielte Polypen von 11-15 mm bzw. 36-40 mm), ein 25 mm großes tubulovillöses Adenom (TVA), vier 6-10 mm große sessile serrierte Adenome (SSA) und ein 5 mm großes Lipom. Mit Ausnahme eines Falles, bei dem der resezierte Polyp nur teilweise entfernt werden konnte und mikroskopisch keine Submukosa zu sehen war, wiesen alle übrigen neun Fälle Anzeichen von verätzter Submukosa auf, oft mit sichtbaren Blutgefäßen in der Nähe des verätzten Randes, wie in Abbildung 3C dargestellt. Diese Befunde deuten darauf hin, dass die Schädigung der Submukosa während der Hot-Snare-Polypektomie zur Blutung nach der Polypektomie beitrug.
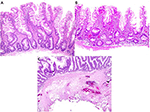
Abbildung 3. Histopathologischer Vergleich von fortgeschrittenen Polypen, die mit EMS und Hot Snare Polypektomie entfernt wurden. (A,B) Mit EMS entfernte Polypen zeigen typischerweise einen tiefen Aspekt der Muscularis mucosae mit wenig Submukosa und fehlenden Blutgefäßen. (C) Niedrige Vergrößerung eines mit der heißen Schlinge entfernten Polypen zeigt die typische Menge an Submukosa mit Gewebeschäden durch den Kauter.
Zum Vergleich haben wir auch 20 aufeinanderfolgende Fälle von fortgeschrittenen Dickdarmpolypen, die mit EMS entfernt wurden, mikroskopisch untersucht. Diese Polypen enthielten nur eine variable Menge an Muscularis mucosae und, wenn überhaupt, nur wenig Submukosa ohne Blutgefäße (Tabelle 2, Abbildungen 3A und B). Diese Ergebnisse deuten darauf hin, dass EMS Blutungen nach der Polypektomie verhindert, indem eine Schädigung der Submukosa vermieden wird.
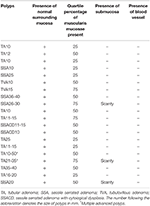
Tabelle 2. Merkmale von 20 konsekutiven Fällen fortgeschrittener Dickdarmpolypen, die mit EMS entfernt wurden.
EMS-unterstützte vollständige Polypektomie
Ausführliche Biopsien wurden am Rand (x4) und am Pseudostiel (x1) von 10 zufällig ausgewählten fortgeschrittenen Polypenstellen nach endoskopisch vollständiger Entfernung durch EMS durchgeführt. In keiner der Proben wurden Polypenreste gefunden. Siebenundneunzig neoplastische EMS-Polypektomiestellen wurden über einen Zeitraum von 6 Monaten bis 4 Jahren nachverfolgt, darunter 38 Polypektomiestellen bei 23 Patienten nach Entfernung fortgeschrittener Polypen. Keiner der 59 nicht fortgeschrittenen neoplastischen Polypen (< 10 mm und ohne fortgeschrittene Merkmale) wies bei der Nachfolgekoloskopie Restpolypen oder rezidivierende Polypen auf. Bei der überwiegenden Mehrheit (33 von 38; 87 %) der fortgeschrittenen Polypen fanden sich auch bei der Nachsorgekoloskopie keine Polypen (Tabelle 3). Zwei kleine Polypen wurden 1 Jahr später in der Nähe von Polyp Nr. 12 gefunden, waren aber von einem anderen Typ als der ursprüngliche Polyp (SSA vs. TA). Bei den Polypen Nr. 13, Nr. 22 und Nr. 25 wurde bei Nachfolgekoloskopien 1-3,5 Jahre später zwar jeweils ein kleiner (2-5 mm) Polyp desselben Typs (TA) in der Nähe der ursprünglichen Polypektomiestelle gefunden, doch war es schwierig festzustellen, ob es sich um neu gebildete Polypen oder um Rückstände handelte, da sie alle bei Polyposis-Fällen auftraten, bei denen bei den kombinierten Erst- und Nachfolgekoloskopien 24, 10 bzw. 14 adenomatöse Polypen entfernt worden waren. Bei der Nachfolgekoloskopie wurden in der Nähe der ursprünglichen Polypektomiestellen von Polyp Nr. 13 und Nr. 25 auch andersartige kleine Polypen (SSA statt TA) entdeckt, was eher auf neues Polypenwachstum als auf eine unvollständige Polypektomie hindeutet. Ein 10 mm großer SSA wurde 14 Monate später hinter einer Falte in der Nähe der tätowierten Polypektomiestelle des 50 mm großen flachen SSA (Nr. 26) gefunden. Dabei könnte es sich um eine unvollständige Polypektomie handeln, möglicherweise wegen der übergroßen Größe des ursprünglichen Polypen, aber auch um einen sich vergrößernden separaten Polypen, der bei der ursprünglichen Koloskopie übersehen wurde, weil er sehr versteckt hinter einer Falte liegt, die am besten bei der Retroflexion zu sehen ist (Abbildung 4). Kein einziger überzeugender Fall und höchstens 4/97 (4,1 %) aller nachfolgenden neoplastischen Polypen oder 4/38 (10,5 %) der mit EMS entfernten fortgeschrittenen Polypen hatten eine unvollständige Polypektomie. Diese Raten sind sehr günstig im Vergleich zu denen, die für herkömmliche Schlingenpolypektomietechniken berichtet wurden (18).
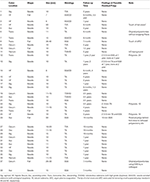
Table 3. Nachuntersuchung von 38 fortgeschrittenen Dickdarmpolypen, die bei 23 Patienten mit EMS entfernt wurden.
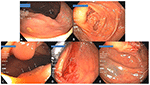
Abbildung 4. (A) Ein großes, 50 mm großes, sessiles, gezacktes Adenom (Polyp Nr. 26 in Tabelle 3) im proximalen aszendierenden Kolon mit sichtbarem ICV im Hintergrund (Pfeil). (B) Übersicht über die Polypektomiestelle 14 Monate später mit einer der Tätowierungen auf der rechten Seite (Pfeile). (C) Ein 10 mm langer SSA, versteckt hinter einer Falte (Pfeile) in der Nähe der Polypektomiestelle. (D) Polypektomiestelle des Polypen in (C) in Retroflexionsansicht. (E) Relativer Abstand zwischen einem der Tattoos (links unten) und der Falte, hinter der sich der Polyp in (C) verbarg (Pfeil).
Diskussion
Unsere Datenanalysen bestätigen, dass EMS im Vergleich zu herkömmlichen Schlingenpolypektomietechniken Blutungen nach der Polypektomie verhindert und die vollständige Entfernung von Polypen erleichtert. EMS könnte daher die Koloskopie als Instrument der Darmkrebsprävention sicherer und effektiver machen.
Koloskopie-Komplikationen wie Blutungen und Perforationen nach der Polypektomie treten aufgrund von Verletzungen der Submukosa und des tieferen Gewebes auf. Eine solche Verletzung ist bei der Entfernung präkanzeröser Dickdarmpolypen nicht notwendig und sollte vermieden werden.
Die Submukosa ist reich an Bindegewebe und Blutgefäßen. Sie wird bei der Schlingenpolypektomie häufig eingeklemmt, was einen vollständigen Verschluss der Schlinge ohne Guillotine oder Hitzekoagulation verhindert. Bei der TCSP-Technik zur Guillotine des gesamten umschlungenen Gewebes wird die eingeschlossene Submukosa geschädigt, wenn auch in geringerem Maße als bei der Hot-Snare-Technik (39). Die erhöhte unmittelbare Blutungsrate bei TCSP, die einen hämostatischen Eingriff wie das Clipping erfordert, könnte nicht nur die Erkennung von Polypenrückständen beeinträchtigen, sondern schränkt auch die Anwendung auf größere Polypen ein (39-42). Indem das Schneiden der Submukosa vollständig vermieden wird, verhindert EMS sofortige und verzögerte Blutungen und scheint auch bei größeren Polypen sicher zu sein, ohne dass die Antikoagulation und Thrombozytenaggregationshemmer abgesetzt werden müssen (Abbildung 5).

Abbildung 5. (A) Ein 15 mm großes sessiles serriertes Adenom im transversalen Kolon mit zytologischer Dysplasie (Polyp Nr. 7 in Tabelle 3). (B) Polypektomiestelle unmittelbar nach Entfernung des Polypen in (A). (C) Dieselbe Polypektomie-Stelle wie (B) 6 Monate später. Bei diesem Patienten wurde Clopidogrel zum Zeitpunkt der Polypektomie nicht abgesetzt. Angesichts des Sicherheitsprofils von EMS wurde beschlossen, die Polypektomie durchzuführen, da sie aufgrund ihres fortgeschrittenen Alters (4 Monate vor Vollendung des 80. Lebensjahres) und ihres langen und gewundenen Dickdarms mit Verstopfung eine schwierige Wiederholungs-Koloskopie haben könnte. Sie hatte schließlich eine Koloskopie 6 Monate später für die Hochrisiko-Histopathologie des Polypen.
Ein potenzielles Problem ist die Vollständigkeit der EMS-Polypektomie, insbesondere im Pseudostamm. Die Biopsiedaten unserer Polypektomiestelle und die Analyse des Pseudostiels nach Kaltschlingenpolypektomie (43) zeigen eine vollständige Entfernung der Polypen. Dies wird auch durch die Häufigkeit untermauert, mit der wir bei der Follow-up-Koloskopie mögliche Restpolypen an den EMS-Polypektomiestellen entdeckten (wahrscheinlich 0 % und höchstens 4,1 % neoplastische oder 10,5 % fortgeschrittene Polypen), was deutlich niedriger ist als in früheren Berichten (18). Auf der Grundlage von Stichproben an den Rändern der endoskopisch „vollständigen“ Polypektomien stellten Pohl et al. bei 10,1 % aller Polypektomien unerwartet persistierende Neoplasmen fest, 17,3 % der 10-20 mm großen neoplastischen Polypen, höhere Raten für SSAs als für TAs (31 vs. 7,2 %), und 47,6 % aller großen (10-20 mm) SSAs wurden unvollständig entfernt (18). Zhang et al. berichteten in ähnlicher Weise über eine unvollständige TCSP von Polypen (6-9 mm) (8,5 % im Durchschnitt und 13 % bei stückweiser Resektion), wobei eine unmittelbare Blutung, die ein Clipping erforderte, bei 1,8 bzw. 2,7 % pro Polyp bzw. pro Patient auftrat (40). Eine wahrscheinliche Erklärung für diesen Unterschied ist, dass die EMS-Polypektomiestellen im Vergleich zu denen der traditionellen Kalt- oder Heißschlingenpolypektomie weniger traumatisch waren und nur minimale Blutungen oder Verformungen aufwiesen. Dies erleichterte nicht nur die Erkennung und Entfernung von Polypenresten, sondern ermöglichte auch eine großzügigere Resektion der Schleimhaut, ohne dass Blutungen oder andere Komplikationen zu befürchten waren. Die vollständige Polypektomie ist wichtig für die Verhinderung von Intervallkarzinomen, die 2,6-9,0 % aller Kolonkarzinome ausmachen (19).
Bei gestauchten Polypen ist das Risiko einer Blutung nach der Polypektomie hoch, da eine Verletzung der Submukosa unvermeidlich ist. Die gewonnene Erfahrung könnte zu einer geringeren Blutung aus diesen seltenen Polypen geführt haben, da ZJC den Schnitt von der Dickdarmwand weg und in die Nähe des Polyps am Stiel verlegt hat. Die Verringerung der Blutungen aus gestielten Polypen nach der Polypektomie vor und nach der EMS war jedoch statistisch nicht signifikant. Wir glauben, dass die EMS und nicht die gewonnene Erfahrung zur Beseitigung von Nachblutungen aus nicht gestielten Polypen geführt hat.
Ein Hämatom könnte sich selten aus einem gerissenen submukösen Gefäß während der EMS großer Polypen entwickeln. Die intakte Submukosa verhindert jedoch, dass sich ein Hämatom vergrößert und ausblutet. Unserer Erfahrung nach scheint die natürliche Barriere der intakten Submukosa der Koagulation durch die heiße Schlinge überlegen zu sein, wenn es darum geht, eine verzögerte Nachblutung nach der Polypektomie zu verhindern.
Im Vergleich zur EMR ist die EMS viel einfacher durchzuführen und kann selbst bei einigen großen, sich seitlich ausbreitenden Läsionen (Tabelle 3) ohne zusätzliche Ressourcen und mit einem viel geringeren Blutungsrisiko das gleiche Polypektomieergebnis erzielen. Weitere Studien sind erforderlich, um EMS und EMR direkt miteinander zu vergleichen, insbesondere bei der Entfernung großer Polypen.
Da bei EMS nur die Mukosa entfernt wird, ist ein Frühkarzinom mit submuköser Invasion nicht zu erfassen. Bemerkenswert ist, dass wir während des Studienzeitraums einen Fall eines 10 mm großen, unverdächtigen, karzinomatösen, sessilen Dickdarmpolypen hatten. Interessanterweise sickerte die Polypektomiestelle weiter und musste hämoclippiert werden. Die Diagnose wurde erst nach der Entfernung des Polypen gestellt, und der Patient wurde anschließend ohne Zwischenfälle zur Operation überwiesen. Eine vergrößerte Grubenmusterdiagnose könnte in diesem Fall bei der Prädiagnose hilfreich gewesen sein, und eine sorgfältige Untersuchung des Polypen ist vor der EMS immer zu empfehlen, um zu vermeiden, dass ein kanzeröser Polyp herausgeschnitten wird. In diesem Fall traten jedoch keine nachteiligen Folgen auf.
Die EMS kann mit Spiral- oder Exacto-Schlingen und in Kombination mit einer submukösen Injektion zur Schleimhautabhebung, Argonplasma-Koagulation oder Abtragung der heißen Schlingenspitze durchgeführt werden. Es bleibt abzuwarten, ob sie die EMS-Wirksamkeit weiter verbessern.
EMS wurde von einigen MNGI-Kollegen erfolgreich angewandt (Tabelle 3, #37-38), aber die Verallgemeinerbarkeit ihrer Vorteile bedarf weiterer Bestätigungsstudien. Nichtsdestotrotz könnte diese relativ einfache, aber effektive Innovation in der Polypektomietechnik eine neue Grenze für eine sicherere und wirksamere Darmkrebsprävention durch Koloskopie darstellen.
Ethikerklärung
Diese retrospektive Studie wurde am 12. Mai 2016 (IRB ID: 5502) vom Sterling IRB (www.sterlingirb.com) erteilt und wurde in Übereinstimmung mit dem genehmigten Protokoll der klinischen und histopathologischen Überprüfung von Mucosal Stripping als technische Innovation der Koloskopie-Polypektomie und den Empfehlungen des Minnesota Gastroenterology Quality Committee durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung zu den Koloskopieverfahren und der Behandlung gemäß der Deklaration von Helsinki.
Beiträge der Autoren
ZC initiierte das Untersuchungskonzept und -design, die Erfassung, Analyse und Interpretation der Daten sowie die Abfassung und Überarbeitung des Manuskripts. KB beteiligte sich an der Erfassung, Analyse und Interpretation der Daten sowie an der kritischen Überarbeitung des Manuskripts.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Dr. Douglas Nelson, Dr. Robert Ganz, Dr. John Allen, Dr. David Lieberman, Dr. Douglas Rex, Dr. Linda Rabeneck, Dr. Aasma Shaukat, Dr. Zong-ming Eric Chen, Dr. PhD, Dr. Jeffrey Rank, Dr. Joshua Colton und Dr. Cecil Chally für die kritische Durchsicht und hilfreiche Anregungen, Zengri Wang und Yongquan Xue PhD für die Unterstützung bei der statistischen Analyse, Brian Hardwig für die Hilfe bei der Einrichtung der Videoaufnahmen, Carlie Leyde, Amy Lounsbury, Martha Carland, JaNelle Gorg, Siri McCord, Karen Lang und Marit Brock für die administrative Unterstützung. Wir danken auch den Endoskopieschwestern von Minnesota Gastroenterology für die Unterstützung bei der EMS-Polypektomie.
Ein Poster mit vorläufigen Ergebnissen dieser Untersuchung wurde auf der DDW 2017 in Chicago, USA, vorgestellt. Ein Abstract des Posters wurde in Gastrointestinal Endoscopy 2017; 85:AB520 veröffentlicht.
Supplementary Material
Das ergänzende Material zu diesem Artikel ist online zu finden unter: https://www.frontiersin.org/articles/10.3389/fmed.2018.00312/full#supplementary-material
Abkürzungen
EMS, endoskopisches Mukosastripping; EMR, endoskopische Mukosaresektion; ESD, endoskopische Submukosadissektion; TCSP, traditionelle Cold Snare Polypektomie; TA, tubuläres Adenom; TVA(HD), tubulovillöses Adenom (mit hochgradiger Dysplasie); SSA(CD), sessiles serriertes Adenom (mit zytologischer Dysplasie); UC, Colitis ulcerosa.
1. Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. Die nationale Arbeitsgruppe der Polypenstudie. N Engl J Med. (1993) 329:1977-81. doi: 10.1056/NEJM199312303292701
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med. (2012) 366:687-96. doi: 10.1056/NEJMoa1100370
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med. (2013) 369:1095-105. doi: 10.1056/NEJMoa1301969
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Amri R, Bordeianou LG, Sylla P, Berger DL. Auswirkung der Screening-Koloskopie auf die Ergebnisse der Dickdarmkrebs-Chirurgie. JAMA Surg. (2013) 148:747-54. doi: 10.1001/jamasurg.2013.8
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brenner H, Stock C, Hoffmeister M. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies. BMJ (2014) 348:g2467-78. doi: 10.1136/bmj.g2467
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Sonnenberg A, Delcò F, Inadomi JM. Kosteneffektivität der Koloskopie bei der Früherkennung von Darmkrebs. Ann Intern Med. (2000) 133:573-84. doi: 10.7326/0003-4819-133-8-200010170-00007
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Cost-effectiveness of colorectal cancer screening. Epidemiol Rev. (2011) 33:88-100. doi: 10.1093/epirev/mxr004
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Lieberman DA Screening auf kolorektales Karzinom bei Personen mit durchschnittlichem Risiko: aktuelle Methoden und neue Probleme. JAMA Intern Med. (2014) 174:10-11. doi: 10.1001/jamainternmed.2013.11499
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Koloskopische Rückzugszeiten und Adenom-Erkennung bei der Screening-Koloskopie. N Engl J Med. (2006) 355:2533-41. doi: 10.1056/NEJMoa055498
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, et al. Qualitätsindikatoren für die Koloskopie und das Risiko von Intervallkrebs. N Engl J Med. (2010) 362:1795-803. doi: 10.1056/NEJMoa0907667
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, et al. Adenoma detection rate and risk of colorectal cancer and death. N Engl J Med. (2014) 370:1298-306. doi: 10.1056/NEJMoa1309086
CrossRef Full Text | Google Scholar
12. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol. (2006) 101:343-50. doi: 10.1111/j.1572-0241.2006.00390.x
CrossRef Full Text | Google Scholar
13. Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US multi-society task force on colorectal cancer. Gastroenterology (2012) 143:844-57. doi: 10.1053/j.gastro.2012.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB, et al. Qualitätsindikatoren für die Koloskopie. Gastrointest Endosc. (2015) 81:31-53. doi: 10.1016/j.gie.2014.07.058
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Waye JD, Lewis BS, Yessayan S. Colonoscopy: a prospective report of complications. J Clin Gastroenterol. (1992) 15:347-51. doi: 10.1097/00004836-199212000-00018
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ko CW, Dominitz JA. Komplikationen der Koloskopie: Ausmaß und Management. Gastrointest Endosc Clin N Am. (2010) 20:659-71. doi: 10.1016/j.giec.2010.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ASGE Standards of Practice Committee, Fisher, DA, Maple, JT, Ben-Menachem, T, Cash, BD, Decker, GA, et al. Complications of colonoscopy. Gastrointest Endosc. (2011) 74:745-52. doi: 10.1016/j.gie.2011.07.025
CrossRef Full Text | Google Scholar
18. Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Incomplete polyp resection during colonoscopy-results of the complete adenoma resection (CARE) study. Gastroenterology (2013) 144:74-80. doi: 10.1053/j.gastro.2012.09.043
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Adler J, Robertson DJ. Intervall-Kolorektalkarzinom nach der Koloskopie: Erklärungen und Lösungen suchen. Am J Gastroenterol. (2015) 110:1657-64. doi: 10.1038/ajg.2015.365
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Ranasinghe I, Parzynski CS, Searfoss R, Montague J, Lin Z, Allen J, et al. Differences in colonoscopy quality among facilities: development of a post-colonoscopy risk-standardized rate of unplanned hospital visits. Gastroenterology (2016) 150:103-13. doi: 10.1053/j.gastro.2015.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Rosen L, Bub DS, Reed JF, Nastasee SA. Blutungen nach koloskopischer Polypektomie. Dis Colon Rectum. (1993) 36:1126-31. doi: 10.1007/BF02052261
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Gibbs DH, Opelka FG, Beck DE, Hicks TC, Timmcke AE, Gathright JB. Postpolypektomie Kolonblutung. Dis Colon Rectum. (1996) 39:806-10. doi: 10.1007/BF02054448
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Postpolypektomie untere GI-Blutungen: deskriptive Analyse. Gastrointest Endosc. (2000) 51:690-6. doi: 10.1067/mge.2000.105773
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, et al. Complications of colonoscopy in an integrated health care delivery system. Ann Intern Med. (2006) 145:880-6. doi: 10.7326/0003-4819-145-12-200612190-00004
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Tolliver KA, Rex DK. Colonoscopic polypectomy. Gastroenterol Clin North Am. (2008) 37:229-51, ix. doi: 10.1016/j.gtc.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Rabeneck L, Paszat LF, Hilsden RJ, Saskin R, Leddin D, Grunfeld E, et al. Blutungen und Perforationen nach ambulanter Koloskopie und ihre Risikofaktoren in der üblichen klinischen Praxis. Gastroenterology (2008) 135:1899-906. doi: 10.1053/j.gastro.2008.08.058
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, et al. Unerwünschte Ereignisse nach ambulanter Koloskopie in der Medicare-Population. Ann Intern Med. (2009) 150:849-57. doi: 10.7326/0003-4819-150-12-200906160-00008
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Risikofaktoren für schwere verzögerte Blutungen nach Polypektomie. Endoscopy (2008) 40:115-9. doi: 10.1055/s-2007-966959
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions. Endoscopy (2011) 43:506-11. doi: 10.1055/s-0030-1256346
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Bahin FF, Rasouli KN, Byth K, Hourigan LF, Singh R, Brown GJ, et al. Prediction of clinical significant bleeding following wide-field endoscopic resection of large sessile and lateral spreading colorectal lesions: a clinical risk score. Am J Gastroenterol. (2016) 111:1115-22. doi: 10.1038/ajg.2016.235
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Albéniz E, Fraile M, Ibáñez B, Alonso-Aguirre P, Martínez-Ares D, Soto S, et al. A scoring system to determine risk of delayed bleeding after endoscopic mucosal resection of large colorectal lesions. Clin Gastroenterol Hepatol. (2016) 14:1140-7. doi: 10.1016/j.cgh.2016.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Wolff WI, Shinya H. Früherkennung von Dickdarmkrebs durch Kolonendoskopie (Darmspiegelung). Cancer (1974) 34:912-34.
Google Scholar
33. Tedesco FJ. Colonoscopic polypectomy. In: Silvia SE, editor. Therapeutic Gastrointestinal Endoscopy (1984) New York, NY: Igaku-Shoin. p. 269-88.
Google Scholar
34. Waye JD. Polypectomy-basic principles. In: Waye JD, Rex DK, Williams CB, editors. Colonoscopy Principles and Practice. Malden, MA; Oxford: Carlton (2003) p. 410-9. doi: 10.1002/9780470986943.ch35
CrossRef Full Text | Google Scholar
35. Waye JD. Polypektomie: Grundprinzipien. In: Waye JD, Rex DK, Williams CB, editors. Colonoscopy Principles and Practice. Oxford; Hoboken, NJ: Wiley-Blackwell (2009) p. 572-81.
Google Scholar
36. Meeroff JC. Entfernung von mittelgroßen, sessilen Kolonpolypen ohne Diathermie. Gastrointest Endosc. (1989) 35:136. doi: 10.1016/S0016-5107(89)72740-1
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Tappero G, Gaia E, De Giuli P, Martini S, Gubetta L, Emanuelli G. Cold snare excision of small colorectal polyps. Gastrointest Endosc. (1992) 38:310-3. doi: 10.1016/S0016-5107(92)70422-2
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Chen ZJ., Batts K. P. (2017). Mo2011 elimination of post-polypectomy bleeding and more complete polyp removal with endoscopic mucosal stripping (EMS). Gastroenterol. Endos. 85(Suppl. 5):AB520. Abstract Mo2011. doi: 10.1016/j.gie.2017.03.1198
CrossRef Full Text | Google Scholar
39. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Entfernung kleiner kolorektaler Polypen bei antikoagulierten Patienten: ein prospektiver randomisierter Vergleich von Cold Snare und konventioneller Polypektomie. Gastrointest Endosc. (2014) 79:417-23. doi: 10.1016/j.gie.2013.08.040
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Zhang Q, Gao P, Han B, Xu J, Shen Y. Polypectomy for the complete endoscopic resection of small colorectal polyps. Gastrointest Endosc. (2017). 87(3):733-740. doi: 10.1016/j.gie.2017.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Paspatis GA, Tribonias G, Konstantinidis K, Theodoropoulou A, Vardas E, Voudoukis E, et al. A prospective randomized comparison of cold vs hot snare polypectomy in the occurrence of postpolypectomy bleeding in small colonic polyps. Colorectal Dis. (2011) 13:e345-8. doi: 10.1111/j.1463-1318.2011.02696.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Repici A, Hassan C, Vitetta E, Ferrara E, Manes G, Gullotti G, et al. Safety of cold polypectomy for < 10mm polyps at colonoscopy: a prospective multicenter study. Endoscopy. (2012) 44:27-31. doi: 10.1055/s-0031-1291387
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Tutticci N, Burgess NG, Pellise M, Mcleod D, Bourke MJ. Charakterisierung und Bedeutung von Ausstülpungen im Schleimhautdefekt nach Cold Snare Polypektomie. Gastrointest Endosc. (2015) 82:523-8. doi: 10.1016/j.gie.2015.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar