- Einführung
- Materialien und Methoden
- Probanden und Versuchsparadigma
- Funktionelle Magnetresonanztomographie und Blut-Sauerstoff-Spiegel-abhängige Signale
- Auswahl der interessierenden Regionen für Blut-Sauerstoff-Spiegel-abhängige Signale aus Kleinhirn/Hirnstamm
- Berechnung der gemittelten, vom Blutsauerstoffgehalt abhängigen, Schlag-zu-Schlag-Intervall- und Atemwellen
- Ergebnisse
- Diskussion
- Koinzidenz von Atemwellen und Respiratorischen Blut-Sauerstoff-Spiegel-abhängigen Artefakten
- Rhythmische neurale Aktivierung in Verbindung mit neuraler Blut-Sauerstoff-Spiegel-abhängiger Oszillation
- Neurale Aktivität als „treibende Kraft“ für langsame Herzfrequenz-Oszillationen
- Grenzwerte und Zukunftsaussichten
- Schlussfolgerung
- Datenverfügbarkeit
- Ethikerklärung
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagungen
- Abkürzungen
Einführung
Respiratorische Sinusarrhythmie (RSA) spiegelt die Beschleunigung der Herzfrequenz (HR) während der Inspiration und die Verlangsamung der HR während der Exspiration wider. Sie ist ein grundlegendes Prinzip (Yasuma und Hayano, 2004) und das Kernphänomen der paced resonance breathing at 6/min, das mit einer verstärkten niederfrequenten Herzfrequenzvariabilität (HRV), einem erhöhten emotionalen Wohlbefinden (Mather und Thayer, 2018) und einer verbesserten Verarbeitung negativer Emotionen (Zaccaro et al., 2018) assoziiert ist. Interessanterweise gibt es Ausnahmen von der RSA, bei denen das Schlag-zu-Schlag-Intervall (RRI) der Herzfrequenz während der Inspiration zunimmt und die RRI-Phase relativ zum Atemrhythmus verläuft (Rassler et al., 2018). Diese ungewöhnliche paradoxe RSA wurde bei einer Minderheit gesunder Teilnehmer während des Scannens mit funktioneller Magnetresonanztomographie (fMRT) gefunden, einer unangenehmen, manchmal klaustrophobischen Situation, die üblicherweise mit erhöhter Zustandsangst verbunden ist (Munn et al., 2015; Pfurtscheller et al., 2018).
Langsame Spontanatmungswellen mit einer Rate zwischen 6 und 9 Atemzügen/min werden ebenfalls von einer erhöhten HRV begleitet und könnten somit die Verarbeitung unangenehmer Emotionen wie Angst und Stress erleichtern (Thayer und Lane, 2009). Aufgrund der führenden Rolle der RRI gegenüber den Atemschwingungen während des ungewöhnlichen Aufhörens der RSA (Rassler et al., 2018), scheint ein autonomer neuronaler Oszillator (zentraler Schrittmacher; Julien, 2006) im Gehirn wahrscheinlich, der als Quelle für langsame RRI-Oszillationen fungiert. Es ist bemerkenswert, dass Perlitz et al. (2004) über eine neue Art von kardiovaskulärem Rhythmus im 0,15-Hz-Band bei Mensch und Hund mit einem gemeinsamen Ursprung im Hirnstamm berichteten. Das interessanteste Merkmal dieses breitbandigen „0,15-Hz-Rhythmus“ (der auch Frequenzkomponenten nahe 0,1 Hz enthält) ist, dass die Perioden der Spindelwellen im Verhältnis 1:1 mit der Atmung phasengekoppelt sind. Unser Hauptforschungsinteresse bestand darin, diesen Schrittmacher zu identifizieren, von dem angenommen wird, dass er sich im Hirnstamm befindet (Lambertz und Langhorst, 1998; Perlitz et al.,
Das BOLD-Signal quantifiziert nicht direkt die neuronale Aktivität selbst, sondern reagiert empfindlich auf Veränderungen der zerebralen Stoffwechselrate, des zerebralen Blutflusses und des zerebralen Blutvolumens (Obrig et al., 2000; Buxton et al., 2004) sowie auf verschiedene Arten von Bewegungen (Brustkorb- und Blutgefäßbewegungen; Birn et al., 2006). Daher können BOLD-Signale aus neuronalen und nicht-neuronalen (z. B. Gefäßbewegungen) Komponenten zusammengesetzt sein. Es wird erwartet, dass im Hirnstamm mit seinem großen Blutgefäß (Arteria basilaris) und der postulierten neuralen 0,15-Hz-Quelle (Perlitz et al., 2004) zwei BOLD-Signale unterschiedlichen Ursprungs identifiziert werden können. Wir gehen davon aus, dass eines davon aus der Bewegung der Blutgefäße (BOLDv) resultiert und den Beginn einer langsamen Atmungsaktion anzeigt, da es fast gleichzeitig mit der neuronalen Aktivierung der Atmungsneuronen auftritt. Das andere ist vermutlich mit einer neuronalen Aktivierung (BOLDn) verbunden, die um die neurovaskuläre Kopplungszeit von 2-3 s verzögert ist (Mateo et al., 2017). Wir spekulieren, dass beide BOLD-Signale auf einen zentralen Schrittmacher im Hirnstamm hinweisen.
Materialien und Methoden
Probanden und Versuchsparadigma
Die untersuchte Probandengruppe war die gleiche (Alter 23,8 ± 3,3 Jahre), wie sie kürzlich von Rassler et al. (2018) analysiert wurde. Die Aufzeichnung und Vorverarbeitung von EKG und Atmung wurden in dieser Arbeit beschrieben. Alle Teilnehmer gaben eine informierte schriftliche Zustimmung zum Studienprotokoll, das von der lokalen Ethikkommission der Universität Graz genehmigt worden war.
Funktionelle Magnetresonanztomographie und Blut-Sauerstoff-Spiegel-abhängige Signale
Funktionelle Bilder wurden mit einem 3-T-Scanner (Magnetom Skyra) unter Verwendung einer Multiband-GE-EPI-Sequenz (Moeller et al, 2010) mit einer simultanen Sechs-Band-Akquisition mit TE/TR = 34/871 ms, 52° Flipwinkel, 2 mm × 2 mm × 2 mm Voxelgröße, 66 zusammenhängenden axialen Schichten (11 × 6), einer Akquisitionsmatrix von 90 × 104 und einem FOV von 180 mm × 208 mm. Diese Abtastrate von 871 ms (1,15 Hz Abtastfrequenz) ermöglicht die Untersuchung langsamer Schwingungen im Bereich von 0,1-0,15 Hz. Für weitere Details zur Vorverarbeitung siehe Pfurtscheller et al. (2018). Der automated anatomical labeling (AAL)-Atlas (Tzourio-Mazoyer et al., 2002) wurde verwendet, um Zeitverläufe von BOLD-Signalen in 116 Regionen von Interesse (ROIs) zu extrahieren. Dieser Atlas zeigt keine ROIs im Hirnstamm, sondern nur in unmittelbarer Nähe des Kleinhirns und des Vermis. Aufgrund der Nähe dieser Regionen und der Nähe einer großen Arterie kann man davon ausgehen, dass die Signale der AAL-ROIs mit der Bezeichnung „Kleinhirn“ teilweise die Aktivität des Hirnstamms widerspiegeln.
Auswahl der interessierenden Regionen für Blut-Sauerstoff-Spiegel-abhängige Signale aus Kleinhirn/Hirnstamm
Unter den 116 ROIs des AAL-Atlas entsprechen ROI 91 bis ROI 108 axialen Schnitten aus dem Kleinhirn einschließlich des Hirnstamms (Tzourio-Mazoyer et al., 2002). T1-Bilder aus dem axialen Schnitt (Talairach-Raum z = -34) dokumentieren die Nähe von Kleinhirn und Hirnstamm (Abbildung 1). Aufgrund der geringen Anzahl von Voxeln (<200) wurden die ROIs 107 und 108 von der weiteren Analyse ausgeschlossen. ROIs aus dem Kleinhirn/Hirnstamm wurden visuell inspiziert, um nach geeigneten ROIs zu suchen, d. h. ROIs mit einem guten Signal-Rausch-Verhältnis und dominanten langsamen BOLD-Wellen. Die folgenden ROIs wurden identifiziert: 96, 98, 100, 103 und 105. Die Zahlen bezeichnen die ROI-Bezeichnungen gemäß dem AAL-Atlas. Ungerade und gerade Zahlen bezeichnen die linke bzw. rechte Hemisphäre.
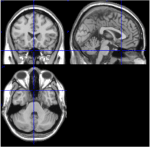
Abbildung 1. T1-Bilder aus medialen, sagittalen und axialen Schichten einer Person (Talairach-Raum 0, 20, -34). In der sagittalen Schicht (oberes rechtes Bild) ist die Pons deutlich sichtbar, und in der axialen Schicht (unten) wird die Nähe von Kleinhirn und Hirnstamm dokumentiert.
Berechnung der gemittelten, vom Blutsauerstoffgehalt abhängigen, Schlag-zu-Schlag-Intervall- und Atemwellen
Die Mittelwertbildung ermöglicht eine Verbesserung des Signal-Rausch-Verhältnisses, erfordert jedoch die Verwendung eines Triggers. Da solche Trigger in Ruhezustandsdaten nicht verfügbar sind, wurden die rhythmisch auftretenden Maxima (Peaks) des RRI-Signals verwendet (Pfurtscheller et al., 2017): Zunächst wurden die markantesten Peaks der RRI-Signale im Abstand von mindestens einigen Sekunden identifiziert. Im Fall von 0,1-Hz-Oszillationen lagen diese Abstände zwischen den Spitzen bei etwa 10 s, im Fall von 0,15-Hz-Oszillationen bei etwa 7 s (ein Beispiel ist in Abbildung 2 durch die fast äquidistanten gestrichelten vertikalen Linien dargestellt). Die markierten RRI-Spitzen wurden als Auslöser für die Mittelwertbildung (Epochen mit 6 s vor und 6 s nach dem Auslöser) über die BOLD-, RRI- und Atmungssignale verwendet.
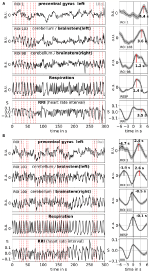
Abbildung 2. Beispiele für laufende BOLD-, RRI- und Atmungssignale und entsprechende gemittelte Wellen (±SE) für zwei Probanden, einer mit dominanten 0,1-Hz- und einer mit dominanten 0,15-Hz-Oszillationen. Die vertikalen gestrichelten Linien in den Feldern auf der linken Seite zeigen die Maxima (Spitzen) der RRI-Oszillationen an, die als Auslöser für die Mittelwertbildung verwendet wurden. Die Spitzen der gemittelten Wellen sind in den Feldern auf der rechten Seite angegeben.
Ergebnisse
Slow BOLD-Oszillationen im Kleinhirn/Hirnstamm zeichnen sich durch ihre günstige Signalqualität aus, aber, was noch wichtiger ist, durch ihr Zusammentreffen mit Oszillationen in RRI und Atmung. Wie in Rassler et al. (2018) berichtet, überwogen 0,1-Hz-Oszillationen während ~37% der Aufzeichnungszeit, während 0,15-Hz-Oszillationen in ~45% vorherrschten. Zwei charakteristische Beispiele für 0,1-Hz- (Proband 1Rb1) und 0,15-Hz-Oszillationen (Proband 11Ra1) sind in Abbildung 2 dargestellt. In beiden Fällen fallen RRI-Oszillationen großen Ausmaßes mit der Atmung in Form eines RRI-Anstiegs während der Inspiration zusammen und spiegeln sich auch deutlich in den BOLD-Signalen im Hirnstamm wider. Die unterschiedliche Dynamik von Spontanschwingungen bzw. Einzelwellen im Ruhezustand ist ein deutlicher Hinweis darauf, dass nicht nur ein, sondern eine Vielzahl von kardiovaskulären Rhythmen mit Frequenzkomponenten nahe 0,1 und 0,15 Hz existieren. Einige dieser Rhythmen werden während der Angstverarbeitung verstärkt, andere nicht, und einige sind im präfrontalen Kortex und im Hirnstamm synchronisiert, andere nicht.
Beispiele für spontane Signale und gemittelte Wellen von zwei charakteristischen Probanden sind in Abbildung 2 dargestellt. Die gemittelten Wellen mit markierten Spitzenlatenzen (Abstand von der RRI-Spitze) aller Probanden sind in Abbildung 3 dargestellt. Bemerkenswert ist die relativ geringe Varianz der gemittelten BOLD-Wellen im Hirnstamm, was die Zuverlässigkeit der Spitzenmessungen unterstreicht.
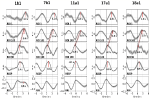
Abbildung 3. Gemittelte Wellen (±SE) der BOLD-Signale aus dem linken präzentralen Gyrus (ROI 1), dem linken Hirnstamm (BOLDn, ROIs 103, 105), dem rechten Hirnstamm (BOLDv, 96, 98, 100), der Atmung und den RR-Intervallen (von oben nach unten) von allen fünf Probanden. Die Spitzenlatenzen (Differenz zum RRI-Peak) von wichtigen Peaks sind markiert. Die Zeitverschiebung von 2-3 s zwischen den beiden BOLD-Signalen aus dem Kleinhirn/Hirnstamm ist durch eine gepunktete Linie gekennzeichnet.
Die BOLD-Welle in der rechten Hemisphäre, die der Atemwelle um 0,3 ± 0,2 s vorausging, wurde als BOLDv interpretiert, und die BOLD-Welle in der linken Hemisphäre, die der Atemwelle um 2,3 ± 0,5 s hinterherhinkte, wurde als BOLDn betrachtet. Die Spitzendifferenz zwischen BOLDv- und BOLDn-Wellen betrug 2,6 ± 0,4 s.
Die gemittelten Wellen in Abbildung 3 verdeutlichen die deutliche Phasenverschiebung zwischen den beiden BOLD-Signalen im Hirnstamm (BOLDn, BOLDv) bei allen fünf Probanden. Die Spitzenwertunterschiede sind durch gestrichelte Linien gekennzeichnet. Zusätzlich zu den beiden BOLD-Signalen aus dem Hirnstamm wurde das BOLD-Signal aus dem linken präzentralen Gyrus (ROI 1) als Kontrolle analysiert. Obwohl die gemittelten BOLD-Wellen im präfrontalen Kortex (PFC) eine erhöhte Varianz (SE) aufweisen, stimmen sie erstaunlich gut mit den BOLDn-Wellen im Kleinhirn/Hirnstamm überein. Dies bestätigt die starke Interaktion zwischen PFC und Hirnstamm im langsamen Frequenzbereich um 0,1 Hz.
Diskussion
Koinzidenz von Atemwellen und Respiratorischen Blut-Sauerstoff-Spiegel-abhängigen Artefakten
Atmung wird nicht nur von Brustkorbbewegungen, sondern auch von Bewegungen der zerebralen Blutgefäße begleitet (Birn et al., 2006). Es wurde eine stabile Zeitverschiebung von 0,3 ± 0,2 s zwischen der positiven Spitze des BOLDv-Signals im rechten Kleinhirn/Hirnstamm und dem Maximum jeder Atemwelle (Beginn der Exspiration) beobachtet. Die Atmung erfolgte spontan, und die Atmungsspitze verzögerte sich gegenüber der BOLDv-Spitze, was möglicherweise auf eine rege Vasomotion der Arteria basilaris, eines großen Blutgefäßes nahe der rostralen Seite des Pons, hinweist. Diese Vasomotion könnte als respiratorisches Artefakt betrachtet werden, das durch eine respiratorische Modulation der sympathoexzitatorischen Neuronen im rostroventrolateralen retikulären Nukleus verursacht wird. Ein deutlicher Einfluss des zentralen Atemmustergenerators auf die Aktivität der sympathischen Nerven wurde bei vielen Spezies, einschließlich des Menschen, beobachtet (Haselton und Guyenet, 1989; Häbler und Jänig, 1995; Eckberg, 2003; Mandel und Schreihofer, 2006). Die Abnahme der Aktivität dieser Neuronen in der rostroventrolateralen Medulla (d.h. sympathische Depression) während der Inspiration und die abrupte Wiederzunahme der Aktivität bei Beendigung der phrenischen Ausbrüche ist eines der vorherrschenden Muster der respiratorisch-sympathischen Kopplung (Haselton und Guyenet, 1989). Diese atmungsmodulierten sympathischen Oszillationen bewirken eine maximale Vasodilatation am Ende der Inspiration (d. h., Maximum des BOLD-Signals unmittelbar vor dem Beginn der Exspiration) und Vasokonstriktion während der Exspiration (Minimum des BOLD-Signals unmittelbar vor dem Beginn der Inspiration).
Rhythmische neurale Aktivierung in Verbindung mit neuraler Blut-Sauerstoff-Spiegel-abhängiger Oszillation
BOLD-Oszillationen (BOLDn) verzögerten das periodische Atmungsartefakt (BOLDv) um 2.Beide BOLD-Oszillationen wurden gleichzeitig in axialen Schnitten aufgezeichnet, wobei BOLDn mit der neuronalen Aktivität als treibende Kraft für die Spontanatmung in Verbindung gebracht wird und BOLDv eine mit dem Beginn der Exspiration verbundene Gefäßbewegung widerspiegelt. Diese Zeitverzögerung von 2-3 s entspricht der neurovaskulären Kopplungszeit (Mateo et al., 2017).
Verschiedene äußere Einflüsse auf die Emotionen, die durch die unbequeme Rückenlage mit dem Kopf des Probanden in einem begrenzten geräuschvollen Raum hervorgerufen werden, können zuerst primäre sensorische Bereiche aktivieren und von der kortikalen Projektion zu den Atemneuronen des Hirnstamms gefolgt werden. Darüber hinaus verändern interne, verhaltensbedingte Einflüsse, die von höheren Zentren ausgehen, die metabolischen Atemmuster. Die endgültige Atmungsleistung beinhaltet eine komplexe Interaktion zwischen kortikalen Strukturen, Hirnstamm und limbischem System und ist charakteristisch für die emotionale Atmung (Homma und Masaoka, 2008; Kato et al., 2018). Daher ist es durchaus plausibel, dass die Oszillationen im linken präzentralen Gyrus (ROI 1) mit den langsamen, neural induzierten BOLD-Oszillationen im Kleinhirn/Hirnstamm synchronisiert waren.
Neurale Aktivität als „treibende Kraft“ für langsame Herzfrequenz-Oszillationen
Die unterschiedliche Dynamik der im Ruhezustand beobachteten Kopplungsmuster deutet auf eine Vielzahl von kardiovaskulären Rhythmen im Frequenzband zwischen 0,1 und 0,15 Hz hin. Dies unterstreicht die Bedeutung, Flexibilität und Komplexität der Gehirn-Herz-Interaktion und verdient weitere intensive Forschung.
Bei allen fünf Teilnehmern war das Kopplungsmuster zwischen Atmung und Herzfrequenz ganz im Gegensatz zur typischen RSA (Rassler et al., 2018), nämlich die RRI stieg während der Inspiration und sank während der Exspiration. In angstauslösenden Situationen ist die Atmung tendenziell schneller und die vagale Aktivität geringer, was zu einer höheren Herzfrequenz führt (kürzerer RRI). Wenn jedoch die Atmung in einer angstauslösenden Situation unbewusst/autonom verlangsamt wird, könnte die vagale Aktivität zunehmen, was zu einer niedrigeren HR (größerer RRI) führt. Es scheint, dass nicht nur die kortikale Aktivierung einen fast gleichzeitigen RRI-Anstieg auslöst (Barry, 1983; Damen und Brunia, 1987; Pfurtscheller und Lopes da Silva, 1999; Pfurtscheller et al., 2013), sondern unsere Studie liefert auch erste Belege dafür, dass auch ein zentraler Schrittmacher im Kleinhirn/Stammhirn als treibende Kraft für intrinsische RRI-Oszillationen und spontane langsame Atemwellen fungieren kann. Dieser Befund unterstützt die Arbeit von Perlitz et al. (2004) über den „0,15-Hz-Rhythmus“
Grenzwerte und Zukunftsaussichten
Die Auswahl der ROIs mit BOLD-Signalen guter Qualität im Kleinhirn/Hirnstamm erfolgte durch visuelle Inspektion. Dabei wurde zwischen BOLD-Oszillationen neuronalen Ursprungs und Bewegungsartefakten unterschieden. Letztere bezeichnen BOLD-Signale, die mit der Atmung zeitlich gekoppelt sind. Für weitere Studien wird die Berechnung von Phase-Locking Values (PLV; Pfurtscheller et al.(2017) zwischen RRI und einzelnen BOLD-Signalen im Kleinhirn/Stammhirn. Zusätzlich könnte die synchrone Auswertung von Beatmungsmetriken wie Tidalvolumen/Atmungsvolumen pro Zeit, endtidaler pCO2 und Art der Atmung (Nase vs. Mund) sowie der Einsatz verschiedener Entrauschungsmethoden in klinischen und tierexperimentellen Settings tiefere Einblicke in die komplexen Interaktionen der beteiligten Regulationssysteme geben.
Das „Abschalten“ der respiratorischen Sinusarrhythmie ist eine Ausnahme von einem grundlegenden physiologischen Phänomen, das z.B. in angstauslösenden Situationen auftreten kann. Unter 23 gesunden Teilnehmern einer fMRI-Studie wiesen nur fünf Probanden dieses paradoxe Kopplungsmuster auf.
Eine Voraussetzung für die BOLD-Analyse (Bn und Bv) im Hirnstamm ist die Koinzidenz von langsamer Atmung und RRI-Oszillationen; eine solche 1:1-Kopplung ist jedoch nur bei einer Minderheit der Teilnehmer zu finden. Daher ist diese Art der Analyse auf diese seltenen Fälle beschränkt. Dennoch ist davon auszugehen, dass ein zentraler Schrittmacher im Hirnstamm auch bei Personen mit normalem RSA und 1:2- oder 1:3-Kopplung (zwei oder drei Atemzüge während eines RRI-Zyklus) vorherrscht. Erste Ergebnisse der Berechnung der Phasenkopplung (PLV) zwischen BOLD-Oszillationen aus dem Hirnstamm und RRI-Oszillationen im 0,1- bis 0,15-Hz-Band unterstützen diese Annahme. Mit dieser Methode ist es möglich, die Schrittmacheraktivität im Hirnstamm unabhängig von der Atemfrequenz zu messen. Diese Arbeit ist noch nicht abgeschlossen.
Es ist zu beachten, dass der Grad der Angstzustände bei den Personen mit langsamer Spontanatmung zwischen AS = 14 und AS = 28 variierte (möglicher Bereich der AS-Werte: 10-40) und nicht jede Person mit erhöhten Angstwerten diese Art der langsamen Atmung aufwies. Wir kommen daher zu dem Schluss, dass keine eindeutige Beziehung zwischen langsamer Spontanatmung und Angstverarbeitung besteht.
Schlussfolgerung
1. Ruhezustands-BOLD-Oszillationen aus dem Kleinhirn/Hirnstamm können alternierende Frequenzen zwischen 0,1 und 0,15 Hz aufweisen, ähnlich wie bei RRI- und Atmungssignalen (Rassler et al., 2018).
2. Einige BOLD-Signale aus dem Kleinhirn/Hirnstamm können durch Vasomotion (Arteria basilaris) beeinflusst werden, während andere mit einer zentralen Schrittmacheraktivität im Hirnstamm verbunden sein können. Folglich konnten sowohl der tatsächliche Zeitpunkt des Atembeginns als auch seine neurale Quelle in den BOLD-Signalen nachgewiesen werden.
3. Die beiden gleichzeitig aufgezeichneten BOLD-Signale unterschiedlichen Ursprungs charakterisieren eine gemeinsame Quelle, was die Arbeit von Perlitz et al. (2004) unterstützt.
4. Die Ergebnisse deuten darauf hin, dass es Hinweise auf eine unbewusste emotionale Atmung bei 6-9/min (0,1-0,15 Hz) gibt, die – ähnlich wie die bewusste Resonanzatmung bei 6/min (0.1 Hz) das psychische Wohlbefinden fördert (Mather und Thayer, 2018) – auch die HRV erhöht und die Verarbeitung negativer Emotionen erleichtern kann.
Datenverfügbarkeit
Die für diese Studie generierten Datensätze sind auf Anfrage beim entsprechenden Autor erhältlich.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit den Empfehlungen der Deklaration von Helsinki von 1964 mit schriftlicher informierter Zustimmung aller Probanden durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Deklaration von Helsinki. Das Protokoll wurde von der Ethikkommission der Universität Graz genehmigt.
Beiträge der Autoren
GP trug zur Konzeptualisierung und zum ursprünglichen Entwurf bei. BR und AA halfen bei der Methodik, Datenverarbeitung, Statistik, dem Schreiben und der Visualisierung. AS, BR, GS, WK und JT überprüften und redigierten das Manuskript.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Die Autoren danken Thomas Zussner, David Fink und Karl Koschutnig, Universität Graz, für die Unterstützung bei der Datenerfassung.
Abkürzungen
BOLD, Blood-oxygenation-level-dependent; EKG, Elektrokardiogramm; (f)MRI, (funktionelle)Magnetresonanztomographie; HR, Herzfrequenz; HRV, Herzfrequenzvariabilität; PFC, Präfrontaler Kortex; ROI, Region of interest; RRI, Beat-to-beat interval; RSA, Respiratorische Sinusarrhythmie.
Barry, R. J. (1983). Primäre Bradykardie und die evozierte kardiale Reaktion im OP-Kontext. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Trennung von atemvariationsbedingten Fluktuationen von neuronal-aktivitätsbedingten Fluktuationen in der fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Modellierung der hämodynamischen Reaktion auf Hirnaktivierung. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., und Brunia, C. H. M. (1987). Veränderungen der Herzfrequenz und der langsamen Hirnpotentiale im Zusammenhang mit der motorischen Vorbereitung und der Stimulusantizipation bei einer Zeitschätzungsaufgabe. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). The human respiratory gate. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., and Jänig, W. (1995). Koordination von Sympathikus und Atmungssystem: neurophysiologische Experimente. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). Zentrale respiratorische Modulation der medullären sympathoexzitatorischen Neuronen bei der Ratte. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Atemrhythmen und Emotionen. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). Das Rätsel der Mayerschen Wellen: Fakten und Modelle. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., and Homma, I. (2018). Beziehungen zwischen Merkmalen und Atmungsparametern bei ruhiger Atmung bei normalen Probanden. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., and Langhorst, P. (1998). Gleichzeitige Veränderungen der rhythmischen Organisation in Hirnstammneuronen, Atmung, Herz-Kreislauf-System und EEG zwischen 0,05 Hz und 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., und Schreihofer, A. M. (2006). Zentrale respiratorische Modulation barosensitiver Neuronen in der caudalen ventrolateralen Medulla der Ratte. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., and Kleinfeld, D. (2017). Entrainment von vasomotorischen Fluktuationen der Arterien durch neuronale Aktivität ist eine Grundlage der vom Sauerstoffgehalt des Blutes abhängigen Konnektivität im „Ruhezustand“. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., and Thayer, J. (2018). Wie die Herzfrequenzvariabilität die Netzwerke des emotionsregulierenden Gehirns beeinflusst. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband-Multislice-GE-EPI bei 7 Tesla mit 16-facher Beschleunigung unter Verwendung partieller paralleler Bildgebung mit Anwendung auf räumlich und zeitlich hochauflösende Ganzhirn-FMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., and Murphy, F. (2015). Klaustrophobie in der Magnetresonanztomographie: eine systematische Übersicht. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontane niederfrequente Oszillationen der zerebralen Hämodynamik und des Stoffwechsels bei erwachsenen Menschen. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Herz-Kreislauf-Rhythmen im 0,15-Hz-Band: gemeinsamer Ursprung identischer Phänomene bei Mensch und Hund in der retikulären Formation des Hirnstamms? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., und Lopes da Silva, F. (1999). Ereignisbezogene EEG/MEG-Synchronisation und Desynchronisation: Grundprinzipien. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Gehirn-Herz-Kommunikation: Nachweis von „zentralen Schrittmacher“-Oszillationen mit einer dominanten Frequenz von 0,1 Hz im Cingulum. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synchronisation intrinsischer 0,1-Hz-Blutsauerstoffspiegel-abhängiger Oszillationen in Amygdala und präfrontalem Kortex bei Probanden mit erhöhter State-Angst. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., and Müller-Putz, G. R. (2013). Zügige Herzfrequenz und EEG-Veränderungen während der Ausführung und Unterbrechung von cue-paced foot motor imagery. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). „Switch-off“ der respiratorischen Sinusarrhythmie kann bei einer Minderheit von Probanden während der funktionellen Magnetresonanztomographie (fMRT) auftreten. Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., and Lane, R. D. (2009). Claude Bernard und die Herz-Hirn-Verbindung: weitere Ausarbeitung eines Modells der neurovisceralen Integration. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automatisierte anatomische Markierung von Aktivierungen in SPM unter Verwendung einer makroskopischen anatomischen Parzellierung des MNI-MRI-Gehirns bei einer Person. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., and Hayano, J. (2004). Respiratorische Sinusarrhythmie: Warum synchronisiert sich der Herzschlag mit dem Atmungsrhythmus? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). How breath-control can change your life: a systematic review on psycho-phyiological correlates of slow breathing. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar