Introduction
Neutrophile sind die am häufigsten vorkommende Population zirkulierender weißer Blutkörperchen und die erste Verteidigungslinie des Wirtes gegen eindringende Krankheitserreger. Unter normalen Bedingungen haben zirkulierende neutrophile Granulozyten eine Halbwertszeit von 6-12 Stunden und befinden sich in einem funktionellen Ruhezustand. Während einer Entzündung gelangen die Neutrophilen schnell an den Ort der Infektion und Verletzung, verstärken die antimikrobielle Aktivität und sterben im infiltrierten Gewebe ab. Sie spielen eine wichtige Rolle im angeborenen Immunsystem, und bei systemischen Entzündungen wie Traumata, Verbrennungen, Sepsis und größeren chirurgischen Eingriffen werden signifikante neutrophile Reaktionen beobachtet.
Die Dysregulation neutrophiler Reaktionen, wie die übermäßige oder unkontrollierte Freisetzung proinflammatorischer Zytokine, kann jedoch bei schwerer Sepsis und Autoimmunkrankheiten zu Gewebe- oder Organschäden führen.
Die Leukozytenentfernungstherapie (LRT), Leukozytapherese (LCAP) oder Granulozyten/Monozyten-Apherese (GMA) ist eine Methode der therapeutischen Apherese, bei der periphere Leukozyten durch extrakorporale Zirkulation entfernt werden. Sie wurde als nicht-pharmakologische Behandlung bei Colitis ulcerosa (UC) und Morbus Crohn (CD) eingesetzt und hat eine ausgezeichnete kurzfristige Wirksamkeit gezeigt.
LCAP unter Verwendung von Cellsorba, einer Säule aus Polyethylen-Telephthalat-Fasern (Asahi-Kasei Medical, Tokio, Japan), entfernt Berichten zufolge ~100% der Granulozyten/Monozyten, ~60% der Lymphozyten und ~50% der Thrombozyten sowohl aus dem Einlass als auch aus dem Auslass des Cellsorba-Geräts. Obwohl die genauen Mechanismen der LRT noch nicht vollständig erforscht sind, wurde über mögliche Mechanismen berichtet, zu denen eine Verringerung der Anzahl aktivierter Leukozyten oder proinflammatorischer Zytokine wie Tumornekrosefaktor (TNF)-α, Interleukin (IL)-1β, IL-6 und IL-8 gehört.
Infektionen an der Operationsstelle (SSI) sind nach wie vor eine der häufigsten Ursachen für Morbidität bei größeren chirurgischen Eingriffen, was den Krankenhausaufenthalt verlängert und die medizinischen Kosten erhöht . Die japanische prospektive multizentrische Überwachung zeigte, dass 19,5 % der Patienten mit UC nach der Operation eine SSI entwickelten.
In einer Fall-Kontroll-Studie verglichen wir retrospektiv die Inzidenz von SSI zwischen Patienten, die sich einer Proktokolektomie mit Ileusbeutel-Anal-Anastomose (IPAA) unterzogen (n=29), und solchen, die sich einer IPAA mit postoperativer LCAP (n=43) unterzogen. Bei UC-Patienten, die sich einer Proktokolektomie mit IPAA unterzogen, konnte die postoperative LCAP die Zahl der SSIs signifikant reduzieren (p<0,01). In einer von uns durchgeführten multizentrischen prospektiven Studie wurde die Häufigkeit von SSI zwischen UC-Patienten, die sich einer Operation unterzogen (Kontrollgruppe; n=103), und solchen, die sich einer Operation mit postoperativem LCAP unterzogen (n=40), verglichen. SSI traten bei 4 von 37 Patienten (10,8 %) in der LCAP-Gruppe auf, während sie bei 29 von 103 Patienten (28,2 %) in der Kontrollgruppe auftraten, obwohl der Unterschied keine statistische Signifikanz erreichte (p=0,069).
Diese klinischen Beobachtungen deuten darauf hin, dass LCAP proinflammatorische Zytokin-produzierende aktivierte Leukozyten bei der postoperativen systemischen Entzündung aufgrund einer großen kolorektalen Operation entfernt und das Auftreten von SSI unterdrücken könnte. Wir haben über einen Zusammenhang zwischen neutrophiler Dysfunktion und postoperativen infektiösen Komplikationen berichtet.
Neutrophile sind die am häufigsten vorkommenden Zellen unter den zirkulierenden Leukozyten und können am häufigsten durch LCAP entfernt werden. Daher konzentrierten wir uns auf die Funktionen der zirkulierenden Neutrophilen, die vor und nach der LCAP isoliert wurden, um die therapeutischen Mechanismen der postoperativen LCAP auf das Auftreten von SSIs bei UC-Patienten nach der Operation zu klären.
Materialien und Methode
Patienten
Dreiundvierzig Patienten mit UC, die sich einer IPAA unterzogen, erhielten von 2004 bis 2008 eine postoperative LCAP in der Abteilung für gastrointestinale und pädiatrische Chirurgie der Mie University Graduate School of Medicine. Die Diagnose von UC basierte auf den klinischen, röntgenologischen, endoskopischen, chirurgischen und histopathologischen Daten. Vor der Operation erhielten die Patienten verschiedene medizinische Behandlungen, darunter entzündungshemmende Medikamente (Aminosalicylate, Kortikosteroide) oder Immunsuppressiva (Azathioprin, Mercaptopurin, Cyclosporin) oder beides. Das postoperative LCAP wurde einmal innerhalb von 2 Stunden nach der Operation durchgeführt. Patienten mit klinischen Symptomen einer Sepsis wurden von der Studie ausgeschlossen. Patienten mit instabiler Hämodynamik nach der Operation wurden ebenfalls gemäß dem Protokoll ausgeschlossen. Vor Beginn dieser Studie, die gemäß der Helsinki-Deklaration durchgeführt und vom Institutional Review Board (Nr. 474) genehmigt wurde, wurde von allen Patienten eine schriftliche Einverständniserklärung eingeholt.
Neutrophilenisolierung
Vor und nach der LCAP wurden Neutrophile von denselben Patienten vor und nach der Operation isoliert. Die Isolierung der Neutrophilen erfolgte nach einem zuvor beschriebenen Verfahren. Die Blutproben (10 ml) wurden mit einem gleichen Volumen phosphatgepufferter Kochsalzlösung (PBS) verdünnt, über ein Volumen Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Kanada) geschichtet und bei 600 × g 30 Minuten lang bei Raumtemperatur zentrifugiert. Nach Entfernung der mononukleären Zellen, des Plasmas und des Ficoll-Paque PLUS wurde das Pellet in 12 ml Ammoniumchloridlösung resuspendiert, um die roten Blutkörperchen zu lysieren, zweimal in PBS gewaschen und in PBS resuspendiert. Die Neutrophilen wurden zweimal mit PBS gewaschen und in TCM-10 resuspendiert. Die Zellpräparate wurden mittels Trypanblau-Ausschluss auf ihre Lebensfähigkeit (>99%) und mittels Durchflusszytometrie auf ihre Reinheit (>95% CD13+, CD33+ Granulozyten) geprüft.
Die phagozytische Aktivität
Ex vivo wurde die phagozytische Aktivität zirkulierender Neutrophiler gegen Escherichia coli zwischen Neutrophilen vor und nach der LCAP-Behandlung verglichen, die von identischen Patienten isoliert worden waren.
Die neutrophile Phagozytose wurde mit fluoreszierenden Biopartikeln gemessen. Zur Opsonisierung der bakteriellen Biopartikel wurden das rekonstituierte Opsonisierungsreagenz und die bakteriellen Biopartikel (5 × 105) gemischt, verwirbelt und 1 Stunde lang bei 37°C in einem befeuchteten 5 %-CO2-Inkubator inkubiert. Nach zweimaligem Waschen mit PBS und Abtrennung durch langsame Zentrifugation (1500 × g, 15 min, 4°C) wurden die Pellets mit Neutrophilen (5 × 105) in 1 mL Medium ohne Antibiotika für 3 h bei 37°C in einem befeuchteten 5%-igen CO2-Inkubator inkubiert. Nach 3 h Inkubation wurde die phagozytische Aktivität der Neutrophilen gegen E. coli mit einem FACScan (Becton-Dickinson, San Jose, CA, USA) analysiert und 10.000 Ereignisse pro Probe gezählt.
Präparation von E. coli
Escherichia coli (ATCC25922) wurde von American Type Culture Collection (Manassas, VA, USA) erworben und in Dulbecco’s Modified Eagle’s Medium (Invitrogen, Tokio, Japan) für 10 h bei 37°C kultiviert. Das Kulturmedium wurde bei 1.700 × g für 10 Minuten bei Raumtemperatur zentrifugiert, um ein Pellet zu erhalten, das zweimal gewaschen und in steriler Kochsalzlösung resuspendiert wurde. Ein Aliquot (100 μl) der Suspension wurde seriell mit steriler Kochsalzlösung verdünnt, auf Agar-B (Qbiogene, Carlsbad, CA, USA) plattiert und zur Bestimmung der Bakterienkonzentration 18 Stunden lang bebrütet. Der Rest wurde bis zur Verwendung bei -80°C gelagert.
Ko-Kultur von Neutrophilen mit E. coli
Unmittelbar vor der Verwendung wurde die E. coli-Suspension in Medium verdünnt, um eine Endkonzentration von 2,5 × 106 cfu/mL zu erreichen. Nach Opsonisierung von E. coli mit autologem Serum für 30 min bei 37°C wurden Neutrophile (2,5 × 105 /mL) in 1 mL Medium ohne Antibiotika für 3 h bei 37°C in einem befeuchteten 5%-igen CO2-Inkubator kokultiviert. Nach Zentrifugation der Zellen bei 600 × g für 10 Minuten bei 4°C wurde der Überstand gesammelt, um die Zytokinproduktion, die neutrophile Elastase (NE) und die Lebensfähigkeit der Neutrophilen zu analysieren.
Die Lebensfähigkeit der Neutrophilen
Ex vivo wurde die Lebensfähigkeit der zirkulierenden Neutrophilen gegenüber E. coli zwischen Neutrophilen verglichen, die vor und nach der LCAP von identischen Patienten isoliert wurden. Um die Lebensfähigkeit der Neutrophilen nach der Co-Kultur mit E. coli zu bewerten, wurde ein Apoptose-Assay durchgeführt.
Die Apoptose der Neutrophilen nach der Co-Kultur mit E. coli wurde mittels Durchflusszytometrie unter Verwendung eines Annexin V Apoptose Detection Kits (BioVision Research Products, Palo Alto, CA, USA) quantifiziert. Die Neutrophilen wurden in 1X-Bindungspuffer inkubiert, dem 5 μL Annexin V-Fluoresceinisothiocyanat (FITC) und 5 μL Propidiumjodid (PI) zugesetzt wurden. Nach 5-minütiger Inkubation bei Raumtemperatur im Dunkeln wurden die Zellen mit einem FACScan analysiert und 10.000 Ereignisse pro Probe gezählt.
Die Kombination von Annexin V-FITC und PI konnte zwischen frühen apoptotischen Zellen (Annexin V+, PI-), nekrotischen Zellen (Annexin V-, PI+), späten apoptotischen oder sekundär nekrotischen Zellen (Annexin V+, PI+) und lebensfähigen Zellen (Annexin V-, PI-) unterscheiden.
Enzyme-linked immunosorbent assay (ELISA)
Zytokine im Patientenserum vor und nach LCAP und in den Überständen nach der Co-Kultur von Neutrophilen vor und nach LCAP mit E. coli wurden mittels ELISA nach den Anweisungen des Herstellers gemessen. Zu den Zytokinen gehörten TNF-α, IL-1-Rezeptor-Antagonist (IL-1Ra), IL-6, IL-8 und NE. Die TNF-α-, IL-1Ra-, IL-6- und IL-8-ELISA-Kits wurden von R&D Systems (Minneapolis, MN, USA) erworben. Der NE-ELISA-Kit wurde von Immundiagnostik (Bensheim, Deutschland) erworben. Die Nachweisgrenzen von TNF-α, IL-1Ra, IL-6, IL-8 und NE lagen bei 1, 2, 0,01 und 2 pg/mL bzw. 0,12 ng/mL, und Werte unterhalb dieser Grenzen wurden als nicht nachweisbar betrachtet. Die Werte der einzelnen Zytokine wurden in zweifacher Ausfertigung ermittelt und der Durchschnittswert der Zytokine berechnet.
Statistische Analyse
Alle statistischen Analysen wurden mit JMP Version 5 (SAS Institute, Cary, NC, USA) durchgeführt. Assoziationen zwischen kontinuierlichen und kategorialen Variablen wurden gegebenenfalls mit dem Mann-Whitney-U-Test oder dem gepaarten t-Test bewertet. P<0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Patientenmerkmale
Neunundzwanzig UC-Patienten, die sich einer IPAA unterzogen, erhielten postoperativ LCAP. Die Merkmale der Patienten sind in Tabelle 1 aufgeführt. Das Durchschnittsalter bei der Diagnose lag bei 27 Jahren (Spanne 15-54 Jahre) und das Durchschnittsalter bei der Operation bei 33 Jahren (Spanne 16-61 Jahre). Die Krankheitsdauer betrug 6,9 Jahre (Spanne 0,1-28 Jahre). Eine linksseitige Kolitis lag bei 6/29 (21 %) Patienten und eine Pan-Kolitis bei 23/29 (79 %) Patienten vor. Der Schweregrad der Kolitis wurde als leicht (7; 24 %), mittelschwer (11; 38 %) und schwer (4; 38 %) eingestuft.
| Patientenmerkmale | |
|---|---|
| Variablen | Patienten (n=29) Anzahl |
| Geschlecht | |
| Männlich | 19 |
| Fraulich | 10 |
| Alter bei Diagnose | 27( 15-54) |
| Alter bei der Operation | 33(16-61) |
| Erkrankungsdauer | 6.9 (0.1-28) |
| Schweregrad der Erkrankung | |
| mild | 7 |
| moderat | 11 |
| Schwer | 4 |
| Ausmaß der Erkrankung | |
| Links-sided colitis | 6 |
| Pan- Kolitis | 23 |
| Malts Einstufungssystem | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Gesamtsteroiddosis (mg) | 17285 (800-70000) |
| Verwendung von Immunsuppressiva | |
| Ja | 5 |
| Nein | 24 |
| Operationsdauer (min) | 262.4 (118-496) |
| Blutverlust (ml) | 307,9 (17-826) |
Tabelle 1: Patientenmerkmale.
Zeitliche Veränderung der WBC-, Neutrophilen- und Thrombozytenzahl
WBC, Neutrophile und Thrombozyten wurden jeweils vor der Operation, vor LCAP (nach der Operation) und nach LCAP (innerhalb von 12 Stunden nach LCAP) gezählt. Wie in Abbildung 1 dargestellt, waren die WBC-, Neutrophilen- und Thrombozytenzahlen nach LCAP signifikant niedriger als vor LCAP. Alle Patienten, die postoperativ LCAP erhielten, hatten keine hämatologischen Nebenwirkungen.
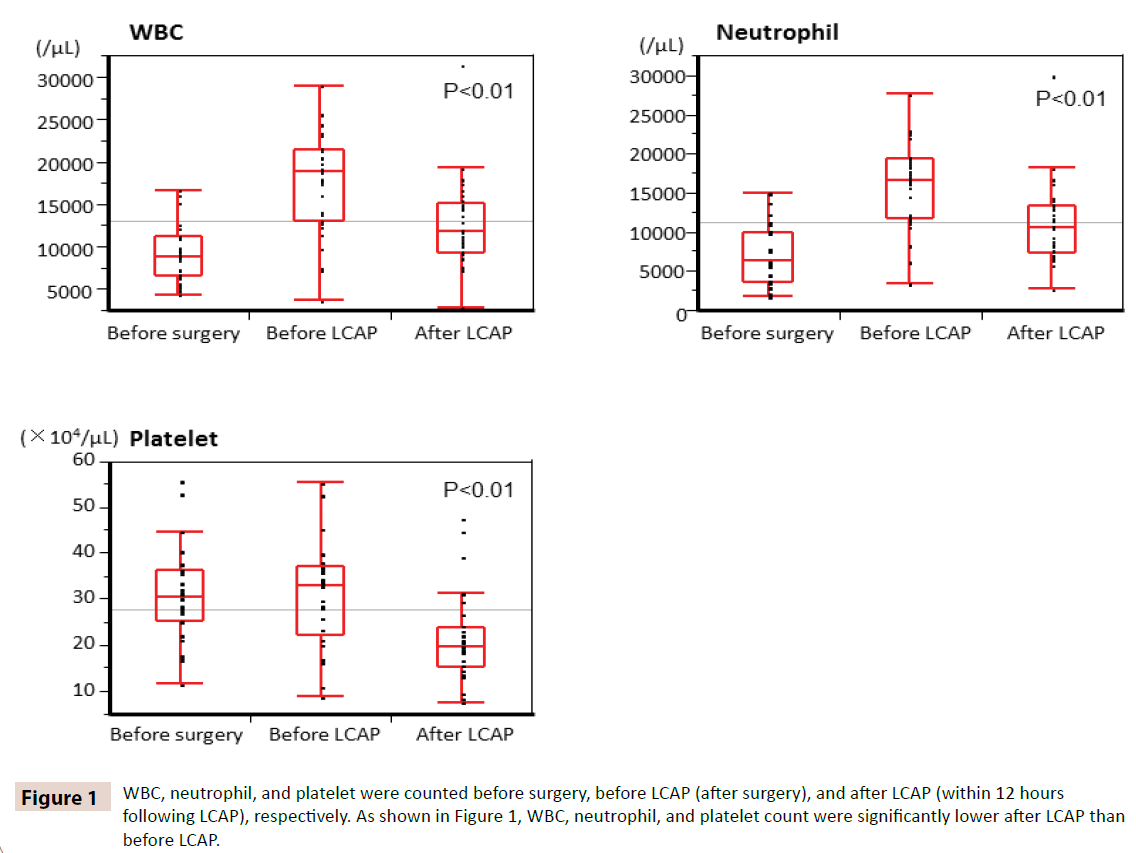
Abbildung 1: WBC, Neutrophile und Thrombozyten wurden vor der Operation, vor LCAP (nach der Operation) bzw. nach LCAP (innerhalb von 12 Stunden nach LCAP) gezählt. Wie in Abbildung 1 dargestellt, war die Anzahl der Leukozyten, Neutrophilen und Blutplättchen nach LCAP signifikant niedriger als vor LCAP.
Phagozytische Aktivität der Neutrophilen gegen E. coli
Um zu klären, ob LCAP die phagozytische Aktivität der zirkulierenden Neutrophilen beeinflusst, wurde die phagozytische Aktivität gegen E. coli zwischen Neutrophilen vor und nach LCAP verglichen. Wie in Abbildung 2 gezeigt, wurde kein signifikanter Unterschied in der neutrophilen phagozytischen Aktivität (mittlere Fluoreszenzintensität) gegen E. coli zwischen Neutrophilen vor LCAP (Median 1259,4, Bereich 50,8-3505,6) und nach LCAP (Median 1077,6, Bereich 24,4-4152,1) festgestellt (P=0,72). Diese Ergebnisse deuten darauf hin, dass LCAP die phagozytische Aktivität der zirkulierenden Neutrophilen gegen E. coli nicht beeinflusst.
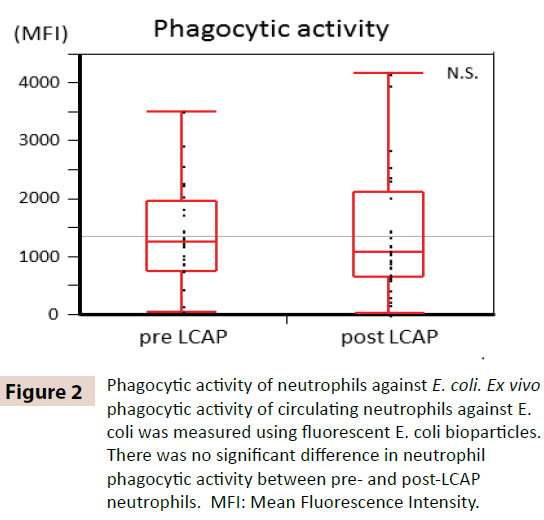
Abbildung 2: Phagozytische Aktivität der Neutrophilen gegen E. coli. Die phagozytische Aktivität der zirkulierenden Neutrophilen gegen E. coli wurde ex vivo mit fluoreszierenden E. coli-Biopartikeln gemessen. Es gab keinen signifikanten Unterschied in der neutrophilen phagozytischen Aktivität zwischen Neutrophilen vor und nach der LCAP-Behandlung. MFI: Mittlere Fluoreszenzintensität.
Lebensfähigkeit der Neutrophilen nach Co-Kultur mit E. coli
Um zu klären, ob LCAP die Reaktion der Neutrophilen auf eine bakterielle Infektion beeinflusst, wurde die Lebensfähigkeit der Neutrophilen gegenüber E. coli zwischen Neutrophilen vor und nach LCAP verglichen. Die Prozentsätze lebensfähiger Zellen (Annexin V-, PI-), früher apoptotischer Zellen (Annexin V+, PI-), nekrotischer Zellen (Annexin V-, PI+) und später apoptotischer oder sekundär nekrotischer Zellen (Annexin V+, PI+) wurden zwischen Neutrophilen vor und nach LCAP verglichen. Wie in Abbildung 3 dargestellt, war der mediane Prozentsatz lebensfähiger Neutrophiler, die mit E. coli kokultiviert wurden, bei Neutrophilen nach LCAP (median 34,2 %, Bereich 1,16- 77,7 %) höher als bei Neutrophilen vor LCAP (median 27,9 %, Bereich 0,53-89,7 %), obwohl der Unterschied keine statistische Signifikanz erreichte (P=0,82). Der Prozentsatz der nekrotischen Neutrophilen, die mit E. coli kokultiviert wurden, war bei den Neutrophilen nach der LCAP (Median 0,73 %, Spanne 0,0-26,0 %) signifikant geringer als bei den Neutrophilen vor der LCAP (Median 1,14 %, Spanne 0,0-26,0 %) (P=0,0232).
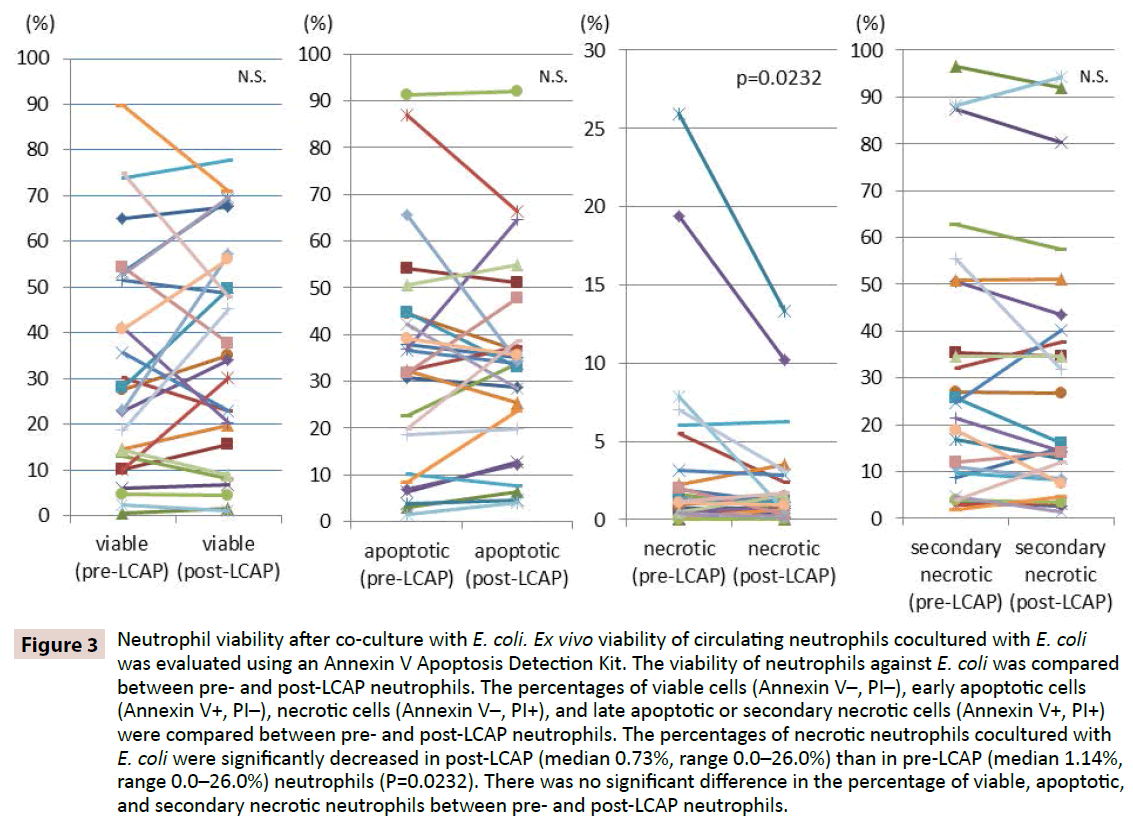
Abbildung 3: Lebensfähigkeit der Neutrophilen nach der Kokultur mit E. coli. Die Ex-vivo-Lebensfähigkeit von zirkulierenden Neutrophilen, die mit E. coli kokultiviert wurden, wurde mit einem Annexin-V-Apoptose-Detektionskit bewertet. Die Lebensfähigkeit der Neutrophilen gegenüber E. coli wurde zwischen Neutrophilen vor und nach der LCAP-Behandlung verglichen. Der prozentuale Anteil lebensfähiger Zellen (Annexin V-, PI-), früh apoptotischer Zellen (Annexin V+, PI-), nekrotischer Zellen (Annexin V-, PI+) und spät apoptotischer oder sekundär nekrotischer Zellen (Annexin V+, PI+) wurde zwischen den Neutrophilen vor und nach der LCAP-Kultur verglichen. Der prozentuale Anteil nekrotischer Neutrophiler, die mit E. coli kokultiviert wurden, war bei Neutrophilen nach LCAP (Median 0,73%, Bereich 0,0-26,0%) signifikant geringer als bei Neutrophilen vor LCAP (Median 1,14%, Bereich 0,0-26,0%) (P=0,0232). Es gab keinen signifikanten Unterschied im Prozentsatz der lebensfähigen, apoptotischen und sekundär nekrotischen Neutrophilen zwischen den Neutrophilen vor und nach der LCAP.
Es wurde kein signifikanter Unterschied im Prozentsatz apoptotischer Neutrophiler, die mit E. coli kokultiviert wurden, zwischen Neutrophilen vor LCAP (Median 32,3 %, Bereich 1,51-91,2 %) und nach LCAP (Median 33,8 %, Bereich 4,0-92,1 %) festgestellt (P=0,57). Es wurde auch kein signifikanter Unterschied im Prozentsatz der spät apoptotischen oder sekundär nekrotischen Neutrophilen, die mit E. coli kokultiviert wurden, zwischen den Neutrophilen vor LCAP (Median 23,1 %, Bereich 1,81-96,5 %) und nach LCAP (Median 16,1 %, Bereich 1,44-94,3 %) beobachtet (P=0.13).
Diese Ergebnisse deuten darauf hin, dass LCAP die bestimmte Untergruppe der zirkulierenden Neutrophilen, die bei bakteriellen Infektionen eine Nekrose auslösen, verringern und die Anzahl der lebensfähigen (wahrscheinlich nicht geprimten) Neutrophilen in der systemischen Zirkulation erhöhen kann.
Zytokinproduktion durch Neutrophile nach Co-Kultur mit E. coli
Um zu klären, ob LCAP die Zytokinproduktion durch zirkulierende Neutrophile beeinflusst, wurden die Zytokinwerte in Kulturüberständen nach Co-Kultur mit E. coli zwischen Neutrophilen vor und nach LCAP verglichen. Wie in Abbildung 4 dargestellt, gab es keinen signifikanten Unterschied in den NE-, TNF-α-, IL-6-, IL-8- und IL-1Ra-Spiegeln im Kulturüberstand zwischen Neutrophilen vor und nach LCAP. Diese Ergebnisse deuten darauf hin, dass LCAP die Zytokinproduktion von zirkulierenden Neutrophilen gegen E. coli nicht beeinflusst.
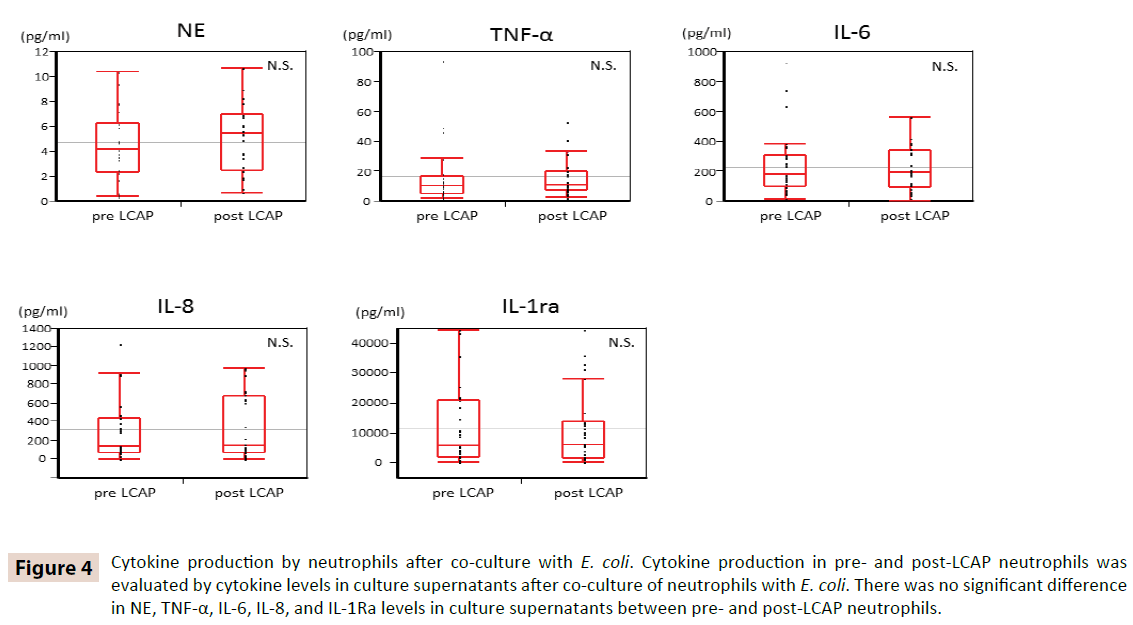
Abbildung 4: Zytokinproduktion durch Neutrophile nach Co-Kultur mit E. coli. Die Zytokinproduktion in Neutrophilen vor und nach der LCAP wurde anhand der Zytokinwerte im Kulturüberstand nach der Co-Kultur von Neutrophilen mit E. coli bewertet. Es gab keinen signifikanten Unterschied in den NE-, TNF-α-, IL-6-, IL-8- und IL-1Ra-Spiegeln in den Kulturüberständen zwischen den Neutrophilen vor und nach LCAP.
Serumzytokine vor und nach LCAP
Um zu klären, ob LCAP die systemische Entzündungsreaktion des Wirts beeinflusst, wurden die Serumzytokine anhand von Blutproben vor und nach LCAP gemessen. Wie in Abbildung 5 dargestellt, war der Serum-NE-Wert nach LCAP (Median 5,62 pg/ml, Bereich 0,16-10,4 pg/ml) signifikant höher als der Wert vor LCAP (Median 2,87 pg/ml, Bereich 0,15-7,61 pg/ml) (P=0,0251). Kein signifikanter Unterschied wurde bei den Serumspiegeln von TNF-α, IL-6, IL-8 und IL-1Ra vor und nach LCAP festgestellt.
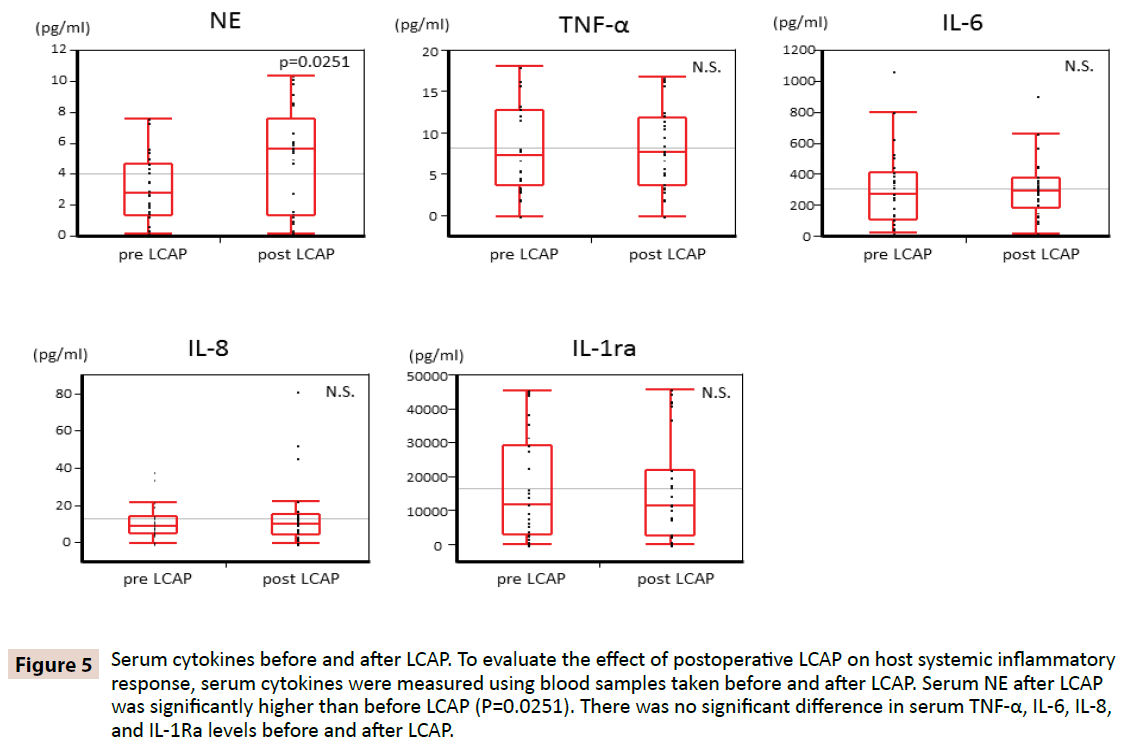
Abbildung 5: Serumzytokine vor und nach LCAP. Um die Auswirkungen der postoperativen LCAP auf die systemische Entzündungsreaktion des Wirts zu bewerten, wurden die Serumzytokine anhand von Blutproben gemessen, die vor und nach der LCAP entnommen wurden. Der NE-Wert im Serum war nach LCAP signifikant höher als vor LCAP (P=0,0251). Es gab keinen signifikanten Unterschied in den Serumwerten von TNF-α, IL-6, IL-8 und IL-1Ra vor und nach LCAP.
Assoziationen der neutrophilen Funktionen nach LCAP mit der Operationszeit oder der postoperativen Neutrophilenzahl
Um zu klären, ob die zirkulierenden neutrophilen Funktionen nach LCAP das Auftreten von SSI beeinflussen, untersuchten wir die Assoziation zwischen der phagozytischen Aktivität oder der Zytokinproduktion der Neutrophilen nach LCAP und den Risikofaktoren für SSI, die mit der chirurgischen Belastung zusammenhängen, wie Operationszeit, Blutverlust und postoperative Neutrophilenzahl.
Wie in Abbildung 6 gezeigt, war NE in den Überständen nach der Co-Kultur von Post-LCAP-Neutrophilen mit E. coli bei Patienten mit einer Operationszeit >3 h signifikant höher (Median 5,65 pg/mL, Bereich 0,97-10.7 pg/mL) als bei Patienten mit einer Operationszeit von <3 Stunden (Median 1,05 pg/mL, Bereich 0,72-2,44 pg/mL) (P=0,0158).
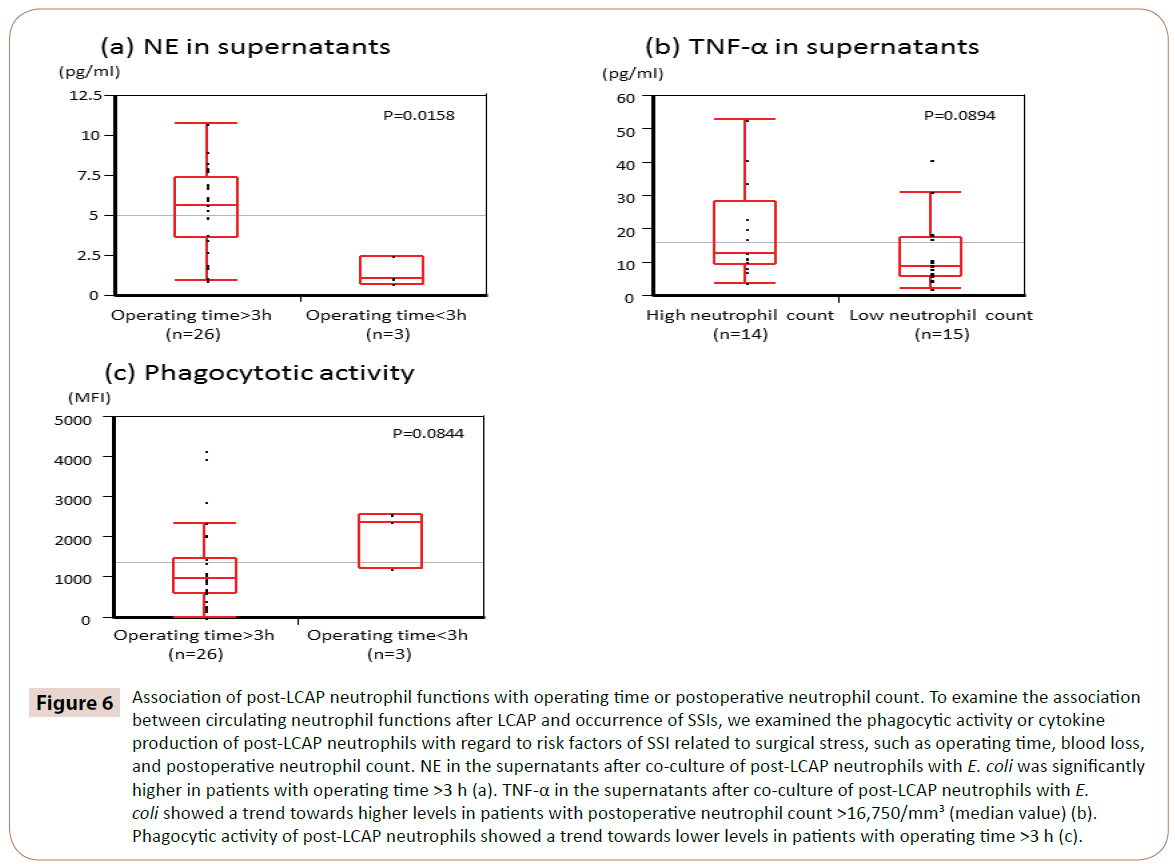
Abbildung 6: Zusammenhang zwischen post-LCAP-Neutrophilenfunktionen und Operationszeit oder postoperativer Neutrophilenzahl. Um den Zusammenhang zwischen zirkulierenden Neutrophilenfunktionen nach LCAP und dem Auftreten von SSI zu untersuchen, untersuchten wir die phagozytische Aktivität oder die Zytokinproduktion der Neutrophilen nach LCAP im Hinblick auf Risikofaktoren für SSI, die mit der chirurgischen Belastung zusammenhängen, wie Operationszeit, Blutverlust und postoperative Neutrophilenzahl. NE in den Überständen nach der Co-Kultur von post-LCAP-Neutrophilen mit E. coli war bei Patienten mit einer Operationszeit >3 h signifikant höher (a). TNF-α in den Überständen nach Co-Kultur von Post-LCAP-Neutrophilen mit E. coli zeigte einen Trend zu höheren Werten bei Patienten mit einer postoperativen Neutrophilenzahl >16.750/mm3 (Medianwert) (b). Die phagozytische Aktivität der post-LCAP-Neutrophilen zeigte einen Trend zu niedrigeren Werten bei Patienten mit einer Operationszeit >3 h (c).
TNF-α in den Überständen nach Co-Kultur von post-LCAP-Neutrophilen mit E. coli zeigten einen Trend zu höheren Werten bei Patienten mit einer postoperativen Neutrophilenzahl >16.750/mm3 (Medianwert) (P=0,0894).
Die phagozytische Aktivität der post-LCAP-Neutrophilen gegen E. coli zeigte einen Trend zu niedrigeren Werten bei Patienten mit einer Operationszeit >3 h (P=0,0844).
Zusammenhänge zwischen Serum-TNF-α nach LCAP und SSI
Um zu klären, ob die systemische Entzündungsreaktion des Wirts nach LCAP das Auftreten von SSI beeinflusst, untersuchten wir den Zusammenhang zwischen Serum-Zytokinspiegeln nach LCAP und dem Auftreten von SSI.
Wie in Abbildung 7 dargestellt, zeigten die Serum-TNF-α-Werte nach LCAP einen Trend zu höheren Werten bei Patienten, die SSI entwickelten, als bei denen, die keine SSI entwickelten (P=0,0714).
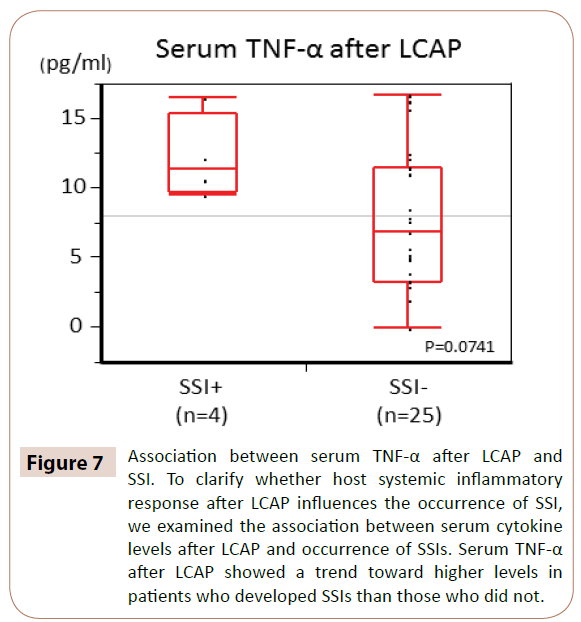
Abbildung 7: Zusammenhang zwischen Serum-TNF-α nach LCAP und SSI. Um zu klären, ob die systemische Entzündungsreaktion des Wirts nach LCAP das Auftreten von SSI beeinflusst, untersuchten wir den Zusammenhang zwischen den Serumzytokinwerten nach LCAP und dem Auftreten von SSI. Die Serum-TNF-α-Werte nach LCAP zeigten einen Trend zu höheren Werten bei Patienten, die SSI entwickelten, als bei denen, die keine SSI entwickelten.
Es gab keinen signifikanten Unterschied zwischen den Serum-IL-6-, IL-8- und IL-1Ra-Werten nach LCAP und dem Auftreten von SSI.
Diskussion
Es wurde über verschiedene mögliche Wirkmechanismen von LCAP oder GMA berichtet, obwohl die genauen Mechanismen noch nicht vollständig untersucht wurden. Die Variabilität der Ergebnisse scheint von den Unterschieden bei den für die Analysen verwendeten Blutzellen (Granulozyten, Monozyten oder Lymphozyten), den Methoden der Blutentnahme (aus der Einlass- oder Auslassleitung oder aus der peripheren Vene) und den Studienteilnehmern (gesunde Freiwillige oder kranke Patienten) abzuhängen.
Die meisten Forscher verwendeten Leukozyten wie Neutrophile, Monozyten oder Lymphozyten, die aus den Einlass- und Auslassleitungen eines extrakorporalen Zirkulationsgeräts entnommen wurden. Die Leukozyten aus den Auslassleitungen sind die restlichen Zellen, die von LCAP gefiltert werden. Sie werden sofort in den systemischen Kreislauf des Patienten zurückgeführt und mit den zirkulierenden Leukozyten neu vermischt. Die Leukozyten aus den Auslassleitungen stellen den geringen Anteil aller zirkulierenden Leukozyten nach LCAP dar. Um die systemische Wirkung von LCAP auf das Wirtsimmunsystem zu klären, haben wir zirkulierende Neutrophile verwendet, die aus peripheren Venen von UC-Patienten isoliert wurden.
Streng genommen sollte die Leukozytapherese (LCAP) als Leukozytafiltration bezeichnet werden, da sie nicht nur Leukozyten entfernen, sondern diese auch durch den Filter aktivieren kann. In der Tat kann die LCAP nicht alle Blutzellen, die in die LCAP gelangen, absorbieren und entfernen. Eine bestimmte Anzahl von Blutzellen kann den Filter passieren und dann in den Blutkreislauf zurückkehren. Es wird angenommen, dass die gefilterten Blutzellen durch die Filtration von LCAP aktiviert werden.
Neutrophile sind die am häufigsten vorkommende Leukozytenpopulation und die Zellen, die am effizientesten von LCAP entfernt werden. Die geschätzte Anzahl der gefilterten Leukozyten beträgt fast 1,1 × 1010 Zellen pro einzelner LCAP-Sitzung, was mit der Entfernung von fast der Hälfte der zirkulierenden Neutrophilen (2 × 10-3 × 1010 Zellen) vergleichbar sein könnte. Daher untersuchten wir den funktionellen Unterschied zwischen Neutrophilen vor und nach der LCAP-Behandlung im Hinblick auf die Reaktion auf E. coli, um die möglichen Mechanismen der klinischen Beobachtung zu klären, dass die postoperative LCAP-Behandlung die SSI-Inzidenz reduzierte. LCAP mit Cellsorba kann jedoch nicht nur Neutrophile, sondern auch andere Blutzellen (Monozyten, Lymphozyten und Thrombozyten) mit unterschiedlicher Wirksamkeit entfernen und aktivieren. Daher ist es notwendig, die Veränderung der Reaktion auf E. coli nicht nur bei den Neutrophilen, sondern auch bei den anderen Blutzellen vor und nach LCAP zu untersuchen, obwohl sie in dieser Studie nicht untersucht wurden.
Eines der wichtigsten Ergebnisse der vorliegenden Studie war die Tatsache, dass der Prozentsatz der nekrotischen Neutrophilen signifikant reduziert wurde, wenn Neutrophile nach LCAP mit E. coli kultiviert wurden, im Vergleich zu Neutrophilen vor LCAP. Diese Beobachtung deutet darauf hin, dass LCAP den Anteil der Neutrophilen, die durch E. coli zur Nekrose angeregt werden, verringert und den Anteil der lebensfähigen (wahrscheinlich nicht geprimten) Neutrophilen in der systemischen Zirkulation erhöht.
Es wurden große Schwankungen des Prozentsatzes der Lebensfähigkeit, Apoptose oder Nekrose der Neutrophilen bei Co-Kultur mit E. coli beobachtet. In unseren jüngsten unveröffentlichten Daten schwankte der Prozentsatz der frühen Apoptose (Annexin V+, PI-) in zirkulierenden Neutrophilen bei Patienten mit systemischen Entzündungen, wie z. B. erhöhtem C-reaktiven Protein >0,3 mg/L, zwischen etwa 10 % und 90 %. Diese Beobachtungen deuten darauf hin, dass Neutrophile bereits ohne Kokultur von E. coli aufgrund höherer chirurgischer Insulte apoptotisch sein können.
Nekrose wird als unkontrollierter Zelltod angesehen, und es scheint, dass toxische Sauerstoffspezies und proteolytische Enzyme unerwartet freigesetzt werden. Es ist bekannt, dass die Neutrophilennekrose die Hauptursache für Atemwegs- und Lungenschäden in den stark entzündeten Lungen von Patienten mit zystischer Fibrose ist. Postoperatives LCAP kann die Rekrutierung einer neutrophilen Untergruppe, die gegen unerwarteten oder unkontrollierten nekrotischen Zelltod resistent ist, gegen eine bakterielle Infektion in den systemischen Kreislauf induzieren, zusätzlich zur Beseitigung aktivierter Leukozyten, die eine systemische Entzündung verursachen.
Im Gegensatz zu den oben genannten Ergebnissen von Ex-vivo-Experimenten war die Serum-NE nach LCAP deutlich erhöht. Die unmittelbare Senkung des Serum-NE durch LCAP wurde nicht beobachtet. Eine mögliche Erklärung dafür ist, dass eine einzige LCAP-Sitzung die NE-Freisetzung aus den Ganzkörper-Neutrophilen bei der chirurgisch induzierten systemischen Entzündung nicht ausreichend unterdrückt
Zirkulierende Neutrophile nach LCAP, die von Patienten mit einer längeren Operationszeit (>3 h) oder einer höheren postoperativen Neutrophilenzahl (>16.750/mm3; Medianwert) isoliert wurden, zeigten nicht nur eine höhere Produktionsaktivität von NE oder TNF-α, sondern auch eine geringere phagozytische Aktivität gegen E. coli. Diese Ergebnisse deuten darauf hin, dass Neutrophile, die von Patienten mit hohem chirurgischem Stress isoliert wurden, eine übermäßige Produktion von proinflammatorischen Zytokinen oder eine beeinträchtigte phagozytische Aktivität aufweisen, selbst nach einer neutrophilen Erneuerung durch postoperative LCAP.
Unter 29 UC-Patienten mit postoperativer LCAP entwickelten nur vier Patienten (13,8 %) SSIs. Ihr Serum-TNF-α war nach LCAP höher als bei den Patienten ohne SSI, obwohl der Unterschied keine statistische Signifikanz erreichte. Daher kann Serum-TNF-α nützlich sein, um Patienten zu identifizieren, die nach einer postoperativen LCAP eine SSI entwickeln werden. Es wurde jedoch kein Zusammenhang zwischen der Entwicklung von SSI und der Lebensfähigkeit, Apoptose oder Nekrose von Neutrophilen in Co-Kultur mit E. coli beobachtet, was zum Teil auf den geringen Stichprobenumfang zurückzuführen sein könnte.
In jüngster Zeit wurde erkannt, dass zirkulierende Neutrophile eine funktionell heterogene Population darstellen und gegen verschiedene Insulte unterschiedlich gerüstet sind. Wir haben über die klinische Bedeutung von zirkulierenden Neutrophilen bei systemischen Entzündungen berichtet. Wir denken, dass zirkulierende Neutrophile das primäre Ziel sein könnten, um die systemische Wirkung von LCAP auf das Immunsystem des Wirts zu erforschen.
Darüber hinaus haben einige Forscher berichtet, dass die Leukodepletion, bei der polymorphkernige Zellen mithilfe von Leukozytenfiltern aus dem systemischen Kreislauf entfernt werden, zu einer signifikanten Verbesserung der Lungen- und Nierenfunktion von Patienten führt, die nach einem kardiopulmonalen Bypass ein systemisches Entzündungssyndrom (SIRS) entwickeln. Die gezielte Leukozyteneliminierung von Neutrophilen könnte sich als vorteilhaft erweisen, um Organversagen aufgrund von SIRS zu verhindern.
Zusammenfassend lässt sich sagen, dass dies vermutlich der erste Bericht ist, der zeigt, dass LCAP nach einer Operation die Untergruppe der zirkulierenden Neutrophilen verringert, die bei bakteriellen Infektionen Nekrose verursachen. Es könnte für die Prävention von SSI von Vorteil sein, den unerwarteten oder unkontrollierten nekrotischen Zelltod zu reduzieren, der durch die Freisetzung toxischer oder proteolytischer Substanzen in den systemischen Kreislauf verursacht wird.
Danksagung
Die Autoren danken Motoko Ueeda und Chihiro Hibi für ihre hervorragende technische Unterstützung.
Autorenschaft Beitrag
K.T., T.A. und M.K. planten und führten die Experimente durch, analysierten und interpretierten die Daten und schrieben das Manuskript. S.Y., Y.O. und S.K. führten die Experimente durch und analysierten die Daten. Y.T., M.I., M.O., M.K., Y.I., K.U. und Y.M. planten die Experimente und analysierten und interpretierten die Daten. C.M. und M.K. planten die Experimente und interpretierten die Daten.
Förderung und Offenlegung finanzieller Vereinbarungen
Diese Arbeit wurde zum Teil durch Zuschüsse des japanischen Ministeriums für Bildung, Kultur, Sport, Wissenschaft und Technologie unterstützt (KAKENHI 23791523 für S.Y., 25861181 to Y.O., and 24791887 to M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Leben und Sterben für die Entzündung: Neutrophile, Eosinophile, Basophile. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Current status and future perspectives of leukocytapheresis for inflammatory bowel disease. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factors affecting short- and long-term effects of leukocyte removal therapy in active ulcerative colitis. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluation of filtration leucocytapheresis for use in the treatment of patients with rheumatoid arthritis. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukozytapherese mit einem Filter zur Leukozytenentfernung. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) A new paradigm in ulcerative colitis: regulatory T cells are key factor which induces/exacerbates UC through an immune imbalance. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Immunmodulatorische Effekte der Granulozyten- und Monozytenadsorptionsapherese als Behandlung für Patienten mit Colitis ulcerosa. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) In vitro and in vivo evaluation of Adacolumncytapheresis in healthy subjects. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)A systematic review of risk factors associated with surgical site infections among surgical patients. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Risk factors for surgical site infection in Japanese patients with ulcerative colitis: a multicenter prospective study. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Early postoperative application of extracorporeal leukocyte apheresis in ulcerative colitis patients: results of a pilot trial to prevent postoperative septic complications. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdosed patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Klassifizierung des Zelltods: Empfehlungen des Nomenklaturausschusses für den Zelltod 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Direct evidence of secondary necrosis of neutrophils during intense lung inflammation. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Neutrophil necrosis and annexin 1 degradation associated with airway inflammation in lung transplant recipients with cystic fibrosis. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverse neue Funktionen von Neutrophilen in Immunität, Entzündung und darüber hinaus. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)The effects of leucodepletion in patients who develop the systemic inflammatory response syndrome following cardiopulmonary bypass. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depletion of blood neutrophils from patients with sepsis: treatment for the future? IntImmunopharmacol17:1226-1232.