Wenn ein Stoff seine Phase ändert, d.h. entweder von einem festen in einen flüssigen oder von einem flüssigen in einen gasförmigen Zustand übergeht, benötigt er Energie. Die potentielle Energie, die in den interatomaren Kräften zwischen den Molekülen gespeichert ist, muss durch die kinetische Energie, die Bewegung der Teilchen, überwunden werden, bevor die Substanz ihre Phase ändern kann.
Wenn wir die Temperatur der Substanz messen, die anfangs fest ist, während wir sie erhitzen, erhalten wir ein Diagramm wie in Abbildung 1.
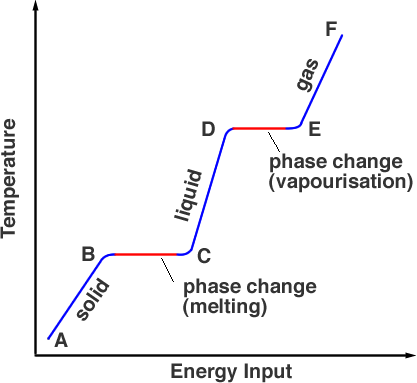
Ausgehend von Punkt A befindet sich die Substanz in ihrer festen Phase; durch Erhitzen wird die Temperatur auf den Schmelzpunkt erhöht, aber das Material ist am Punkt B immer noch fest. Wenn es weiter erhitzt wird, geht die Energie der Wärmequelle in das Aufbrechen der Bindungen über, die die Atome an ihrem Platz halten. Dies geschieht von B nach C. Am Punkt C hat sich die gesamte feste Phase in die flüssige Phase verwandelt. Erneut wird Energie zugeführt, die in die kinetische Energie der Teilchen fließt und die Temperatur erhöht (C bis D). Am Punkt D hat die Temperatur ihren Siedepunkt erreicht, befindet sich aber noch in der flüssigen Phase. Zwischen den Punkten D und E überwindet die Wärmeenergie die Bindungen, und die Teilchen haben genug Bewegungsenergie, um aus der Flüssigkeit zu entweichen. Der Stoff geht in die Gasphase über. Jenseits von E kann die Temperatur durch weiteres Erhitzen unter Druck noch weiter erhöht werden – so funktioniert ein Schnellkochtopf.
Latente Fusions- und Verdampfungswärme
Die Energie, die erforderlich ist, um die Phase eines Stoffes zu ändern, wird als latente Wärme bezeichnet. Das Wort latent bedeutet verborgen. Wenn die Phasenänderung von einem festen zu einem flüssigen Stoff erfolgt, müssen wir die latente Schmelzwärme verwenden, und wenn die Phasenänderung von einem flüssigen zu einem gasförmigen Stoff erfolgt, müssen wir die latente Verdampfungswärme verwenden.
Die erforderliche Energie ist Q= m L, wobei m die Masse des Stoffes und L die spezifische latente Schmelz- oder Verdampfungswärme ist, die die Wärmeenergie für die Umwandlung von 1 kg eines festen Stoffes in eine Flüssigkeit misst.
Tabelle 1. zeigt die
| Stoff | Spezifische latente Schmelzwärme kJ.kg-1 |
°C | Spezifische latente Verdampfungswärme kJ.kg-1 |
°C |
|---|---|---|---|---|
| Wasser | 334 | 0 | 2258 | 100 |
| Ethanol | 109 | -114 | 838 | 78 |
| Ethansäure | 192 | 17 | 395 | 118 |
| Chloroform | 74 | -64 | 254 | 62 |
| Quecksilber | 11 | -39 | 294 | 357 |
| Schwefel | 54 | 115 | 1406 | 445 |
| Wasserstoff | 60 | -259 | 449 | -253 |
| Sauerstoff | 14 | -219 | 213 | -183 |
| Stickstoff | 25 | -210 | 199 | -196 |
Wärmerohre
Wenn die Dichte der Transistoren in einem Mikroprozessor zunimmt, steigt auch die Menge der abgeleiteten Wärme. Ein Pentium-4-Prozessor (180 nm, der mit 2 GHz läuft) gibt 55 Watt Leistung als Wärme ab. Seine Fläche beträgt nur 131 mm2. Das ergibt 55 W/(131/(102)) = 42 W cm-2. Im Vergleich dazu liegt ein Dampfbügeleisen bei 5 Wcm-2.
Eine Lösung ist das Wärmerohr. Wie der Name schon sagt, überträgt sie Wärme von Bereichen mit hoher Temperatur in Bereiche mit niedrigerer Temperatur, wo mehr Platz für Kühlkörper oder Lüfter ist.
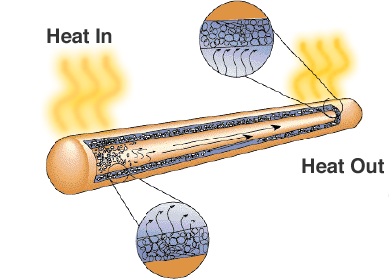
Auch wenn es nur wie ein versiegeltes Metallrohr aussieht, gibt es einen Docht oder ein poröses Material und eine Flüssigkeit mit einer hohen latenten Verdampfungswärme. Wenn das Rohr erhitzt wird, nutzt die Flüssigkeit die Wärme zum Verdampfen und verwandelt sich in ein Gas. Das Gas bewegt sich in einen kälteren Bereich des Wärmerohrs, wo es kondensiert und die latente Wärme nutzt, um sich wieder in eine Flüssigkeit zu verwandeln. Wärmerohre sind eine zuverlässige und kostengünstige Lösung für Laptops, bei denen Lüfter die Lebensdauer der Batterie verkürzen würden.