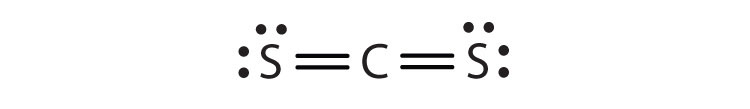4.3 Mehrfache kovalente Bindungen
Lernziel
- Erkennen Sie Moleküle, die wahrscheinlich mehrfache kovalente Bindungen haben.
In vielen Molekülen wäre die Oktettregel nicht erfüllt, wenn jedes Paar gebundener Atome zwei Elektronen teilt. Nehmen wir Kohlendioxid (CO2). Wenn sich jedes Sauerstoffatom ein Elektron mit dem Kohlenstoffatom teilt, ergibt sich folgendes Bild:
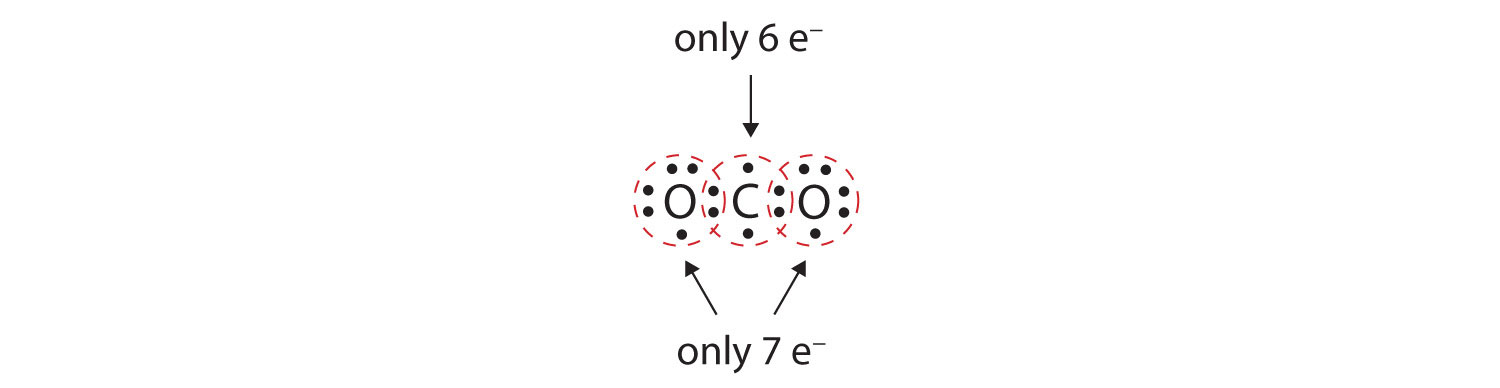
Damit hat das Kohlenstoffatom kein vollständiges Oktett; in seiner Valenzschale befinden sich nur sechs Elektronen. Außerdem hat jedes Sauerstoffatom nur sieben Elektronen in seiner Valenzschale. Schließlich geht kein Atom die Anzahl von Bindungen ein, die es normalerweise bildet (Abbildung 4.2 „Wie viele kovalente Bindungen werden gebildet?“). Diese Anordnung der gemeinsam genutzten Elektronen ist alles andere als zufriedenstellend.
Manchmal muss mehr als ein Elektronenpaar zwischen zwei Atomen geteilt werden, damit beide Atome ein Oktett bilden. In Kohlendioxid wird ein zweites Elektron von jedem Sauerstoffatom auch mit dem zentralen Kohlenstoffatom geteilt, und das Kohlenstoffatom teilt sich ein weiteres Elektron mit jedem Sauerstoffatom:
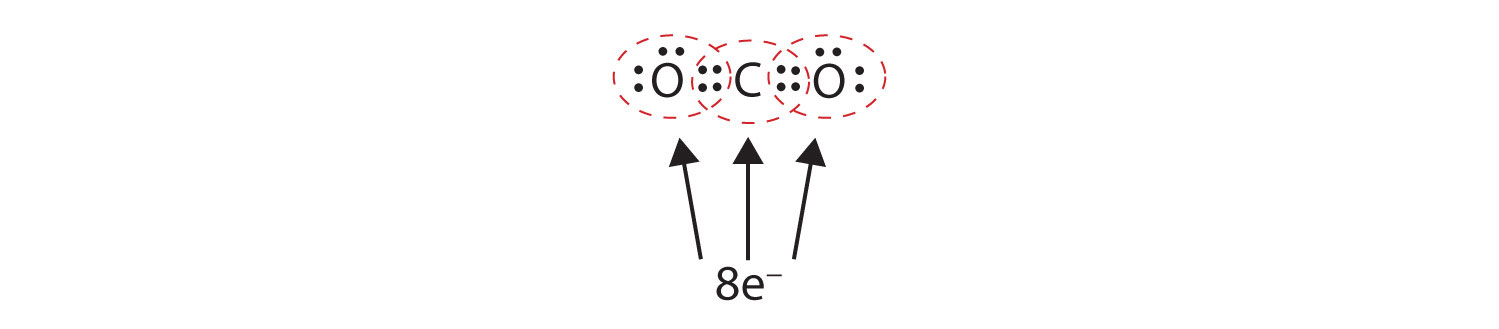
In dieser Anordnung teilt sich das Kohlenstoffatom vier Elektronen (zwei Paare) mit dem Sauerstoffatom auf der linken Seite und vier Elektronen mit dem Sauerstoffatom auf der rechten Seite. Es befinden sich nun acht Elektronen um jedes Atom herum. Zwei Elektronenpaare, die sich zwei Atome teilen, bilden eine DoppelbindungZwei Elektronenpaare, die sich zwei Atome in einem Molekül teilen. zwischen den Atomen, was durch einen Doppelstrich dargestellt wird:
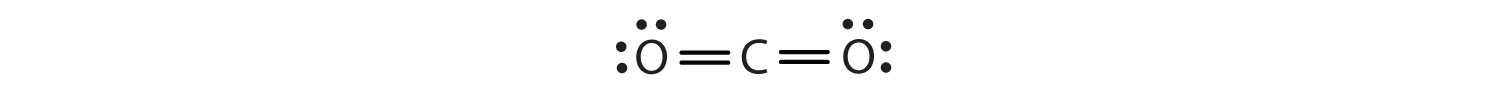
Einige Moleküle enthalten DreifachbindungenDrei Elektronenpaare, die sich zwei Atome in einem Molekül teilen. kovalente Bindungen, bei denen sich zwei Atome drei Elektronenpaare teilen. Eine einfache Verbindung mit einer Dreifachbindung ist Acetylen (C2H2), dessen Lewis-Diagramm wie folgt aussieht:

Beispiel 5
Zeichne das Lewis-Diagramm für jedes Molekül.
- N2
- CH2O (Das Kohlenstoffatom ist das Zentralatom.)
Lösung
-
Die Bindung zwischen den beiden Stickstoffatomen ist eine Dreifachbindung. Das Lewis-Diagramm für N2 sieht wie folgt aus:

-
In CH2O ist das Zentralatom von zwei verschiedenen Arten von Atomen umgeben. Das Lewis-Diagramm, das die Valenzelektronenschale jedes Atoms ausfüllt, sieht wie folgt aus:

Anmerkung
Eine Anwendung von CH2O, auch Formaldehyd genannt, ist die Konservierung biologischer Proben. Wässrige Lösungen von CH2O werden Formalin genannt und haben einen scharfen, charakteristischen (stechenden) Geruch.
Skill-Building Exercise
-
O2
-
C2H4
Zeichne das Lewis-Diagramm für jedes Molekül.
Übung zur Überprüfung des Konzepts
-
Was ist ein Anhaltspunkt dafür, dass ein Molekül eine Mehrfachbindung hat?
Antwort
-
Wenn Einfachbindungen zwischen allen Atomen nicht für alle Atome (außer Wasserstoff) ein Oktett ergeben, kann eine kovalente Mehrfachbindung vorhanden sein.
Key Takeaway
- Einige Moleküle müssen mehrere kovalente Bindungen zwischen den Atomen haben, um die Oktettregel zu erfüllen.
Übungen
-
Jedes Molekül enthält mehrere Bindungen. Zeichnen Sie jeweils das Lewis-Diagramm. Das erste Element ist das Zentralatom.
- CS2
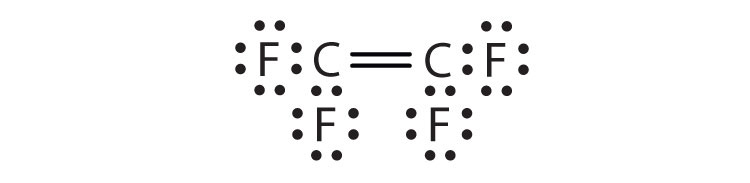
- C2F4
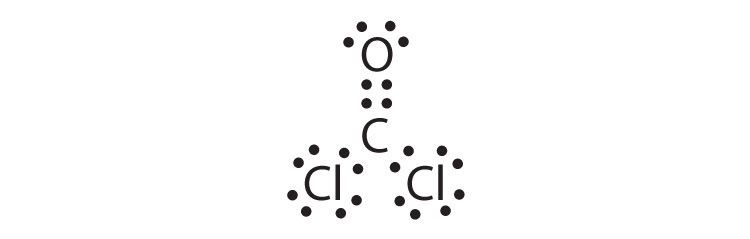
- COCl2
-
Jedes Molekül enthält Doppelbindungen. Zeichnen Sie das Lewis-Diagramm für jedes Molekül. Gehe davon aus, dass das erste Element das Zentralatom ist, sofern nicht anders angegeben.
- N2
- HCN (Das Kohlenstoffatom ist das Zentralatom.)
- POCl (Das Phosphoratom ist das Zentralatom.)
-
Erkläre, warum Wasserstoffatome keine Doppelbindungen bilden.
-
Warum ist es falsch, im Lewis-Diagramm für MgO eine Doppelbindung zu zeichnen?
Antworten
-
-
-
Wasserstoff kann nur ein weiteres Elektron aufnehmen; Bei Mehrfachbindungen muss mehr als ein Elektronenpaar geteilt werden.