
Zitronensaft schmeckt sauer, weil er 5 bis 6 % Zitronensäure enthält und einen pH-Wert von 2,2 hat. (hoher Säuregehalt)
pH (Wasserstoffpotenzial) ist eine Skala für den Säuregehalt von 0 bis 14. Sie gibt an, wie sauer oder alkalisch ein Stoff ist. Je saurer eine Lösung ist, desto niedriger ist ihr pH-Wert. Je alkalischer eine Lösung ist, desto höher ist ihr pH-Wert. Stoffe, die weder sauer noch alkalisch sind (d. h. neutrale Lösungen), haben in der Regel einen pH-Wert von 7. Säuren haben einen pH-Wert von weniger als 7. Alkalien haben einen pH-Wert von über 7.
Der pH-Wert ist ein Maß für die Konzentration von Protonen (H+) in einer Lösung. S.P.L. Sørensen führte diesen Begriff im Jahr 1909 ein. Das p steht für die deutsche Potenz, d.h. Kraft oder Konzentration, und das H für das Wasserstoff-Ion (H+).
Alkalische Substanzen haben anstelle von Wasserstoff-Ionen eine Konzentration von Hydroxid-Ionen (OH-).
pH-Indikatoren
Ein pH-Indikator ist eine chemische Verbindung, die in kleinen Mengen einer Lösung zugesetzt wird, um den pH-Wert (Säuregehalt oder Basizität) der Lösung zu erkennen. Der pH-Indikator ist ein chemischer Detektor für Hydronium-Ionen (H3O+) oder Wasserstoff-Ionen (H+). Normalerweise bewirkt der Indikator, dass sich die Farbe der Lösung in Abhängigkeit vom pH-Wert ändert.
Typische Indikatoren sind Phenolphthalein, Methylorange, Methylrot, Bromthymolblau und Thymolblau. Sie ändern ihre Farbe an verschiedenen Stellen der pH-Skala und können zusammen als Universalindikator verwendet werden.
Eine andere Möglichkeit ist die Verwendung von Lackmuspapier, das auf einem natürlichen pH-Indikator basiert. Mit dem Papier kann man feststellen, wie stark die Chemikalie ist, ob es sich um eine stärkere Säure oder eine stärkere Base handelt.
Gebräuchliche pH-Werte
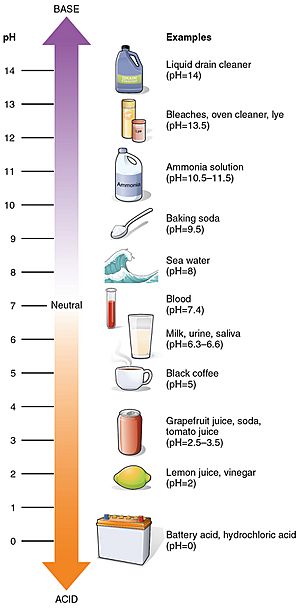
pH-Werte einiger gebräuchlicher Stoffe
Neutralisation
Die Neutralisation lässt sich mit der Gleichung zusammenfassen:
H+ + OH- → H2O
(Säure + Base → Wasser)
Verwandte Seiten
- Säure
- Base
- Alkali
- Titration
- Transpiration(Sreekanta Das).
Bilder für Kinder
-
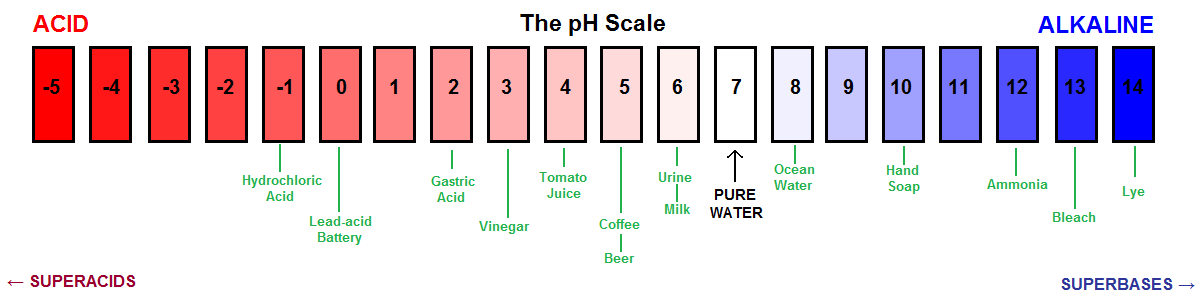
Eine weitere visuelle Darstellung der pH-Skala.
-

Referenzbereiche für Bluttests, wobei die Protonenkonzentration (lila) links dargestellt ist. Es ist zu erkennen, dass die Bereiche in einem engen Bereich gehalten werden und dass freie Protonen zu den Verbindungen mit den geringsten Massenkonzentrationen gehören.
-

Diagramm, das die Veränderung der Farbe von Universalindikatorpapier mit dem pH-Wert zeigt