HINTERGRUND
Prinzip:
Methylsalicylat (Öl des Wintergrüns) ist ein organischer Ester. Wenn eine Säure (mit der -COOH-Gruppe) mit einem Alkohol (einer Verbindung mit einer -OH-Gruppe) reagiert, entsteht ein Ester. Die Art der Reaktion kann als Kondensationsreaktion bezeichnet werden, da das kleine Molekül H2O aus den Reaktanten entfernt wird, während die verbleibenden Teile der Reaktanten zusammen kondensieren und das Hauptprodukt ergeben. Diese Reaktion wird auch als Veresterung bezeichnet, da das Produkt der Reaktion ein Ester ist, eine Verbindung, die die COOR-Gruppe enthält.1
Ziel:
Zur Herstellung von Methylsalicylat aus Salicylsäure.
Reaktion:
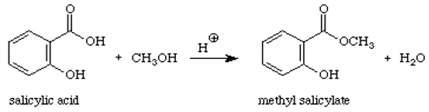
Mechanismus:
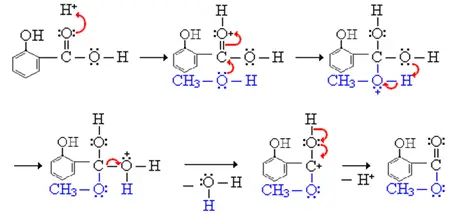
Verwendung:
Es wird zur Behandlung von Muskel- und Gelenkschmerzen verwendet.
Bestimmungen
Chemikalien: Salicylsäure
Trockenes Methanol
Konzentrierte Schwefelsäure
Kohlentetrachlorid
Magnesiumsulfat usw.
Apparatur: Rundkolben mit rundem Boden – 500 ml,
Rückflusskühler
Thermometer
Trenntrichter
Becher
Buchner Trichter
Messzylinder
Filterpapier
VORGEHEN
Man nehme eine Mischung von 28 g (0.2 mol) Salicylsäure, 64 g (81 ml, 2 mol) trockenem Methanol und 8 ml konzentrierter Schwefelsäure in einen Rundkolben von 500 ml. Man gibt einige kleine Späne aus porösem Porzellan hinein, setzt einen Rückflusskühler auf den Kolben und lässt das Gemisch 5 Stunden lang vorsichtig kochen. Den Rückstand in etwa 250 ml Wasser in einem Scheidetrichter gießen und den Kolben mit einigen ml Wasser spülen, die ebenfalls in den Scheidetrichter gegossen werden. Wenn sich die untere Esterschicht und das Wasser wegen des verhältnismäßig geringen Dichteunterschieds nur schwer scharf trennen lassen, gibt man 10-15 ml Tetrachlorkohlenstoff (2) hinzu und schüttelt das Reaktionsgemisch in diesem Trichter kräftig, bis sich die schwere Lösung von Methylsalicylat in Tetrachlorkohlenstoff scharf und schnell am Boden des Scheidetrichters abscheidet. Man lässt die untere Schicht vorsichtig ablaufen, verwirft die obere wässrige Schicht, gibt das Methylsalicylat in den Trichter zurück und schüttelt ihn mit einer starken Natriumhydrogencarbonatlösung, bis die gesamte freie Säure entfernt ist und keine Kohlendioxidentwicklung mehr auftritt. Man wäscht einmal mit Wasser und schüttet zum Trocknen in einen kleinen trockenen Erlenmeyerkolben, der etwa 5 g Magnesiumsulfat enthält. Der Kolben wird verschlossen, etwa 5 Minuten lang geschüttelt und mindestens eine halbe Stunde lang unter gelegentlichem Schütteln stehen gelassen. Die Methylsalicylatlösung wird durch ein kleines geriffeltes Filterpapier direkt in einen Rundkolben filtriert, der mit einem Destillierkopf mit einem 360 °C-Thermometer und einem Luftkühler ausgestattet ist. Man gibt einige Siedespäne hinein und destilliert aus einem Luftbad; die Temperatur wird zunächst langsam erhöht, bis der gesamte Tetrachlorkohlenstoff übergegangen ist, und dann stärker erhitzt. Man sammelt das Methylsalicylat (ein farbloses, angenehm duftendes Öl, „Wintergrünöl“) bei 221-224 °C; die Ausbeute beträgt 25 g (81 %). Der Ester kann auch unter vermindertem Druck destilliert werden; der S.P. beträgt 115 °C/20 mmHg und eine 2 °C-Fraktion sollte gesammelt werden.
Berechnung:
Hier ist das begrenzende Reagenz die Salicylsäure; daher sollte die Ausbeute aus der entnommenen Menge berechnet werden.
Molekulare Formel von Salicylsäure = C7H6O3
Molekulare Formel von Methylsalicylat = C8H8O3
Molekulargewicht von Salicylsäure = 138 g/Mol
Molekulargewicht von Methylsalicylat = 152 g/Mol
Theoretische Ausbeute:
138 g Salicylsäure bilden 152 g Methylsalicylat
Daher werden 28 g Salicylsäure gebildet …….? (X) g Methylsalicylat
X =( 152 ×28)/138 = 30,84 g
Theoretische Ausbeute = 30.84 g
Praktische Ausbeute = —– g
% Ausbeute = (Praktische Ausbeute)/(Theoretische Ausbeute) × 100
ZUSAMMENFASSUNG
Methylsalicylat wurde synthetisiert und die prozentuale Ausbeute betrug………..%