Einführung
Prostatakrebs ist die häufigste Form von Malignität und die zweithäufigste Krebstodesursache bei Männern.1 Untersuchungen an Leichen zeigen, dass die Wahrscheinlichkeit, Mikroherde des Prostatakrebses zu entwickeln, mit dem Alter zunimmt (30 % im vierten Lebensjahrzehnt, 40 % im fünften Lebensjahrzehnt usw.).2
Während einige Krebsarten aggressiv sind, haben andere nur ein geringes oder gar kein Metastasierungspotenzial.3 Viele Männer mit einem Prostatakarzinom mit geringem Risiko entwickeln sich nicht weiter oder werden im Laufe ihres Lebens klinisch symptomatisch.4 Aufgrund dieser Variabilität wurden verschiedene Behandlungsoptionen eingeführt, die eine mit der radikalen Prostatektomie (RP) vergleichbare therapeutische Wirkung bieten und gleichzeitig die sexuelle Funktion und Kontinenz erhalten. In diesem Szenario kann die aktive Überwachung (Active Surveillance, AS) eine geringere Morbidität und eine Verbesserung der Lebensqualität bieten.5 Kleine, nicht aggressive Tumore sind die idealen Kandidaten für die AS, auch wenn noch kein Konsens erzielt wurde. Eine Erkrankung mit geringem Risiko ist definiert als Gleason-Score (GS) 6 und prostataspezifisches Antigen (PSA)
ng/ml. Patienten mit einem klinischen Stadium >T2a werden in der Regel ausgeschlossen.6
Der histologische Grad ist eine unabhängige Determinante der Krankheitsprognose und des Überlebens.7 Das GS-Klassifizierungssystem ist die am weitesten akzeptierte Klassifizierung,8 aber viele Studien haben gezeigt, dass der aus der Prostatabiopsie gewonnene GS nicht immer mit dem endgültigen pathologischen Grad der chirurgischen Proben korreliert. In bis zu 57 % der Fälle wurde eine Aufwertung des GS (Erhöhung des GS um mindestens einen Punkt) festgestellt.9,10 Fehler bei der Zuordnung des GS können zu einer unangemessenen Überwachung von biologisch aggressiven Tumoren oder zur Auswahl von Behandlungen mit schlechteren Heilungsraten bei Hochrisikokrankheiten führen, was sich letztlich negativ auf die Ergebnisse für die Patienten auswirken kann.11 Daher wurde in mehreren neueren Studien nach Faktoren gesucht, die eine Hochstufung der GS vorhersagen könnten.12
Ein geringes Prostatavolumen (PV) und insbesondere eine hohe prostataspezifische Antigendichte (PSAD) haben sich in vielen Studien als Prädiktoren für eine Risikoprogression erwiesen, was die Möglichkeit eines unentdeckten aggressiven Krebses widerspiegelt.6 Mehrere Studien haben einen starken Zusammenhang zwischen PSAD und der Aggressivität des Prostatakrebses gezeigt.13 PSAD wurde als starker Prädiktor für eine GS-Aufstufung bei Patienten mit einer durch Biopsie bestätigten Gleason-6-Erkrankung vorgeschlagen, aber es gibt keinen allgemeinen Konsens über den Cut-off-Wert.1117
Hauptziel unserer Studie war es, die unabhängigen Prädiktoren für ein GS-Upgrade zu identifizieren und den besten Cut-off-Wert für PSAD zu ermitteln, um Risikopatienten zu identifizieren.
Materialien und Methoden
Wir sammelten die Studieninformationen aus der prospektiv geführten Datenbank unseres Krankenhauses. Es wurden Patienten mit klinisch lokalisiertem Prostatakrebs ausgewählt, die sich einer radikalen Prostatektomie (RP) unterzogen und bei denen im Zeitraum von Januar 2004 bis Februar 2015 eine präoperative Prostatabiopsie durchgeführt wurde. Der Nachweis von GS 3+3 bei der Prostatabiopsie wurde als Einschlusskriterium herangezogen. Alle klinischen, bildgebenden, labortechnischen und pathologischen Informationen wurden aus der Datenbank entnommen und durch die klinischen Patientenakten bestätigt.
Wir berücksichtigten das präoperative Patientenalter, das klinische Krankheitsstadium, den PSA-Wert vor der Biopsie, den präoperativen PSAD-Wert, den GS-Wert der Biopsie, die Gesamtzahl der entnommenen Biopsiekerne und die Anzahl der Biopsiekerne mit Krebs und analysierten den Zusammenhang zwischen diesen Faktoren und der Erhöhung des GS-Wertes nach der RP. Für jede Variable wurden verschiedene Cut-off-Werte verwendet, um einen möglichen Zusammenhang mit dem Gleason-Upgrade zu identifizieren und zu quantifizieren. Wir analysierten auch die Assoziation des GS-Upgrades mit Variablen des metabolischen Syndroms, wie Diabetes mellitus (DM), Bluthochdruck (HBP) und Adipositas, die aus den klinischen Aufzeichnungen der Patienten gewonnen wurden. Die letztgenannten Variablen wurden einbezogen, weil frühere Studien gezeigt haben, dass sie mit einer schlechteren Prognose und einer höheren Rezidivrate verbunden sind.18,19
PSAD wurde berechnet, indem der präoperative PSA-Wert durch den PV geteilt wurde. Der PV wurde mittels transrektalem Ultraschall unter Verwendung des maximalen Querdurchmessers (D1), des maximalen anteroposterioren Durchmessers (D2) und des maximalen Längsdurchmessers (D3) nach der Formel D1×D2×D3×ϖ/6 berechnet, die auf der Theorie der Prostata-Ellipsendimension beruht.14 Die Prostatabiopsie wurde nach dem zuvor beschriebenen Protokoll unseres Krankenhauses durchgeführt. Alle Patienten wurden leicht sediert, und 15 Minuten vor dem Eingriff wurde eine einmalige i.v.-Dosis Piperacillin/Tazobactam verabreicht.20 Zur Entnahme des Prostatagewebes verwendeten wir eine 18-Gauge-Nadel mit einer automatischen Biopsiepistole. Für die erste Biopsie wurden je nach Größe der Prostata und dem Vorhandensein verdächtiger Knötchen 12-18 Kerne entnommen.21 Alle Proben wurden in einen separaten Behälter mit der Kennzeichnung der entsprechenden Stelle gegeben und an den pathologischen Dienst unseres Krankenhauses geschickt.
Deskriptive Statistiken wurden als Mittelwert±Standardabweichung (SD) und Median/IQR für kontinuierliche Variablen und als absolute Häufigkeit und Verteilungsprozentsatz für kategorische Variablen dargestellt. Die Patienten, die postoperativ auf GS 7 oder höher verbessert wurden, wurden mit denen verglichen, die nicht verbessert wurden. Um Mittelwertunterschiede und Ähnlichkeiten zu ermitteln, wurden die kategorischen Variablen mit dem Pearson-Chi-Quadrat-Test und die kontinuierlichen Variablen mit dem Median-Test und dem Student’s t-Test verglichen. Ein univariater Regressionstest wurde zur Ermittlung signifikanter unabhängiger Prädiktoren für die Aufwertung verwendet. Es wurde eine Receiver-Operating-Characteristic-Kurve (ROC-Kurve) verwendet, und die Fläche unter der Kurve (AUC) wurde berechnet, um den optimalen Cut-off-Wert für Variablen mit prädiktiver Bedeutung für das GS-Upgrade zu ermitteln. Wir schätzten die Sensitivität, Spezifität, den positiven prädiktiven Wert und den negativen prädiktiven Wert verschiedener von anderen Autoren vorgeschlagener Cut-off-Punkte, wandten sie auf unsere Population an und verglichen sie dann mit unserem Cut-off-Wert. Alle Tests waren zweiseitige Tests mit einem p-Wert von
Ergebnisse
Von den insgesamt 342 Patienten in unserer Datenbank wurden 144 (42,1 %) ausgeschlossen, weil sie einen GS ≥4 in der Prostatabiopsie hatten. Somit blieben 198 (57,9 %) Patienten übrig, die unsere Einschlusskriterien von GS 6 (3+3) erfüllten. Dreiundsiebzig dieser Patienten wurden aufgrund unvollständiger klinischer Angaben in den Krankenakten ausgeschlossen.
Das Durchschnittsalter der Patienten betrug 65,1±6,3 Jahre, der Body-Mass-Index (BMI) lag bei 26,7±3,6 kg/m2, die Anzahl der entnommenen Kerne betrug 13,4±3,5, die Anzahl der positiven Kerne 2,5±2 und der präoperative PSAD-Wert lag bei 0,26±0,23ng/ml2. Der präoperative mediane PSA-Wert betrug 7,2 IQR 5,67-10,05 und der PV-Wert 38 IQR 26,5-55,5. Das klinische Stadium auf der Grundlage der digitalen rektalen Untersuchung war T1c bei 86 (69,6%) Patienten, T2a bei 28 (22,4%), T2b bei 7 (5,6%), T2c bei 2 (1,6%) und T3 bei einem (0,8%) Patienten.
Das präoperative PSA wurde wie folgt kategorisiert: 6 (4,8%) Patienten hatten PSA-Werte
ng/ml, 88 (70,4%) lagen zwischen 4 und 9,9ng/ml, 23 (18,4%) zwischen 10 und 19,9ng/ml und 8 (6,4%) hatten PSA ≥20ng/ml. Bei 71 (56,8 %) Patienten mit GS 3+3 blieben das Biopsie-GS und das chirurgische GS gleich, während bei 54 (43,2 %) Patienten ein Upgrade erfolgte. Von den Patienten mit Upgrade stiegen 70 % auf einen GS von 7 und 30 % auf ≥8.
Tabelle 1 zeigt die demografischen und klinischen Merkmale der Patienten mit und ohne GS-Upgrade. Wir fanden eine statistisch signifikante Korrelation zwischen dem postoperativen Upgrade und dem präoperativen PSAD-Wert (p0,001), dem präoperativen PSA (p=0,039), dem PV (p=0,004) und dem Patientenalter ≥70 Jahre (p=0.011).
Charakteristika von Patienten mit und ohne Upgrade des Gleason-Scores nach radikaler Prostatektomie.
| Merkmale | Aufwertung | keine Aufwertung | p-Wert |
|---|---|---|---|
| Anzahl. der Patienten (%) | 54 (43,2%) | 71 (56.8%) | |
| Alter (Jahre) | |||
| Mittelwert±SD | 66.22±6,5 | 64,28±6,0 | 0,092b |
| Alter (Nr.) | |||
| >70 Lebensjahre | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| BMI (kg/m2) | |||
| Mittelwert±SD | 26.22±4.0 | 27.14±3.1 | 0.178c |
| PSA (ng/ml) | |||
| Median/IQR | 8/6.5-12.6 | 6,8/5,4-9 | 0,039*,c |
| Prostatavolumen (ml) | |||
| Median/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Mittelwert±SD | .36±.27 | .19±.16 | *,c |
| Biopsiekerne (Anzahl.) | |||
| Mittelwert±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Positive Kerne (Anzahl) | |||
| Mittelwert±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c |
| Auffälligkeit (Anzahl) | |||
| positiv | 9 (16,6%) | 16 (22,5%) | 0.500a |
| Negativ | 45 (83,4%) | 55 (77.5%) | |
| DM (Nr.) | |||
| Positiv | 16 (29,6%) | 14 (19.7%) | 0.150a |
| Negativ | 38 (70.4%) | 57 (80.3%) | |
| HBP (Nr.) | |||
| positiv | 21 (38.9%) | 30 (42.2%) | 0.775a |
| Negativ | 33 (61.1%) | 41 (57.8%) | |
IQR: Interquartilsbereich; BMI: Body Mass Index; PSA: Prostata-spezifisches Antigen; PSAD: Prostata-spezifische Antigendichte; DM: Diabetes mellitus; HBP: Bluthochdruck.
X2-Test.
Student’s t-test.
Median-Test.
Statistisch signifikant mit einem p-Wert
Wir schätzten einen optimalen PSAD-Cut-off-Punkt von 0.17ng/ml2 durch ROC-Analyse mit einer AUC von 0,675 (p=0,001, 95%CI .580-.770) und analysierten dann die von anderen Autoren vorgeschlagenen Cut-off-Werte und verglichen sie. Tabelle 2 und Abb. 1 zeigen diese Ergebnisse.
Analyse verschiedener Cutoff-Werte der PSAD als Prädiktor für ein GS-Upgrade.
| Upgrade | kein Upgrade | p | Odds Verhältnis | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (Nr.) | ||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49 (69%) | |||||||
PSAD: prostataspezifisches Antigen.
X2-Test.
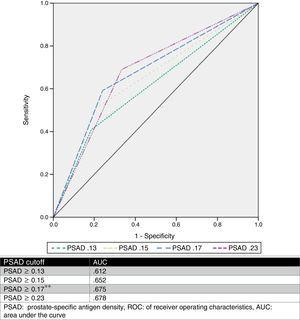
ROC-Kurve.
Tabelle 3 zeigt die Ergebnisse der univariaten Regression zur Ermittlung unabhängiger Prädiktoren für die Aufwertung.
Unabhängige Prädiktoren für die Aufwertung (univariate Regression).
| Merkmale | HR | 95 CI | p-Wert |
|---|---|---|---|
| Alter | 0.5 | 0,99-1,11 | 0,09 |
| >70 Lebensjahre | 1.06 | 1.26-6.63 | 0.039* |
| BMI | 0.072 | 0.97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0.15 | 1.39 | 1.79-9.03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Prostatavolumen | 0.02 | 1,01-1,04 | 0,008* |
| Positive Biopsiekerne | 0.06 | 0,98-1,18 | 0,24 |
| Adipositas | 0,31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0.152 |
| HBP | 0.10 | 0.53-2.29 | 0.775 |
BMI: Body-Mass-Index; PSA: prostataspezifisches Antigen; PSAD: prostataspezifische Antigendichte; DM: Diabetes mellitus; HBP: Bluthochdruck.
Diskussion
Verschiedene Studien haben eine mangelnde Übereinstimmung zwischen dem GS-Bericht der Prostatabiopsie und dem Bericht der radikalen Prostatektomie festgestellt. In einer kürzlich durchgeführten Meta-Analyse mit 14.839 Patienten schätzten die Autoren, dass sich bei 30 % der Patienten ein GS-Upgrade ergab, wobei nur 63 % nach der Prostatektomie unverändert blieben.22 Ein Gleason-Upgrade wurde in 29-58 % der Fälle festgestellt,23 und ist in der Untergruppe der Patienten mit einem Biopsie-GS 3+3 (bis zu 63,3 %) schlechter.14 In unserem Krankenhauszentrum fanden wir ein GS-Upgrade bei 42,1 % aller Patienten, die sich einer radikalen Prostatektomie unterzogen, und bei 43,2 % der Patienten mit einem Biopsie-Gleason-Score von 3+3.
Viele Autoren haben versucht, Prädiktoren für ein GS-Upgrade zu finden, insbesondere mit der derzeit zunehmenden Popularität der AS-Protokolle. Zuvor beschriebene Prädiktoren sind Alter >60 Jahre, PSA-Wert >5,0ng/ml und >25% positive Kerne bei der Biopsie.24
PSAD wurde analysiert und mehrere Cut-off-Werte wurden beschrieben (wie ≥0,13ng/ml, ≥0,15ng/ml und ≥0,23ng/ml).11,13,16,17 Dennoch gibt es keinen Konsens über die Verwendung dieses Wertes zur genauen Vorhersage eines GS-Upgrades. Auf der Grundlage unserer Ergebnisse haben wir einen Cut-off-Wert von ≥0,17ng/ml vorgeschlagen, der eine AUC von 0,675, eine Sensitivität von 75,9 %, eine Spezifität von 59,2 %, einen PPV von 58,5 % und einen NPV von 76,3 % für die Vorhersage eines GS-Upgrades aufwies. Wir haben diesen Cut-off-Punkt gewählt, weil bei der Analyse anderer vorgeschlagener Werte in Bezug auf unsere Fallserie die beste AUC mit einem Wert ≥0,23ng/ml (0,678) erzielt wurde, der jedoch eine schlechtere Sensitivität und eine hohe Falsch-Negativ-Rate (33,33 %) aufwies. Wurden dagegen die Werte ≥0,13ng/ml und ≥0,15ng/ml verwendet, lag die Falsch-Positiv-Rate bei 59 % bzw. 49 %. Die Falsch-Negativ-Rate und die Falsch-Positiv-Rate des von unserem Team vorgeschlagenen Cut-Off-Werts lagen bei 24 % bzw. 41 %, was wir als am sinnvollsten erachteten. Abb. 2 zeigt ein Diagramm unserer Population.

Die Studienpopulation mit den verschiedenen prostataspezifischen Antigendichten und Upgrade-Daten.
In unsere Studie wurden nur Patienten mit einem Biopsie-GS von 3+3 aufgenommen, da diese Variable bei der Auswahl eines Patienten für eine AS von großer Bedeutung ist. Da es noch andere Faktoren gibt, die bei der aktiven Überwachung berücksichtigt werden, können wir nicht behaupten, dass das Risiko eines GS-Upgrades und die PSAD ausschlaggebende Variablen für den Vorschlag einer therapeutischen Strategie sind, aber wir sind auf jeden Fall der Meinung, dass sie diskutiert werden sollten, bevor eine Entscheidung getroffen wird. Bei Patienten mit einem PSAD-Wert von ≥0,17ng/ml könnte eine zweite Biopsie angezeigt sein, um den GS zu bestätigen, wobei das Risiko einer Unterklassifizierung zu berücksichtigen ist. Die MRT der Prostata und MRT-gesteuerte Fusionsbiopsien haben eine hohe Sensitivität und Spezifität für die Lokalisierung von nicht erkanntem signifikantem Krebs gezeigt.25 Diese Optionen sind in Mexiko jedoch nicht weit verbreitet, so dass die transrektale ultraschallgesteuerte Sättigungs- oder Schablonenbiopsie eine praktikablere Option zur Erhöhung der diagnostischen Genauigkeit sein könnte.
Rezente Erkenntnisse deuten auf einen Zusammenhang zwischen den verschiedenen Komponenten des metabolischen Syndroms und Prostatakrebs hin, der das Risiko erhöht, an der Krankheit zu erkranken und daran zu sterben,21 sowie eine höhere Rate an biochemischen Rezidiven nach einer Radikalbehandlung.22 In unserer Studie konnten wir jedoch keinen Zusammenhang mit einem höheren Gleason-Score nachweisen.
Das Prostatavolumen, das direkt mit dem Alter zusammenhängt, könnte ein störendes Element sein. Wenn eine zufällige ultraschallgesteuerte Biopsie in einer großen Prostata durchgeführt wird, besteht das potenzielle Risiko, dass größere unzureichend beprobte Bereiche zurückbleiben, was ein höheres Risiko darstellt, dass ein signifikanter Tumor übersehen wird.
Die AS hat bei Patienten mit Prostatakrebs mit geringem Risiko vielversprechende Ergebnisse erbracht, mit Verbesserungen der Lebensqualität, der Erhaltung der Erektionsfähigkeit und der Harnkontinenz sowie anderer Komplikationen, die mit radikalen Behandlungen verbunden sind.6 Es besteht jedoch das Risiko, dass ein aggressiver Krebs falsch diagnostiziert und eine angemessene Behandlung verzögert wird, was die Prognose der Patienten beeinträchtigt. Es gibt viele Kriterien für die Auswahl von AS-Kandidaten, wobei die D’Amico-Risikoklassifikation26 und die Epstein-Kriterien27 am häufigsten für diesen Zweck verwendet werden. Erstere beziehen die PSAD nicht mit ein, aber in den Epstein-Kriterien wird die Verwendung eines Cut-off-Werts ≥0,15ng/ml vorgeschlagen. In unserem Krankenhaus wenden wir sehr strenge Kriterien an, und der PSAD-Cut-off-Wert ≥0,17ng/ml wird bei der Auswahl eines möglichen AS-Kandidaten in die Diskussion einbezogen.
Der retrospektive Charakter unserer Studie war ihre größte Einschränkung. Die potenzielle Stichprobe wurde durch unvollständige Daten in den klinischen Fallberichten noch weiter reduziert. Eine weitere Einschränkung war die Tatsache, dass wir nicht über alle Daten der Biopsieproben verfügten, so dass wir die Patienten nicht nach den vollständigen AS-Kriterien analysieren konnten. Mit der Anzahl der in die Studie einbezogenen Patienten wurden jedoch aussagekräftige Ergebnisse erzielt, die dazu verwendet werden können, das Risiko eines GS-Upgrades bei Patienten mit GS 3+3 zu berücksichtigen.
Schlussfolgerungen
Wir kommen zu dem Schluss, dass es wichtig ist, so viele Instrumente wie möglich zu verwenden, um genaue Entscheidungen zu treffen und die Patienten mit einem hohen Risiko eines pathologischen Upgrades zu identifizieren, die von einer sorgfältigeren Untersuchung und/oder aggressiven Behandlung profitieren könnten. Die PSAD sollte routinemäßig eingesetzt werden, um Patienten mit scheinbar risikoarmen Krebserkrankungen zu identifizieren, bei denen ein Risiko für ein GS-Upgrade besteht, was zu einer genaueren Auswahl der Kandidaten für eine AS führt. Unseren Daten zufolge können wir in etwa 43 % der Fälle ein möglicherweise falsches GS-Staging vermeiden.
Wir fanden in unserer Population eine hohe Häufigkeit von GS-Upgrades. In unserer Studie waren die PSAD-Werte signifikant mit einer Höherstufung assoziiert, und der genaueste Cut-off-Wert war 0,17ng/ml2. Wir empfehlen, dass eine lokale Überprüfung des GS-Upgrade-Risikos und seiner potenziellen Prädiktoren in allen Krankenhauszentren durchgeführt wird, bevor potenziellen Kandidaten eine aktive Überwachung angeboten wird.
Ethische AngabenSchutz von Menschen und Tieren
Die Autoren erklären, dass für diese Studie keine Experimente an Menschen oder Tieren durchgeführt wurden.
Vertraulichkeit der Daten
Die Autoren erklären, dass in diesem Artikel keine Patientendaten erscheinen.
Recht auf Privatsphäre und informierte Zustimmung
Die Autoren erklären, dass in diesem Artikel keine Patientendaten erscheinen.
Finanzierung
Für die Durchführung dieses Artikels haben sie keinerlei Unterstützung erhalten.
Interessenkonflikt
Die Autoren erklären, dass sie sich in keinem Interessenkonflikt befinden und dass sie keine Unterstützung für die Studie erhalten haben.