- Axiale chromatinfreie Hohlräume erscheinen in Pflanzen mit einem durchschnittlichen 2C-DNA-Gehalt von über 0.8 pg pro Chromosom
- Chromosomenkondensation/Dekondensation kann in Halbdünnschnitten von N. damascena-Zellen nach 4′,6-Diamidino-2-Phenylindol (DAPI)-Färbung sichtbar gemacht werden
- Chromosomenkondensation/-dekondensation während der Mitose, analysiert nach 5-Ethynyl-2′-Desoxyuridin (EdU)-Einbau
- Chromosomenkondensation/-dekondensation während der Mitose, analysiert durch Elektronenmikroskopie
Axiale chromatinfreie Hohlräume erscheinen in Pflanzen mit einem durchschnittlichen 2C-DNA-Gehalt von über 0.8 pg pro Chromosom
Anaphase- und Telophase-Chromatiden einiger Pflanzen enthalten chromatinfreie Hohlräume in den axialen Regionen, die diese Pflanzen von den meisten anderen bisher untersuchten Pflanzen und Tieren unterscheiden (Abb. 1a, b). Soweit uns bekannt ist, beschränken sich Berichte über eine solche Chromosomenorganisation auf Pflanzen mit großen Genomen, und es ist anzunehmen, dass eine solche morphologische Organisation ein spezifisches Merkmal für diese Pflanzen ist. Um diese Vermutung zu bestätigen, haben wir auch Anaphase- und Telophase-Chromatiden von 12 Arten elektronenmikroskopisch untersucht (Tabelle 1; Abb. 1a, b; Additional file 1: Abbildung S1). Abbildung 1c zeigt, dass axiale chromatinfreie Hohlräume nur im Inneren der Chromosomen von Pflanzen mit großen Genomen und mit großen Chromosomen deutlich zu sehen waren, aber es schien, dass die durchschnittliche Chromosomengröße besser mit dem Vorhandensein oder Nichtvorhandensein dieser Hohlräume korrelierte. Unter den Pflanzen mit axialen Hohlräumen hatte Hordeum vulgare das kleinste Genom und den geringsten durchschnittlichen 2C-DNA-Gehalt pro Chromosom (0,79 pg). Somit ist diese Chromosomenorganisation ein Kennzeichen von Pflanzenchromosomen, deren 2C-DNA-Gehalt grob auf über 0,8 pg pro Chromosom geschätzt werden kann.
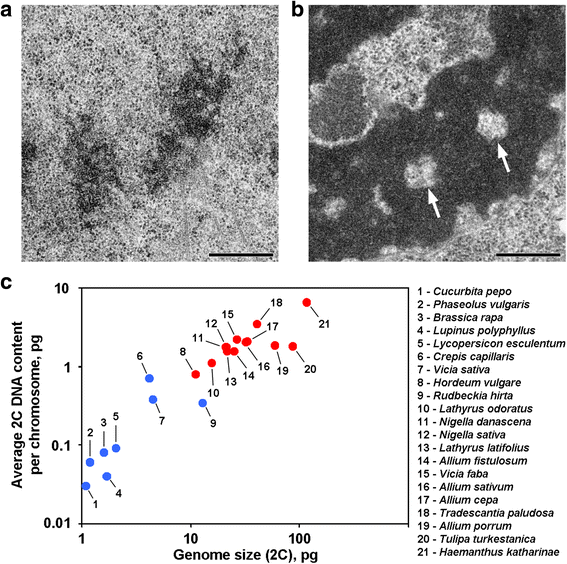
Zwei Varianten der Chromosomenorganisation in Pflanzen. a Telophasenchromosomen der Ackerbohne (Phaseolus vulgaris) als Beispiel für Chromosomen ohne axiale chromatinfreie Hohlräume. b Telophasenchromosomen von N. damascena mit deutlich sichtbaren axialen chromatinfreien Hohlräumen (Pfeile). c Das Vorhandensein von axialen chromatinfreien Hohlräumen hängt vom Genom und der Chromosomengröße ab. Blaue Punkte stellen Pflanzen dar, bei denen die Chromosomen keine axialchromatinfreien Hohlräume enthalten; rote Punkte stellen Pflanzen dar, bei denen die Chromosomen axialchromatinfreie Hohlräume enthalten. Skalenbalken: 0,5 μm
Chromosomenkondensation/Dekondensation kann in Halbdünnschnitten von N. damascena-Zellen nach 4′,6-Diamidino-2-Phenylindol (DAPI)-Färbung sichtbar gemacht werden
Das für die Untersuchung von Pflanzenchromosomen am besten geeignete Objekt, das Wurzelapikalmeristem, erlaubt wegen der unscharfen Fluoreszenz keine hochauflösenden Bilder. Hier haben wir eine Methode angewandt, die auf der Verwendung von halbdünnen (200-250 nm) Schnitten von in LR White Medium eingebetteten Wurzeln basiert. Die Dicke dieser Schnitte war deutlich geringer als die der optischen Schnitte, selbst wenn ein konfokales Mikroskop verwendet wurde. Um die morphologischen Merkmale zu finden, die es uns erlaubten, Zellen in verschiedenen mitotischen Stadien zu identifizieren, analysierten wir die Morphologie der mit DAPI gefärbten Zellen.
Es gab mehrere Transformationen der Chromosomenorganisation von N. damascena, die sogar unter dem Fluoreszenzmikroskop leicht sichtbar waren. In den Kernen der frühen Prophase waren Teile von dünnen Chromosomen (mit einem Durchmesser von etwa 0,6 μm) sichtbar (Abb. 2a). In der mittleren Prophase bildeten sich dickere Prophase-Chromosomen (ca. 1,2 μm), in deren Inneren dünnere Fasern zu erkennen waren, die wahrscheinlich gefalteten Chromosomen der frühen Prophase entsprachen (Abb. 2b). In der späten Prophase (Abb. 2c), der Metaphase (Abb. 2d) und der Anaphase (Abb. 2e) waren die Chromosomen dicht kondensiert, und es war keine interne Organisation erkennbar. Während der Dekondensation in der Telophase führte die Abtrennung von Chromatinfasern mit einem Durchmesser von etwa 0,4 μm zum Auftreten von chromatinfreien Hohlräumen in den axialen Regionen der Chromatiden (Abb. 2f), deren Größe während der Telophase allmählich zunahm (Abb. 2g und h). Der Durchmesser der Chromatinfasern in den Telophase-Chromosomen war vergleichbar mit der Größe der frühen Prophase-Chromosomen. Somit waren alle mitotischen Stadien von N. damascena in mit DAPI gefärbten Halbdünnschnitten leicht zu erkennen.
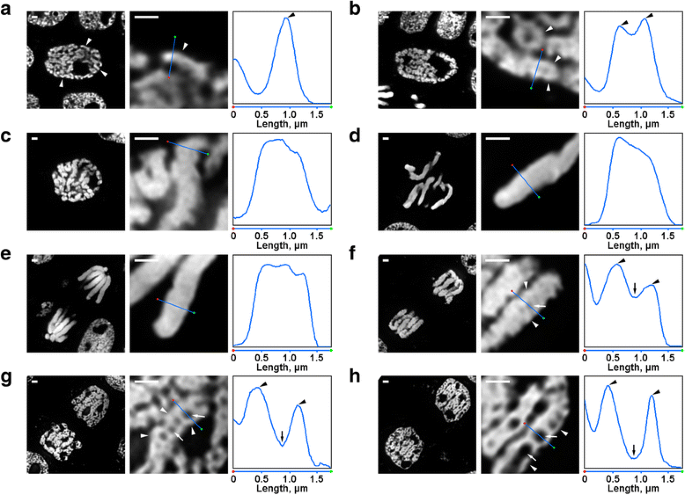
Morphologie der mitotischen Chromosomen von N. damascena. Die linke und die mittlere Tafel zeigen fluoreszenzmikroskopische Aufnahmen von DAPI-gefärbten Halbdünnschnitten (Gesamtansicht und Fragment); die rechte Tafel zeigt einen Dichteplot durch die Linie in der mittleren Tafel. a Frühe Prophase (Chromosomen sind durch Pfeilspitzen gekennzeichnet). b Mittlere Prophase (Fasern, die Chromosomen bilden, die den Chromosomen der frühen Prophase zu entsprechen scheinen, sind durch Pfeilspitzen gekennzeichnet). c Späte Prophase. d Metaphase. e Anaphase. f Frühe Telophase (axiale chromatinfreie Hohlräume sind durch Pfeile gekennzeichnet, Fasern, die Telophase-Chromosomen bilden, sind durch Pfeilspitzen gekennzeichnet). g Späte Telophase. h G1-Phase. Skalenbalken: 1 μm
Chromosomenkondensation/-dekondensation während der Mitose, analysiert nach 5-Ethynyl-2′-Desoxyuridin (EdU)-Einbau
Während der Prophase wurden dünne Chromosomen der frühen Prophase in dicke Chromosomen der späten Prophase umgewandelt. Die Verdickung der Prophase-Chromosomen kann entweder auf eine Faltung der frühen Prophase-Chromosomen oder auf eine allmähliche Verdickung zurückzuführen sein. Um diese beiden möglichen Mechanismen zu untersuchen, war es notwendig, die diskreten Chromosomenfoci zu markieren, die linear innerhalb der frühen Prophase-Chromosomen angeordnet waren, und dann ihre räumliche Umordnung während der Prophase-Kondensation zu analysieren. Wie in Abb. 3a dargestellt, verlieren solche Foci während des Übergangs von der frühen zur späten Prophase entweder die lineare Anordnung (Faltung) oder sie behalten die lineare Anordnung bei und dehnen sich zu dünnen Bändern aus (Verdickung). Um die Chromosomenregionen zu markieren, bauten wir das synthetische Nukleotid EdU, das durch Click-Chemie nachgewiesen werden kann, während der Replikation in das Chromatin ein.
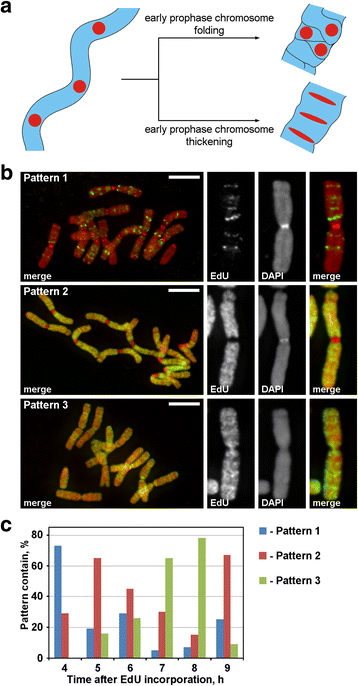
Chromosomenmarkierung mit EdU. a Die Lokalisierung der markierten Regionen und die Morphologie zeigen das Prinzip der Chromosomenkondensation in der Prophase. Linear angeordnete, markierte Chromosomenregionen während des Übergangs von der frühen zur späten Prophase würden entweder die lineare Anordnung verlieren (Faltung) oder die lineare Anordnung beibehalten (Verdickung). b Drei Muster des EdU-Einbaus wurden in den Chromosomen festgestellt: Markierung diskreter Regionen (Muster 1), Markierung von Chromosomenarmen, aber nicht von Zentromeren (Muster 2) und Markierung sowohl von Chromosomenarmen als auch von Zentromeren (Muster 3). c Häufigkeit der verschiedenen Markierungsmuster zu verschiedenen Zeitpunkten nach dem EdU-Einbau. Skalenbalken: 5 μm
EdU wurde 30 Minuten lang in die Wurzeln von N. damascena eingebracht, und nach verschiedenen Chase-Perioden (von 2 bis 14 Stunden) wurden die Chromosomenausbreitungen vorgenommen. Es wurden drei Muster der Chromosomenmarkierung festgestellt: Markierung diskreter Regionen (Muster 1), Markierung der Chromosomenarme, aber nicht der Zentromere (Muster 2) und Markierung sowohl der Chromosomenarme als auch der Zentromere (Muster 3) (Abb. 3b). Muster 1 wurde häufiger 4 Stunden nach der EdU-Inkorporation beobachtet, was darauf hindeutet, dass eine solche Markierung typisch für die späte S-Phase ist (Abb. 3c; Additional file 2: Abbildung S2). Im Falle von Muster 1 war die Markierung der homologen Chromosomen ähnlich (Additional file 3: Abbildung S3), was auf ein spezifisches Muster des EdU-Einbaus hinweist. Die Chromosomenarme wurden während des Rests der S-Phase markiert (Muster 2 und 3), aber auch die zentromerischen Regionen wurden ungefähr an der Grenze zwischen früher und später S-Phase markiert (Muster 3) (Abb. 3c).
Wir analysierten die Übergänge von der frühen zur späten Prophase anhand von Chromosomen, bei denen spät replizierendes Chromatin markiert wurde (Muster 3). In Chromosomen der frühen Prophase waren die markierten Bereiche linear entlang dünner Chromosomen verteilt (Abb. 4a). Bei Chromosomen der späten Prophase, die im Vergleich zu denen der frühen Prophase etwa doppelt so dick waren, verloren die markierten Bereiche ihre lineare Verteilung (Abb. 4b). Diese Beobachtung war nicht ganz richtig, da Prophase- und Metaphase-Chromosomen aus zwei Chromatiden bestehen, die sich allmählich entmischen, was zu einem Verlust der Linearität der Verteilung der markierten Regionen führen kann. Daher haben wir die Anaphase-Chromatiden (d. h. die nach der Chromatidentrennung vollständig verdichteten Chromosomen) weiter analysiert. In Anaphase-Chromatiden mit einem Durchmesser, der ungefähr dem Durchmesser der späten Prophase-Chromosomen entspricht, waren die markierten Chromatinregionen nicht linear angeordnet, sondern über das gesamte Volumen der Chromatiden verteilt (Abb. 4c). In der Telophase waren die chromatinfreien Hohlräume in den axialen Bereichen der Chromatiden deutlich sichtbar, so dass die Chromatinfasern, in denen die markierten Bereiche linear angeordnet waren, erkannt werden konnten (Abb. 4d). Während des Übergangs von der frühen zur späten Prophase kam es also zur Faltung der Chromosomen der frühen Prophase. Dieses Ergebnis stimmt mit den Beobachtungen an DAPI-gefärbten Chromosomen der mittleren Prophase (Abb. 2b) überein, in denen gefaltete dünne Fasern deutlich sichtbar waren.
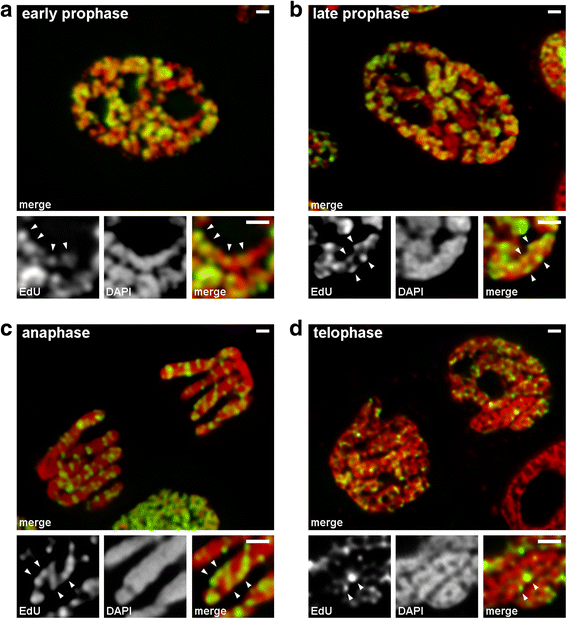
Chromosomenkondensation/Dekondensation während der Mitose von N. damascena (mitotische Zellen, deren Chromosomen während der späten S-Phase EdU enthielten). a In der frühen Prophase waren die markierten Bereiche linear in dünnen Chromosomen verteilt und überspannten die Chromosomenbreite fast vollständig. b In der späten Prophase waren die markierten Bereiche über das gesamte Chromosomenvolumen verstreut. c In der Anaphase war das Markierungsmuster ähnlich wie bei den Chromosomen der späten Prophase. d In der späten Telophase zeigte die Dekondensation dünne Fasern, die Chromatiden bildeten, in denen die markierten Bereiche ähnlich wie in den Chromosomen der frühen Prophase verteilt waren. Skalenbalken: 1 μm
Chromosomenkondensation/-dekondensation während der Mitose, analysiert durch Elektronenmikroskopie
Für den Nachweis der inneren Organisation der Chromatinfasern, deren Faltung mit Hilfe der Lichtmikroskopie beschrieben wurde, haben wir die Elektronenmikroskopie verwendet. Um chromatinfibrilläre Substrukturen zu erkennen und zu messen, analysierten wir chromatinfreie Hohlräume, die Chromatinfasern trennten, wie wir annahmen (Additional file 4: Abbildung S4; Tabelle 2).
Interphasenkerne waren mit einem Geflecht aus dicken 234 ± 49 nm (Mittelwert ± S.D.) Fasern gefüllt (Abb. 5a), die, wie an anderer Stelle diskutiert, als „Interphasen-Chromonemata“ bezeichnet werden können. Mit Hilfe der Elektronenmikroskopie konnten drei Stadien der Prophase-Chromosomenkondensation nachgewiesen werden, von denen das früheste mit Hilfe der Lichtmikroskopie nicht erkannt werden konnte und hier als „Präprophase“ bezeichnet wird. Das zweite und dritte Stadium entsprach der frühen und späten Prophase, wie oben beschrieben (Abb. 2a bzw. c).
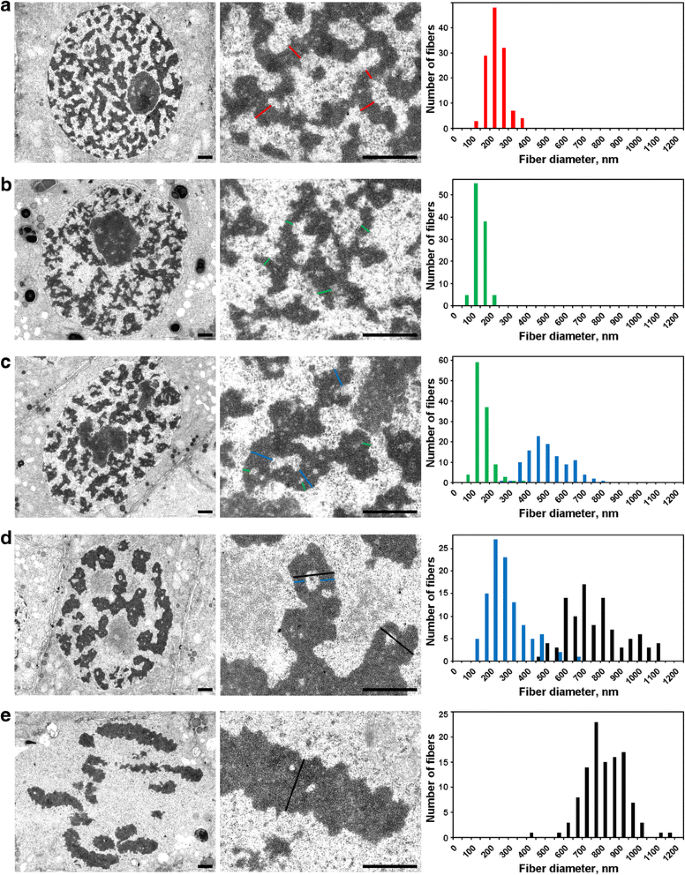
Elektronenmikroskopische Morphometrie von N. damascena-Chromosomen: Chromosomenkondensation von der Interphase bis zur Metaphase. Die linke und die mittlere Tafel zeigen die ultrastrukturelle Organisation (Gesamtansicht und Fragment), die rechte Tafel zeigt Histogramme, die die Verteilung der Chromosomen- und Chromatinfaserbreite darstellen. a Interphase. b Präprophase. c Frühe Prophase. d Späte Prophase. e Metaphase. Die typischen Querschnitte der Chromosomen und/oder Chromatinfibrillen sind durch farbige Linien gekennzeichnet: rot – Interphasen-Chromonemata (Heterochromatin), grün – Chromonemata; blau – „300 nm Fasern“; schwarz – Chromosomen. Skalenbalken: 1 μm
(1) In der Präprophase waren die Chromosomen nur schlecht voneinander getrennt, und wir konnten ihren Durchmesser nicht genau messen (Abb. 5b). Die Präprophase-Chromosomen bestanden aus Fasern mit einem Durchmesser von 148 ± 30 nm (Tabelle 2), was höchstwahrscheinlich den Fasern mit einem Durchmesser von 100-130 nm (Chromonema) entsprach, die die Hauptchromosomen-Substruktur der Prophase- und Telophase-Chromosomen in tierischen Zellen darstellen. Die Daten erlaubten es uns nicht, die Identität von Interphasen- und mitotischen Chromonemen festzustellen, aber früher gemeldete Daten deuten darauf hin, dass die Interphasen-Chromonemen Komplexe sind, die von gefalteten Chromonemen gebildet werden.
(2) In der frühen Prophase erfolgte die Trennung der Chromosomen (Abb. 5c). Der Durchmesser der Chromosomen betrug 527 ± 107 nm, und diese Chromosomen wurden ebenfalls durch Chromonemata mit einem Durchmesser von 158 ± 46 nm gebildet.
(3) Schließlich analysierten wir Zellen der späten Prophase, die verdickte Chromosomen mit einem Durchmesser von 809 ± 185 nm enthielten (Abb. 5d). Einige späte Prophase-Chromosomen enthielten Hohlräume in den axialen Regionen, die es uns ermöglichten, die Fasern mit einem Durchmesser von 285 ± 102 nm („300 nm-Faser“) zu unterscheiden. Die Analyse der markierten Chromosomensegmente zeigte, dass sich die Chromosomen der frühen Prophase zu dickeren Chromosomen der späten Prophase falteten (Abb. 4). Daher kann davon ausgegangen werden, dass es sich bei den 285 ± 102 nm großen Fasern und den 527 ± 107 nm großen Chromosomen der frühen Prophase um die gleichen Fasern handelt. Der verringerte Durchmesser der Fasern könnte mit der Chromatinverdichtung der frühen Prophasechromosomen zusammenhängen, worauf auch das Verschwinden der sichtbaren Chromonemata hindeutet.
Das Chromatin im Inneren der Metaphase-Chromosomen (Abb. 5e) und der Anaphase-Chromatiden (Abb. 6a) war stark verdichtet, und obwohl seltene chromatinfreie Hohlräume in ihrem Inneren sichtbar waren, war eine genaue Unterscheidung von fibrillären Substrukturen unmöglich. In den Chromosomen der frühen Telophase konnten zwei Arten von Hohlräumen eindeutig nachgewiesen werden (Abb. 6b). Große Hohlräume befanden sich in der axialen Region der Chromatiden, so dass wir Fasern mit einem Durchmesser von 422 ± 78 nm identifizieren und messen konnten. In den zentralen Bereichen dieser Fasern entdeckten wir kleine Hohlräume, die es uns ermöglichten, einen zweiten Fasertyp mit einem Durchmesser von 182 ± 47 nm zu identifizieren. Der erste Fasertyp könnte den „300-nm-Fasern“ innerhalb der späten Prophase-Chromosomen entsprechen, der zweite Typ den Chromonemata.

Elektronenmikroskopische Morphometrie von N. damascena-Chromosomen: Chromosomendekondensation von der Anaphase bis zur G1-Phase. Die linke und die mittlere Tafel zeigen die ultrastrukturelle Organisation (Gesamtansicht und Fragment), die rechte Tafel zeigt Histogramme, die die Verteilung der Chromatiden- und Chromatinfaserbreite darstellen. a Anaphase. b Frühe Telophase. c Späte Telophase. d G1-Phase. Die typischen Querschnitte der Chromosomen und/oder Chromatinfibrillen sind durch farbige Linien gekennzeichnet: rot – Interphasen-Chromonemata, grün – Chromonemata; blau – ‚300 nm Fasern‘; schwarz – Chromatiden. Skalenbalken: 1 μm
In der späten Telophase (Abb. 6c) und in der G1-Phase (Abb. 6b) sind die Chromatiden in den Chromosomenfibrillen zu sehen. 6d), wurden die Chromosomen in den Tochterkernen zu Chromosomendomänen dekondensiert, wo sie nicht leicht zu beobachten sind. Dennoch war es möglich, getrennte Chromatidenfragmente zu identifizieren. In diesem Stadium bestanden die Chromatiden aus Fasern mit einem Durchmesser von etwa 250 nm, was in etwa dem Durchmesser der Interphasen-Chromonemata entspricht. Diese Beobachtung und das Verschwinden der Chromonemafasern deuten darauf hin, dass sich die Chromatinfasern in diesem Stadium der Mitose zu Interphasenkomplexen aus kondensiertem Chromatin zusammenfalten.