Betrachten Sie eine allgemeine nukleophile Substitutionsreaktion.
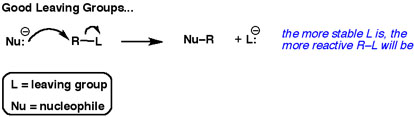
Der zweite Pfeil zeigt immer ein Elektronenpaar, das zur Abgangsgruppe geht.
Die besten Abgangsgruppen „wollen“ diese Elektronen. Sie wollen sie nicht mit anderen Atomen teilen.
Gute Abgangsgruppen sind schwache Basen.
Schwache Basen haben starke konjugierte Säuren. Wir können also schwache Basen identifizieren, indem wir uns eine #“p „K_“a“-Tabelle ansehen.
Achtung: Der #“p „K_“a „#-Wert misst die Lage eines Gleichgewichts. Die Fähigkeit, Gruppen zu verlassen, basiert jedoch auf den Reaktionsgeschwindigkeiten. Obwohl die Korrelation also gut ist, ist sie nicht perfekt.

Im Allgemeinen gilt: Je schwächer die Base, desto besser die Abgangsgruppe.
Ausnahme: Fluor ist eine schlechte Abgangsgruppe.
F- ist ein kleines Ion. Seine hohe Ladungsdichte macht es relativ unpolarisierbar. Die Abgangsgruppe muss polarisierbar sein, um die Energie des Übergangszustandes zu senken. In einer #“S“_“N „2#-Reaktion sollte F- niemals austreten.
Frage: Warum ist Wasser eine gute Abgangsgruppe?
Antwort#Farbe(weiß)(ll)#: Ist es nicht! Das Hydronium-Ion ist die Abgangsgruppe.
Erläuterung:
Betrachte das Gleichgewicht
#“R-OH ⇌ R“^“+“ + unterBrace(„OH“^“-„)_color(red)(„konj. Base von H“_2 „O“)#
Wasser ist eine schwache Säure, also ist das Hydroxid-Ion eine starke Base. Es „will“ seine einsamen Elektronenpaare nutzen, um eine kovalente Bindung zu bilden.
Die Gleichgewichtslage liegt also weit links.
Wenn wir den Alkohol protonieren, erhalten wir
#“R-„stackrelcolor(blue)(+)(„O“) „H“_2 ⇌“R“^“+“ + underbrace(„OH“_2)_color(red)(„conj. Base von H“_3 „O“^“+“)#
Wasser ist die konjugierte Base des Hydronium-Ions, der stärksten Säure, die in Wasser vorkommen kann, und damit eine schwache Base.
Sie hat wenig Neigung, ihre Elektronenpaare mit anderen Spezies zu teilen.
Wasser in Form von Hydronium-Ionen ist eine ausgezeichnete Abgangsgruppe.
Hier ist ein Video darüber, was eine gute Abgangsgruppe ausmacht.