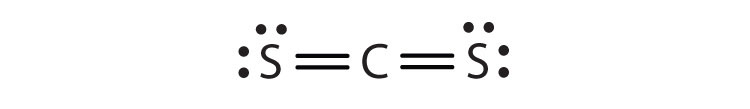4.3 Enlaces covalentes múltiples
Objetivo de aprendizaje
- Reconocer las moléculas que probablemente tengan enlaces covalentes múltiples.
En muchas moléculas, la regla del octeto no se cumpliría si cada par de átomos enlazados comparte dos electrones. Consideremos el dióxido de carbono (CO2). Si cada átomo de oxígeno comparte un electrón con el átomo de carbono, obtenemos lo siguiente:
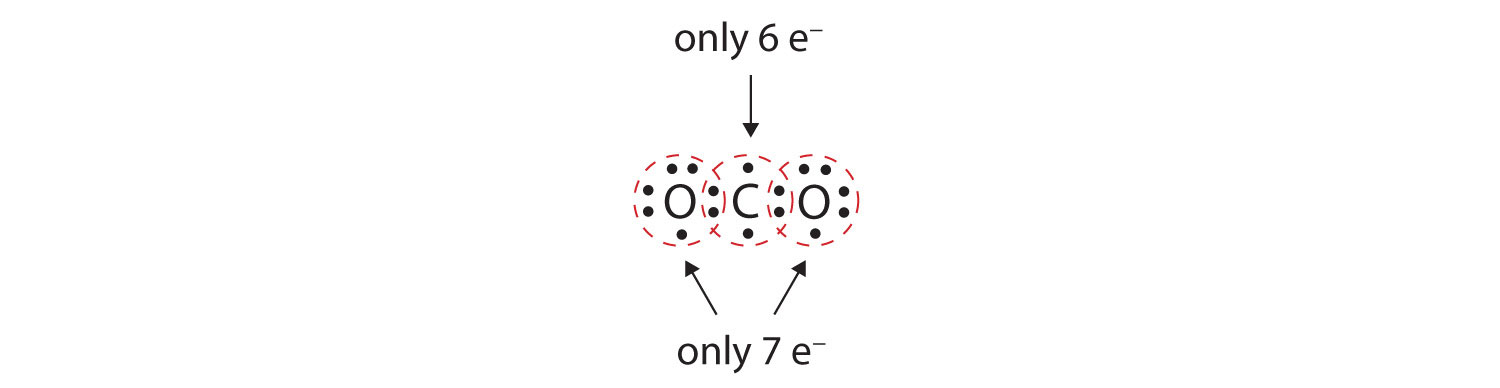
Esto no da al átomo de carbono un octeto completo; sólo encontrará seis electrones en su capa de valencia. Además, cada átomo de oxígeno sólo tiene siete electrones en su capa de valencia. Por último, ningún átomo realiza el número de enlaces que suele formar (Figura 4.2 «¿Cuántos enlaces covalentes se forman?»). Esta disposición de los electrones compartidos dista mucho de ser satisfactoria.
A veces hay que compartir más de un par de electrones entre dos átomos para que ambos tengan un octeto. En el dióxido de carbono, un segundo electrón de cada átomo de oxígeno se comparte también con el átomo de carbono central, y el átomo de carbono comparte un electrón más con cada átomo de oxígeno:
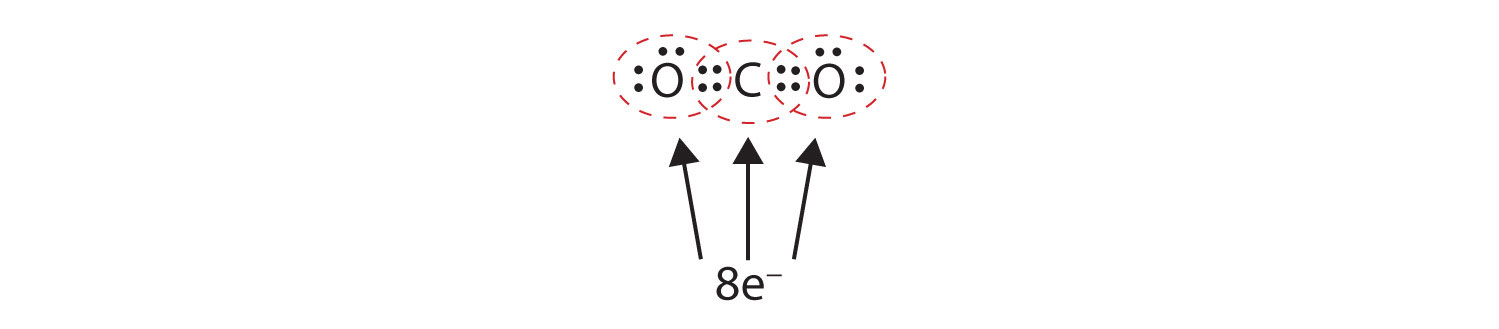
En esta disposición, el átomo de carbono comparte cuatro electrones (dos pares) con el átomo de oxígeno de la izquierda y cuatro electrones con el átomo de oxígeno de la derecha. Ahora hay ocho electrones alrededor de cada átomo. Dos pares de electrones compartidos entre dos átomos forman un enlace dobleDos pares de electrones compartidos por dos átomos en una molécula. entre los átomos, que se representa con un doble guión:
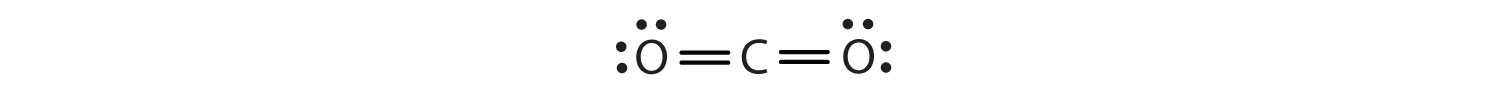
Algunas moléculas contienen enlaces triplesTres pares de electrones compartidos por dos átomos en una molécula., enlaces covalentes en los que tres pares de electrones son compartidos por dos átomos. Un compuesto simple que tiene un triple enlace es el acetileno (C2H2), cuyo diagrama de Lewis es el siguiente:

Ejemplo 5
Dibuja el diagrama de Lewis para cada molécula.
- N2
- CH2O (El átomo de carbono es el átomo central.)
Solución
-
El enlace entre los dos átomos de nitrógeno es un enlace triple. El diagrama de Lewis para el N2 es el siguiente:

-
En el CH2O, el átomo central está rodeado por dos tipos diferentes de átomos. El diagrama de Lewis que rellena la capa de electrones de valencia de cada átomo es el siguiente:

Nota
Una aplicación del CH2O, también llamado formaldehído, es la conservación de especímenes biológicos. Las soluciones acuosas de CH2O se denominan formalina y tienen un olor penetrante y característico (acre).
Ejercicio de habilidad
-
O2
-
C2H4
Dibuja el diagrama de Lewis para cada molécula.
Ejercicio de repaso de conceptos
-
¿Cuál es una pista de que una molécula tiene un enlace múltiple?
Respuesta
-
Si los enlaces simples entre todos los átomos no dan a todos los átomos (excepto al hidrógeno) un octeto, puede haber enlaces covalentes múltiples.
Contenido clave
- Algunas moléculas deben tener múltiples enlaces covalentes entre los átomos para satisfacer la regla del octeto.
Ejercicios
-
Cada molécula contiene múltiples enlaces. Dibuja el diagrama de Lewis para cada una. El primer elemento es el átomo central.
- CS2
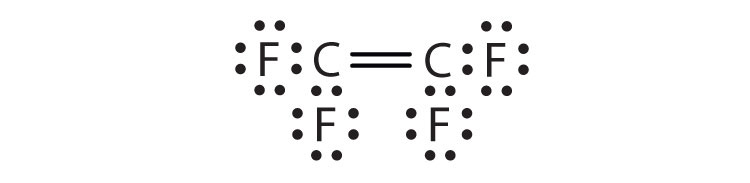
- C2F4
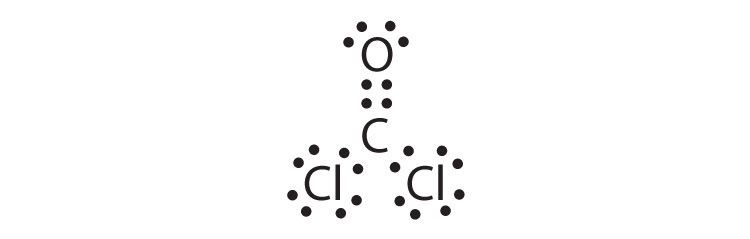
- COCl2
-
Cada molécula contiene dobles enlaces. Dibuja el diagrama de Lewis para cada una. Asuma que el primer elemento es el átomo central, a menos que se indique lo contrario.
- N2
- HCN (El átomo de carbono es el átomo central.)
- POCl (El átomo de fósforo es el átomo central.)
-
Explique por qué los átomos de hidrógeno no forman dobles enlaces.
-
¿Por qué es incorrecto dibujar un doble enlace en el diagrama de Lewis para el MgO?
Respuestas
-
-
-
El hidrógeno puede aceptar sólo un electrón más; los enlaces múltiples requieren que se comparta más de un par de electrones.