Introduction
L’infection à mycoplasma pneumoniae affecte la peau et les muqueuses dans jusqu’à 25% des cas,1 et peut provoquer un érythème polymorphe (EM)2 et un syndrome de Stevens-Johnson/nécrolyse épidermique toxique (SJS/TEN).3 Le chevauchement clinique entre ces affections, qui a donné lieu à un débat de longue date dans la littérature,4-9 rend le diagnostic difficile dans certains cas.10,11 Une revue approfondie de 202 cas d’EM, de SJS et de mucosite sans rash induits par M pneumoniae a été publiée récemment.12 Dans leurs conclusions, les auteurs ont proposé une nouvelle entité qu’ils ont appelée rash et mucosite induits par Mycoplasma. Nous présentons un cas que nous avons trouvé difficile à classer et qui correspond à la nouvelle entité décrite. Comme suggéré par ces auteurs, nous pensons que cette entité pourrait être utile dans le diagnostic et le traitement de ces cas dans la pratique quotidienne.
Description du cas
La patiente, une jeune fille de 16 ans auparavant en bonne santé, a présenté une histoire de 7 jours de fièvre de 38,5°C, d’odynophagie, de toux et de sifflement. On lui a diagnostiqué une bronchite aiguë et elle a été traitée avec du budésonide inhalé et de l’ibuprofène. Elle a ensuite été consultée pour l’apparition rapide de lésions sur la peau et les muqueuses. Elle n’avait pas reçu d’autres médicaments et ne rapportait pas d’antécédents d’infection herpétique.
L’examen physique a révélé une stomatite intense avec ulcères confluents et croûtes affectant toutes les lèvres et les muqueuses buccales, palatines et pharyngées, associée à une hyperémie conjonctivale bilatérale avec écoulement. De nombreuses plaques érythémateuses irrégulières, œdémateuses avec des vésicules centrales et un halo érythémateux, leur donnant l’aspect de lésions cibles atypiques, étaient observées sur la peau du visage, du tronc, des membres, du périnée et des muqueuses génitales (Fig. 1). Les paumes et les plantes des pieds n’étaient pas touchées. Aucun exsudat amygdalien n’a été observé et il n’y avait pas de ganglions lymphatiques palpables dans la tête et le cou. L’auscultation de la poitrine a révélé des crépitations. L’examen abdominal était normal.
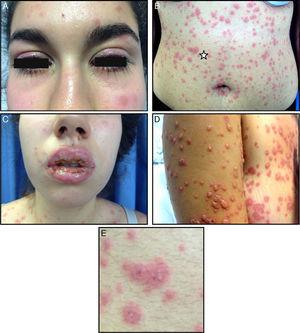
A, Hyperémie conjonctivale bilatérale avec écoulement. B, Papules érythémateuses irrégulières, œdémateuses, avec vésicules centrales et halo érythémateux, formant des lésions cibles atypiques palpables, répandues sur le visage, le tronc, les membres et les muqueuses périnéales et génitales, sans atteinte des paumes et des plantes. C, Érosions, ulcères confluents et croûtes sur les lèvres et les muqueuses. D, évolution des lésions cutanées 2 jours après l’apparition de l’éruption. E, Détail des lésions cibles atypiques (correspond à la zone de l’étoile sur l’image B).
Le patient a été admis avec une suspicion clinique d’érythème polymorphe majeur secondaire à une infection à M pneumoniae. Les analyses de laboratoire étaient les suivantes : Protéine C-réactive, 21mg/dL ; titre anti-streptolysine O, 222U/mL ; numération des globules blancs, 22850 cellules/μL (82,3% de neutrophiles, sans lymphocytes atypiques) ; anticorps IgM de M pneumoniae, 292U ; sérologie du virus de l’herpès simplex, du virus d’Epstein-Barr et du cytomégalovirus, négative. La radiographie du thorax a montré un infiltrat de pneumonie dans le lobe supérieur droit (Fig. 2). La biopsie cutanée a révélé une lésion d’interface vacuolaire intense, des kératinocytes nécrotiques isolés et une séparation dermoépidermique étendue, sans nécrose épithéliale (figure 3).

Infiltrat de pneumonie dans le lobe supérieur droit (flèche).

Histopathologie : lésion d’interface vacuolaire étendue, kératinocytes nécrotiques isolés et séparation dermoépidermique étendue sans nécrose épithéliale. Hématoxyline-éosine, grossissement originalx10.
Le traitement a été débuté par de la méthylprednisolone intraveineuse, 1mg/kg/j, de la clarithromycine et de l’acyclovir. L’acyclovir a été retiré après réception des résultats de la sérologie. Des corticostéroïdes et des antibiotiques topiques ont été appliqués sur les muqueuses conjonctives et buccales, et un soutien liquidien et une analgésie ont été administrés jusqu’à ce que l’état du patient s’améliore.
Les lésions cutanées ont augmenté pendant 3 jours supplémentaires, touchant jusqu’à 20% de la surface corporelle, et ont pris un aspect croûteux et purpurique, les lésions étant observées simultanément à des stades distincts. Certaines lésions ont développé des cloques flasques qui ne se sont pas coalescées ni rompues. Le signe de Nikolski était négatif et il n’y avait pas d’exfoliation. Après 10 jours, l’état de la patiente s’était suffisamment amélioré pour qu’elle puisse sortir de l’hôpital avec seulement une hyperpigmentation résiduelle.
Discussion
M pneumoniae est impliqué dans jusqu’à 40% des pneumonies atypiques, en particulier chez les enfants et les jeunes adultes1. Il provoque des modifications de la peau chez jusqu’à un quart des patients, l’éruption cutanée non spécifique étant la plus fréquente, bien que l’on observe également des stomatites, des ulcères vaginaux, un pityriasis rosea, une maladie de Kawasaki, une vascularite leucocytoclasique, une dermatose pustuleuse sous-cornée, un syndrome de Sweet, un purpura thrombocytopénique thrombotique, une maladie de Raynaud, un purpura de Henoch-Schonlein et d’autres affections10. L’incidence exacte de l’EM chez les enfants et les jeunes adultes qui développent une infection due à M pneumoniae et à d’autres espèces de Mycoplasma13 est inconnue, tandis que celle du SJS a été estimée à environ 5 %, bien que ces données puissent être affectées par une nomenclature confuse.10,11 En raison du chevauchement clinique entre ces syndromes, l’EM, le SJS et le TEN ont été considérés pendant des décennies comme faisant partie d’un spectre. Cependant, l’étude Severe Cutaneous Adverse Reactions a conclu que l’EM et le SJS/TEN pouvaient être séparés en deux groupes distincts sur la base de leurs caractéristiques cliniques.5 Une étude multicentrique ultérieure a confirmé la validité de cette classification et sa corrélation avec les facteurs étiologiques et pronostiques,8 et les deux affections sont désormais considérées comme des entités distinctes.9 Il était difficile de classer avec certitude notre patient dans l’un de ces groupes, car l’origine infectieuse, l’apparition aiguë, la morphologie cible des lésions et l’évolution clinique favorable plaidaient en faveur d’un diagnostic d’EM, tandis que les symptômes généraux, la distribution centrale avec propagation centripète et la grande surface affectée par les lésions, ainsi que l’atteinte intense de trois muqueuses, étaient compatibles avec le SJS. Les différences entre ces affections sont résumées dans le tableau 1.
Différences entre l’éruption et la mucosité induites par les mycoplasmes, l’érythème polymorphe et le spectre du syndrome de Stevens-Johnson/nécrolyse épidermique toxique.
| Epidémiologie | Etiologie | Lésion de base | Distribution | Extension | Prognostic | Traitement | |
|---|---|---|---|---|---|---|---|
| M pneumoniae-.éruption et mucosite induites | Age moyen=12 ans Prodrome de l’infection des voies respiratoires |
M pneumoniae | Vésicules, cloques, mucosite (≥2 mucosas) | Variable Prédominance acrale |
Variable | Favorable 8% de taux de récidive. |
Macrolides |
| EM | Age moyen=25 ans8 Historique de l’infection par le HSV |
46 % HSV8 (5 % lié à un médicament)liés aux médicaments) | Lésions cibles typiques/atypiques élevées | Acral | 10% | Favorable, Taux de récidive de 30% | Symptomatique Envisager la suppression du HSV |
| Spectre du SJS | Age moyen=45 ans8 Exposition médicamenteuse |
45% liée aux médicaments8 Autres maladies (maladie du collagène, VIH, tumeurs, 15% HSV) |
Lésions cibles plates et atypiques Bulles survenant sur des macules et des plaques |
Tronc | 10% | 4%a | Retrait des médicaments responsables Mesures de soutien |
| SJS/TEN | 10-30% | 7%a | |||||
| TEN | >30% | 40%a |
Abréviations : EM, érythème polymorphe ; HSV, virus de l’herpès simplex ; SJS, syndrome de Stevens-Johnson ; TEN, nécrolyse épidermique toxique.
Mortalité.
Dans une étude récemment publiée par Canavan et coll.,12 les auteurs ont examiné les caractéristiques épidémiologiques et cliniques des 202 cas publiés d’éruption cutanéo-muqueuse associée à M pneumoniae. Leurs résultats, que nous résumons ici, les ont amenés à proposer la création d’une nouvelle entité distincte du spectre de l’EM. Leurs patients étaient jeunes (âge moyen, 11,9 ans), avec des symptômes prodromiques consistant en une toux, un malaise et une fièvre la semaine précédant l’éruption cutanée. La répartition des lésions était acrale chez 46 %, étendue chez 31 % et sur le tronc chez 23 % ; la morphologie des lésions était variable, les formes les plus courantes étant les vésicules et les cloques (77 %) et les lésions cibles (48 %). L’atteinte des muqueuses était intense et était fondamentale pour le diagnostic. La plus fréquente était la mucosite buccale, qui est survenue dans 94 % des cas, suivie par la conjonctivite purulente bilatérale (82 %) et l’atteinte de la muqueuse urogénitale (63 %). Le nombre moyen de muqueuses touchées était de 2,5. La maladie a eu une évolution bénigne chez la majorité des patients, avec une guérison complète chez 81 % d’entre eux. Seuls 4 % des patients ont dû être pris en charge dans une unité de soins intensifs selon cet article de synthèse, et la mortalité estimée était de 3 %. Les patients ont été principalement traités par antibiotiques (80 %) et corticostéroïdes systémiques (35 %) ; une minorité (8 %) a reçu des immunoglobulines intraveineuses. Les taux de récidive n’étaient pas particulièrement élevés (8 %). Ces auteurs ont conclu que l’étiologie, la morphologie des lésions et l’évolution clinique, ainsi que le traitement potentiellement distinct de ces patients, justifiaient la désignation d’une entité clinique distincte du SE classique associé au virus de l’herpès simplex et du SJS/TEN induit par les médicaments. Ils ont proposé le terme d’éruption et de mucosite induites par les mycoplasmes (MIRM). Cette nouvelle classification est particulièrement utile dans les cas de mucosite étendue due à M pneumoniae sans éruption cutanée (MIRM sine rash pour ces auteurs), qui ne s’adaptaient pas aux classifications précédentes et qui pourraient être dus à certaines souches de M pneumoniae.
L’hypothèse étiologique et pathogénique est que la MIRM est causée par la production d’immunoglobulines par des clones de cellules B en prolifération, et que cela conduit à un dépôt de complexes immuns dans la peau et à l’activation du complément. Ceci différencie également l’affection de l’EM et du SJS/TEN, qui sont causés par une réaction d’hypersensibilité retardée de type IV et par une cytotoxicité médiée par le Fas-ligand.
Conclusion
Notre cas est compatible avec ceux décrits par Canavan et al. et sa classification dans cette nouvelle entité permettrait de dissiper les doutes diagnostiques qui persistaient après l’application des critères de l’étude Severe Cutaneous Adverse Reactions. Nous serions donc favorables à l’acceptation de la proposition de ces auteurs.
La classification des maladies cutanéo-muqueuses graves secondaires à des infections et à des médicaments est complexe en raison du chevauchement clinique entre elles. Après des décennies de controverse, l’EM a été séparée du SJS/TEN en 2002.8 De même, en 2013, la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) a été séparée du spectre du SJS14. L’acceptation du DRESS en tant qu’entité indépendante pourrait faciliter un diagnostic correct et un traitement plus adéquat de nos patients.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette recherche.
Confidentialité des données
Les auteurs déclarent avoir suivi le règlement de leur hôpital concernant la publication des informations sur les patients.
Droit à la vie privée et consentement éclairé
Les auteurs déclarent qu’aucune donnée privée sur les patients n’est divulguée dans cet article.
Conflits d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.