INTRODUCTION
Selon Torrent-Guasp et d’autres auteurs,1-6 le myocarde ventriculaire est constitué d’une bande musculaire continue qui s’étend de la racine de l’artère pulmonaire à la racine aortique, formant une structure hélicoïdale à 2 spirales et délimitant les 2 cavités ventriculaires. Cette bande myocardique serait composée de la « boucle basale » et de la « boucle apicale ». La boucle basale est à prédominance horizontale et se divise en segments gauche et droit ; la boucle apicale est à prédominance verticale et se compose du segment descendant et du segment ascendant (figure 1). L’éjection serait produite par la contraction successive des segments basal droit et basal gauche, ce qui entraîne un rétrécissement de la base du cœur, suivi de la contraction du segment apical descendant. Ceci, à son tour, produit un raccourcissement des dimensions longitudinales du cœur, rapprochant la base de l’apex. Le remplissage ventriculaire commencerait par la contraction du segment apical ascendant, accompagnée d’un allongement longitudinal et suivie d’une relaxation des parois ventriculaires. Pendant le cycle cardiaque, l’apex reste stationnaire, tandis que la base se déplace vers le bas, cause principale du raccourcissement longitudinal et de l’éjection du sang, suivi d’un autre mouvement ascendant auquel on attribue l’aspiration du sang de l’oreillette gauche.7-9
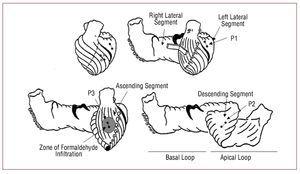
Figure 1. Diagrammes montrant les segments de la bande myocardique (Torrent-Guasp) et la position des paires de cristaux implantés dans le myocarde, représentés par de petits cercles reliés par une ligne. Dans le schéma supérieur gauche, les cristaux correspondant au P2 sous-endocardique (dans le segment descendant de la boucle apicale) sont représentés par des cercles ouverts.
Dans la doctrine classique, le remplissage du ventricule gauche commence par la relaxation ventriculaire, un processus actif consommateur d’énergie qui réduit la pression intraventriculaire à un niveau inférieur à celui correspondant à l’oreillette gauche. Le croisement des pressions provoque l’ouverture de la valve mitrale et l’initiation d’un remplissage rapide précoce. Les facteurs déterminant ce mécanisme sont considérés comme étant la récupération élastique, qui implique différents composants tels que le contenu en élastine du collagène de la matrice extracellulaire10, ou la protéine titine, qui redonne de la force au sarcomère pour sa récupération après la déformation produite pendant la systole11, et la relaxation de la paroi myocardique. Du point de vue hémodynamique, cette dernière implique 80 % du volume de remplissage et est produite avec une contribution quasi nulle de la part des facteurs auriculaires.10
Ce qui est difficile à imaginer et à démontrer, c’est le fait que la phase de relaxation isovolumique et le remplissage rapide qui s’ensuit sont une conséquence de la contraction de la dernière portion de la bande myocardique. Cela expliquerait pourtant pourquoi chaque fois qu’une dysfonction systolique se développe, elle s’accompagne d’une dysfonction diastolique, pourquoi l’indice T (la constante de temps de la chute de pression pendant la phase de contraction isovolumique) dépend de la contractilité et est amélioré par l’isoprotérénol12, et même pourquoi la dysfonction diastolique avec une fonction systolique normale ou « préservée » est une entité dont la signification, l’identification et le traitement restent flous13-17.
Les études expérimentales que nous présentons ici ont été réalisées dans le but de déterminer les mécanismes myocardiques impliqués dans le flux transmitral diastolique précoce. Plus précisément, nous voulions savoir si la phase de remplissage ventriculaire rapide est un processus de relaxation ou de contraction.18 Pour répondre à cette question, nous allons examiner si la contraction du segment ascendant de la boucle apicale coïncide temporellement avec la phase dite de relaxation isovolumique du ventricule gauche et si l’induction d’une hypokinésie ou d’une akinésie limitée à ce segment a un effet négatif sur le flux transmitral précoce, la vitesse de la chute de pression intraventriculaire pendant la phase isovolumique et la pression minimale atteinte dans le ventricule gauche.
METHODES
Nous avons étudié 12 porcs des deux sexes d’un poids moyen de 28,2 (5,1) kg. Ils avaient été élevés dans l’unité vétérinaire du centre de recherche de notre hôpital. Les expériences ont été réalisées conformément aux directives espagnoles et européennes pour la » Protection des animaux utilisés à des fins expérimentales et à d’autres fins scientifiques » (décret royal 223/1988 et décret royal 1201/2005). Les procédures chirurgicales ont été réalisées par des investigateurs qui possédaient le certificat européen de formation en expérimentation animale (décret royal 1201/2005).
Préparation des expériences
Le jour de l’expérience, les animaux sont préanesthésiés et endormis dans leur box par injection intramusculaire de midazolam (0,5 mg/kg de poids corporel) et de kétamine (10 mg/kg de poids corporel). L’anesthésie est induite dans la salle d’opération expérimentale par voie intraveineuse (thiopental, 10 mg/kg de poids corporel), puis une intubation endotrachéale et un cathétérisme de la veine jugulaire externe sont effectués. L’anesthésie est maintenue avec du sévoflurane (2,5 %) dans un mélange de 40 % d’oxygène et de 60 % de protoxyde d’azote, délivré au moyen d’un ventilateur (Temel VT3, Espagne). L’analgésie et la relaxation sont initiées avec du bromure de vécuronium (0,08 mg/kg de poids corporel) et du chlorhydrate de morphine (0,7 mg/kg de poids corporel) et sont maintenues avec du bromure de vécuronium (0,08 mg/kg de poids corporel) et 20 mg de chlorhydrate de morphine dans 50 ml de sérum dans une pompe à perfusion à un débit de 12 ml/h. Une sternotomie médiane est pratiquée, suivie d’une péricardiectomie. La ventilation mécanique est réglée à un rythme compris entre 16 et 20 respirations par minute et à un débit gazeux d’environ 5 L/min, en fonction des oxymétries sanguines. L’électrocardiogramme périphérique, le pH du sang, les gaz du sang, l’hématocrite et la température rectale sont surveillés pendant toute l’expérience. La température est maintenue à l’aide d’une couverture électrique.
Fonctionnement segmentaire
Trois paires de microcristaux ultrasoniques (Biopac Systems, Santa Barbara, Californie, USA) sont implantées dans le myocarde : une paire dans le mésocarde (à une profondeur d’environ 4 à 5 mm) de la face latérale du ventricule gauche correspondant à la boucle basale, segment latéral gauche (P1), en suivant la direction de l’axe longitudinal du cœur ; une autre paire dans le sous-endocarde de la face antérieure du tiers moyen du ventricule gauche, entre la première et la deuxième branche diagonale de l’artère descendante antérieure et tangente à celle-ci, zone correspondant au segment descendant de la boucle apicale (P2) ; et, enfin, une autre paire dans le sous-épicarde (à une profondeur de 1 à 2 mm) de la face antérieure du ventricule gauche, entre la première et la deuxième branche diagonale de l’artère descendante antérieure et parallèlement à l’artère descendante antérieure vers la racine aortique, dans une zone correspondant au segment ascendant de la boucle apicale (P3) (Figure 1). Les paires de microcristaux sont alignées en suivant la direction des fibres musculaires de la zone dans laquelle elles sont placées. Ils sont séparés d’environ 2 cm. Les paires P2 sont ancrées dans le sous-endocarde par une ponction transseptale, atteignant la cavité ventriculaire et se retirant pour les déposer dans le sous-endocarde, formant une croix avec les paires P3 dans le sous-épicarde. Les paires de cristaux nous permettent de connaître le déplacement relatif des 2 points du myocarde sur lesquels ils sont fixés et, ainsi, les propriétés dynamiques du segment contenu entre eux. L’acquisition des courbes de contractilité régionale du myocarde est réalisée avec le système de mesure ultrasonique numérique Sonometrics Corporation (London, Ontario, Canada).
Pressions intracavitaires
Un cathéter est inséré à travers la paroi libre du ventricule gauche pour surveiller la pression ventriculaire gauche et un autre est inséré à travers l’auricule pour mesurer la pression auriculaire gauche ; les deux cathéters sont reliés à des transducteurs de pression (Transpac IV, USA).
Débit aortique
La racine aortique est disséquée et un débitmètre électromagnétique est placé (Transonic Systems, New York, États-Unis).
Débit transmitral
Un échocardiogramme Doppler est réalisé (Interspec XL Doppler, USA) avec une sonde de 5 MHz, directement au-dessus de l’épicarde, pour enregistrer le débit transmitral à partir d’une vue apicale à quatre chambres, d’abord dans les conditions de base, puis après injection de formaldéhyde dilué dans la paroi myocardique.
Induction de l’akinésie segmentaire
Ceci implique des injections de formaldéhyde19 dilué à 2,5 %, à l’aide d’une aiguille atraumatique, dans le sous-épicarde (à une profondeur de 1 à 2 mm) du segment ascendant de la boucle apicale, où se trouvent les paires de cristaux P2. Un maximum de 0,8 ml de la dilution indiquée est injecté, réparti en 3 et 4 injections. Après chaque injection, l’effet produit sur la fraction de raccourcissement du segment est surveillé jusqu’à l’obtention d’une akinésie ou d’une dyskinésie dans le segment donné.
Collecte des données
Les enregistrements correspondant à : ECG (I, II ou III), à la pression ventriculaire gauche en mm Hg, à la pression auriculaire gauche en mm Hg, au débit aortique (mL/min) et aux données sonométriques des 3 segments de bande myocardique indiqués sont numérisés et stockés dans une mémoire électronique (BIOPAC Systems Inc, Santa Barbara, Californie, États-Unis). Les courbes de vitesse du flux transmitral et les valeurs obtenues par échocardiographie Doppler (m/s) sont stockées séparément.
Une fois les expériences terminées, les animaux sont sacrifiés sous anesthésie au moyen d’une injection intraveineuse de chlorure de potassium. Après retrait de la structure anatomique (le cœur), le site anatomique des 3 paires de cristaux est vérifié, la paroi ventriculaire gauche antérieure est disséquée, en suivant le trajet de l’artère interventriculaire, et la profondeur à laquelle chaque cristal est implanté est vérifiée, ainsi que la région du muscle infiltrée avec du formaldéhyde.
Paramètres analysés
Dans l’échocardiogramme Doppler, nous étudions les vitesses maximales du flux transmitral au début (E) et à la fin (A) de la diastole et le rapport E/A. Les courbes de pression intracavitaire fournissent la pression systolique maximale du ventricule gauche, la pression minimale du ventricule gauche, la pression end-diastolique du ventricule gauche (PEDG), le temps écoulé depuis la fermeture de la valve aortique jusqu’à ce que la pression intraventriculaire dépasse la pression end-diastolique de 10 mm Hg, ce qui correspond au temps de relaxation isovolumique12 ; à ce stade, nous pouvons être sûrs qu’il s’agit de la phase isovolumique avec la valve mitrale encore fermée. Les courbes de fonction segmentaire révèlent la fraction de raccourcissement, et les courbes de débit aortique montrent le débit aortique moyen et la relation temporelle entre la fin de la contraction de chacun des trois segments (P1, P2 et P3) et la suspension du débit aortique (temps fermeture aortique-contraction P1, P2, P3). Tous ces paramètres sont analysés avant et après l’injection de formaldéhyde dans le segment ascendant. La fraction de raccourcissement est mesurée après chaque injection de formaldéhyde jusqu’à ce qu’un changement adéquat dans le segment injecté soit vérifié.
Analyse des résultats
Les variables étudiées sont continues et les résultats sont exprimés en moyenne plus ou moins l’écart-type. Les changements des variables après le blocage par le formaldéhyde par rapport aux conditions de base ont été étudiés. La comparaison des moyennes a été effectuée à l’aide du test t de Student pour les échantillons appariés ou du test non paramétrique de Mann-Whitney pour les données qui ne présentaient pas une distribution normale. Une valeur P inférieure à 0,05 a été considérée comme significative. Le progiciel statistique SPSS (version 9.0) a été utilisé.
RÉSULTATS
Modifications hémodynamiques (tableau 1)
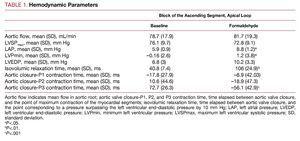
L’injection de formaldéhyde prolonge significativement le temps nécessaire pour dépasser de 10 mm Hg la pression end-diastolique du ventricule gauche après fermeture de la valve aortique, augmente la pression minimale du ventricule gauche qui est atteinte au début de la diastole, passant de pressions négatives à des pressions positives, augmente – bien que de façon peu significative – la PEDGV et augmente significativement la pression auriculaire moyenne. Il n’y a pas de changements significatifs immédiats dans le flux aortique ou dans la pression ventriculaire gauche pendant la systole (figure 2).
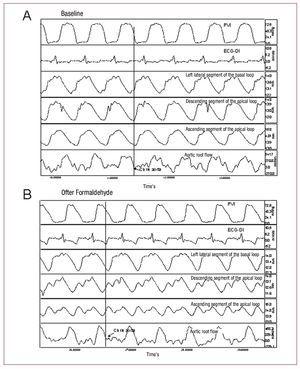
Figure 2. Enregistrement de la pression ventriculaire gauche (PVI) ; électrocardiogramme (ECG-DI) ; contractilité segmentaire dans le segment latéral gauche de la boucle basale, le segment descendant de la boucle apicale et le segment ascendant de la boucle apicale ; et débit de la racine aortique dans les conditions de base (A) et après injection de formaldéhyde (B). Les flèches indiquent les points correspondant à la fermeture de la valve aortique. Les modifications induites par l’injection de formaldéhyde sont décrites dans le texte.
Fin de la contraction myocardique et début de la diastole
Afin de déterminer le début de la phase de relaxation isovolumique, nous avons identifié le moment où l’éjection de sang cesse dans la courbe de débit aortique et la phase de contraction segmentaire dans les courbes sonométriques correspondantes (figure 2).
Dans toutes les expériences, le segment ascendant (P3) était en contraction après l’arrêt du flux aortique et la fermeture de la valve aortique. La contraction du dernier segment myocardique s’est terminée dans un temps moyen de 72,7 (26,3) ms après la fermeture de la valve aortique, coïncidant avec la phase dite de relaxation isovolumique au début de la diastole (figure 2), tandis que le segment descendant (P2) a atteint une contraction maximale 10,6 (44,6) ms après la fermeture de la valve aortique, et la fin de la contraction du segment P1 (boucle basale) a précédé la fermeture de la valve aortique (tableau 1).
Débit Transmitral
Le tableau 2 montre l’effet produit dans la fraction de raccourcissement du segment surveillé par l’injection de formaldéhyde dans le segment ascendant de la boucle apicale. On observe une diminution jusqu’à des niveaux de dyskinésie (selon le protocole) dans le segment injecté (P3, segment ascendant) et une hypokinésie dans le segment voisin, le segment descendant (P2) de la boucle apicale. Les zones correspondant au segment latéral gauche de la boucle basale (P1) ne sont pas altérées. Parallèlement, le flux transmitral est affecté, avec des modifications des taux de remplissage ventriculaire en diastole précoce et du rapport E/A ; l’onde E diminue alors que l’onde A augmente, le rapport E/A étant significativement réduit (P
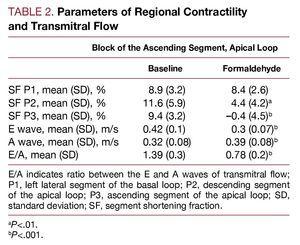
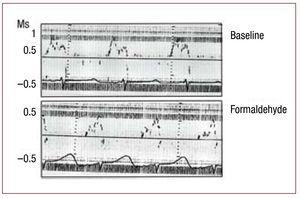
Figure 3. Modifications immédiates du débit transmitral, mesurées par échocardiographie Doppler, secondaires à une infiltration avec du formaldéhyde à 2,5% dans le segment ascendant de l’anse apicale. Figure corrigée pour la reproduction.
DISCUSSION
Lorsque le ventricule cesse d’éjecter le sang, la systole se termine et la diastole commence. A partir de ce moment, et jusqu’à l’ouverture de la valve mitrale, il existe une période de temps pendant laquelle les deux valves sont fermées, que l’on appelle la phase de relaxation isovolumique. Pendant cette phase, la pression intraventriculaire diminue à un rythme constant12 et entraîne des gradients de pression transmurale et transvalvulaire vers l’intérieur de la chambre. Il se produit un effet de succion, auquel on attribue immédiatement la rapidité du remplissage ventriculaire précoce et dont la perte totale ou partielle est une cause de dysfonction diastolique du ventricule gauche, substrat physiopathologique de l’insuffisance cardiaque à fonction systolique préservée.
En pratique clinique,16,20,21 le diagnostic d’insuffisance cardiaque due à une dysfonction diastolique dépend de 3 conditions : la présence de signes ou de symptômes d’insuffisance cardiaque, une fraction d’éjection ventriculaire gauche normale ou légèrement diminuée et une augmentation de la pression de remplissage du ventricule gauche. Ce dernier facteur a un impact et peut être mesuré dans la courbe de remplissage du ventricule gauche de l’échocardiogramme Doppler, dans la prolongation de la période de relaxation isovolumique, dans la diminution de la vélocité diastolique précoce (E), dans la prolongation du temps de décélération, dans l’augmentation de la vélocité diastolique finale (A) et dans la réduction du rapport E/A.
Le remplissage ventriculaire, qui identifie le temps diastolique, était attribué à la contraction auriculaire jusqu’en 1954.3,4 Il est maintenant admis que le ventricule gauche participe activement à la force d’aspiration dont nous avons parlé plus haut. Il s’agit d’un processus actif22,23 qui consomme de l’énergie et implique des échanges de Ca2+. Un certain nombre d’auteurs considèrent que la diastole est une conséquence de l’allongement des fibres myocardiques des parois d’une chambre fermée. Il s’agirait d’un phénomène lié à la relaxation musculaire (séparation des filaments de myosine) et à la récupération élastique des fibres, dans laquelle intervient l’élastine contenue dans un réseau de collagène qui constitue le tissu conjonctif extrafibrillaire, ainsi que la protéine titine comme élément de la récupération du sarcomère déformé pendant la systole.10,11 L’activation mécanique ventriculaire pendant la diastole est hétérogène, avec des gradients de relaxation sous-endocardique-sous-sépicardique au début de la diastole.22,24,25
Dans la théorie de Torrent-Guasp, c’est un phénomène systolique lié à la contraction musculaire.23,26 L’éjection du sang est une conséquence de la contraction du segment descendant de la boucle apicale ; sa contraction « visse » la base sur l’apex, rapprochant les 2 parties. Le segment suivant et final de la bande musculaire est le segment ascendant de l’anse apicale, qui recouvre le segment descendant, formant l’épicarde de la face antérieure jusqu’à la racine aortique, et qui a été « étiré et enroulé » par la contraction du segment précédent. Lorsqu’il se contracte, le segment ascendant effectue un mouvement qui « dévisse » la base, l’éloignant de l’apex, augmentant l’axe longitudinal du cœur et produisant une aspiration comme celle qui se produirait à l’intérieur d’un cylindre qui s’éloigne de son piston, dynamique qui a été observée chez l’homme sur des images de résonance magnétique27.
Dans cette étude, nous avons apporté des données qui démontrent que la force de succion produite pendant la phase de relaxation isovolumique dépend de la contraction car elle est produite pendant la phase de contraction segmentaire et, de plus, que sa fonctionnalité est fortement liée à la contraction du segment ascendant de la boucle apicale, spécifiquement :
1. Nous avons montré que, au début et pendant la phase de relaxation isovolumique du ventricule gauche, le segment ascendant de la boucle apicale se contracte.
2. L’infiltration du segment ascendant de la boucle apicale avec du formaldéhyde dilué affecte directement la capacité à réduire la pression intraventriculaire ou, en d’autres termes, la force d’aspiration. Cet aspect a été démontré par l’allongement du temps nécessaire à la chute de la pression intraventriculaire à 10 mm Hg au-dessus de la pression end-diastolique, un niveau qui nous permet de nous assurer que la valve mitrale est toujours fermée et que la vitesse inférieure (c’est-à-dire le temps écoulé) de la chute de pression se fait dans une chambre fermée (isovolumique). Cela a également été démontré par la pression intraventriculaire minimale plus faible atteinte en début de diastole, qui est significativement affectée lorsque nous infiltrons ledit segment ascendant.
3 En conséquence d’une vitesse de chute plus faible et d’une diminution finale moins marquée de la pression intraventriculaire pendant la phase isovolumique, l’effet de succion est moindre et le taux de remplissage ventriculaire diminue pendant la diastole précoce, augmentant en compensation pendant la diastole terminale, en conséquence d’une contraction de l’oreillette gauche plus « pleine ». Ceci a été démontré par les changements des valeurs de E, A, et du rapport E/A, ainsi que par l’augmentation progressive de la pression auriculaire commençant au début de la diastole.
Limites de l’étude
L’utilisation des cristaux ultrasoniques est appropriée si l’on suppose que la structure du myocarde est organisée partiellement ou totalement en bande et que l’on a implanté les cristaux ultrasoniques sur la même ligne qui marque la direction du mouvement des fibres. Cette méthode est incapable d’isoler la fonction d’un seul segment, car il fait partie du même continuum que les autres. Ainsi, l’altération d’un segment donné modifierait la contraction de toute la bande, comme cela se produit dans notre modèle, dans lequel l’injection dans le segment ascendant modifie également de manière significative la contraction des fibres contenues dans P2, identifiées comme appartenant au segment descendant, voisin du segment injecté.
Pour l’identification des segments et la direction de leurs fibres, ainsi que la confirmation post-mortem dans les spécimens anatomiques, nous avons été conseillés par le Dr Torrent-Guasp. Les fibres sous-endocardiques du segment descendant dans la zone de la face antérieure du ventricule gauche traversent le mésocarde à une certaine profondeur, se croisant perpendiculairement avec celles du segment ascendant28, circonstance que nous avons confirmée sur les pièces anatomiques. Pour cette raison, les cristaux ancrés dans le sous-endocarde suivaient une direction que la paire implantée dans l’épicarde correspondant (segment ascendant) croisait perpendiculairement.
L’atteinte musculaire secondaire à l’injection de formaldéhyde dilué est difficile à standardiser et, bien sûr, elle affecte toutes les propriétés actives et passives de la fibre, réduisant la contraction, la relaxation et l’élasticité à leurs limites les plus basses. On a essayé de minimiser les changements produits par le formaldéhyde, en limitant la quantité et le nombre d’injections dans toutes les expériences, et en contrôlant l’effet en fonction de l’altération de la contractilité du segment injecté et en vérifiant le changement du flux transmitral. Pour de nombreux chercheurs, les théories du Dr Torrent-Guasp ont ouvert des voies qu’ils peuvent suivre pour progresser dans la compréhension de la physiologie du muscle cardiaque. D’autres points restent difficiles à concilier avec les données antérieures.18
CONCLUSIONS
Dans cette nouvelle conception de la fonction diastolique, les 3 propriétés des fibres myocardiques participeraient, suivant un certain ordre tout en se chevauchant. L’aspiration initiale avec la chambre fermée serait une conséquence de la contraction du dernier segment de la bande, comme nous avons tenté de le démontrer avec les expériences présentées ici ; la relaxation des fibres des segments successifs avec la valve mitrale ouverte permettrait un remplissage rapide et, enfin, la distensibilité permettrait à la paroi myocardique de céder en réponse à l’augmentation de pression/volume produite par l’injection dans l’oreillette.
ACKNOWLEDGMENTS
Cette étude a été réalisée en mémoire du Dr Francisco Torrent-Guasp.
Cette étude a été financée par la subvention n° 99/1002 du Fondo de Investigaciones Sanitarias espagnol (FIS).