Introduction
Le cancer de la prostate est la forme la plus courante de malignité et la deuxième cause de décès par cancer chez les hommes1. Des études cadavériques montrent que la possibilité de développer des micro-foyers de cancer de la prostate augmente avec l’âge (30 % dans la quatrième décennie de vie, 40 % dans la cinquième décennie, etc.).2
Alors que certains cancers sont agressifs, d’autres n’ont pas ou peu de potentiel métastatique3. De nombreux hommes atteints d’un cancer de la prostate à faible risque ne progresseront pas ou ne deviendront pas cliniquement symptomatiques au cours de leur vie.4 En raison de cette variabilité, différentes options de traitement ont été introduites, offrant des effets thérapeutiques comparables à la prostatectomie radicale (PR), tout en préservant la fonction sexuelle et la continence. Dans ce scénario, la surveillance active (SA) peut offrir une morbidité réduite et une amélioration de la qualité de vie.5 Les petites tumeurs non agressives sont les candidats idéaux pour la SA, bien qu’aucun consensus n’ait été atteint. Une maladie à faible risque est définie par un score de Gleason (GS) de 6 et un antigène prostatique spécifique (PSA)
ng/ml. Les patients dont le stade clinique est >T2a sont généralement exclus.6
Le grade histologique est un déterminant indépendant du pronostic de la maladie et de la survie.7 Le système de classement GS est la classification la plus largement acceptée,8 mais de nombreuses études ont montré que le GS obtenu par biopsie de la prostate n’est pas toujours en corrélation avec le grade pathologique final des pièces chirurgicales. Une amélioration du GS (augmentation du GS d’au moins un point) a été rapportée dans 57% des cas.9,10 Les erreurs dans l’attribution du GS peuvent conduire à une surveillance inappropriée des tumeurs biologiquement agressives, ou à la sélection de traitements avec des taux de guérison inférieurs dans les maladies à haut risque, ce qui peut finalement avoir un impact négatif sur les résultats pour les patients.11 Par conséquent, plusieurs études récentes ont cherché des facteurs qui pourraient prédire l’évolution du GS.12
Un faible volume prostatique (PV), et plus particulièrement une densité antigénique prostatique (DAPS) élevée, se sont avérés être des facteurs prédictifs de la progression du risque dans de nombreuses études, reflétant la possibilité d’un cancer agressif non détecté.6 Plusieurs études ont montré une relation forte entre la DASP et l’agressivité du cancer de la prostate.13 La DASP a été proposée comme un prédicteur fort de l’amélioration du GS chez les patients présentant une maladie de Gleason 6 confirmée par biopsie, mais il n’y a pas de consensus général sur la valeur seuil.11-L’objectif principal de notre étude était d’identifier les prédicteurs indépendants de l’amélioration du GS et de déterminer la meilleure valeur seuil pour la PSAD afin d’identifier les patients à risque.
Matériels et méthodes
Nous avons recueilli les informations de l’étude à partir de la base de données prospectivement maintenue par notre centre hospitalier. Les patients atteints d’un cancer de la prostate cliniquement localisé ayant subi une prostatectomie radicale (PR) et ayant eu une biopsie préopératoire de la prostate dans la période allant de janvier 2004 à février 2015 ont été sélectionnés. La détection d’un GS 3+3 à la biopsie de la prostate a été prise comme critère d’inclusion. Toutes les informations cliniques, d’imagerie, de laboratoire et pathologiques ont été obtenues à partir de la base de données et corroborées par les dossiers cliniques des patients.
Nous avons inclus l’âge préopératoire du patient, le stade clinique de la maladie, le PSA pré-biopsie, le PSAD préopératoire, le GS de la biopsie, le nombre total de carottes de biopsie prélevées et le nombre de carottes de biopsie avec cancer et nous avons analysé l’association de ces facteurs avec l’amélioration du GS après RP. Différentes valeurs seuils ont été utilisées pour chaque variable afin d’identifier et de quantifier une relation potentielle avec l’amélioration de Gleason. Nous avons également analysé l’association entre le rehaussement du GS et les variables du syndrome métabolique, telles que le diabète sucré (DS), l’hypertension artérielle (HTA) et l’obésité, qui ont été obtenues à partir des dossiers cliniques des patients. Ces dernières variables ont été incluses car des études antérieures ont montré leur association avec un pronostic plus défavorable et un taux de récidive plus élevé.18,19
Le PSAAD a été calculé en divisant la valeur du PSA préopératoire par le PV. Le PV a été calculé par échographie transrectale en utilisant le diamètre transversal maximum (D1), le diamètre antéro-postérieur maximum (D2) et le diamètre longitudinal maximum (D3), selon la formule D1×D2×D3×ϖ/6 basée sur la théorie de la dimension de l’ellipse de la prostate.14 La biopsie de la prostate a été réalisée selon le protocole précédemment décrit de notre hôpital. Tous les patients ont été légèrement sédatés et une dose i.v. unique de pipéracilline/tazobactam a été administrée 15 minutes avant la procédure.20 Nous avons utilisé une aiguille de calibre 18 avec un pistolet à biopsie automatique pour obtenir le tissu prostatique. Pour la première biopsie, 12 à 18 carottes ont été prélevées, en fonction de la taille de la prostate et de la présence de nodules suspects.21 Tous les échantillons ont été placés dans un récipient séparé qui identifiait le site correspondant et ont été envoyés au service de pathologie de notre hôpital.
Les statistiques descriptives ont été présentées sous forme de moyenne±écart-type (SD) et de médiane/IQR pour les variables continues et sous forme de fréquence absolue et de pourcentage de distribution pour les variables catégorielles. Les patients ayant bénéficié d’un reclassement postopératoire à un niveau GS 7 ou supérieur ont été comparés à ceux qui n’ont pas été reclassés. Pour déterminer les différences et les similitudes de moyennes, les variables catégorielles ont été comparées à l’aide du test du chi-deux de Pearson et les variables continues à l’aide du test de la médiane et du test t de Student. Un test de régression univarié a été utilisé pour détecter les prédicteurs indépendants significatifs du reclassement. Une courbe caractéristique d’exploitation du récepteur (ROC) a été utilisée et l’aire sous la courbe (AUC) a été calculée pour montrer la valeur seuil optimale des variables ayant une signification prédictive pour le reclassement du GS. Nous avons estimé la sensibilité, la spécificité, la valeur prédictive positive et la valeur prédictive négative de différents seuils proposés par d’autres auteurs, nous les avons appliqués à notre population, puis nous les avons comparés à notre valeur seuil. Tous les tests étaient bilatéraux et une valeur p de
Résultats
Sur un total de 342 patients dans notre base de données, 144 (42,1%) ont été exclus car ils avaient un GS ≥4 dans la biopsie de la prostate. Il restait donc 198 (57,9%) patients qui répondaient à nos critères d’inclusion de GS 6 (3+3). Soixante-treize de ces patients ont été exclus en raison d’informations cliniques incomplètes provenant des dossiers médicaux.
L’âge moyen des patients était de 65,1±6,3 ans, l’indice de masse corporelle (IMC) était de 26,7±3,6kg/m2, le nombre de carottes prélevées était de 13,4±3,5, le nombre de carottes positives était de 2,5±2, et le PSAD préopératoire était de 0,26±0,23ng/ml2. Le PSA médian préopératoire était de 7,2 IQR 5,67-10,05 et le PV de 38 IQR 26,5-55,5. Le stade clinique basé sur le toucher rectal était T1c chez 86 (69,6%) patients, T2a chez 28 (22,4%), T2b chez 7 (5,6%), T2c chez 2 (1,6%) et T3 chez un (0,8%) patient.
Le PSA préopératoire a été catégorisé comme suit : 6 (4,8 %) patients avaient des valeurs de PSA
ng/ml, 88 (70,4 %) entre 4 et 9,9ng/ml, 23 (18,4 %) entre 10 et 19,9ng/ml et 8 (6,4 %) avaient un PSA ≥20ng/ml. Le GS biopsique et le GS chirurgical sont restés les mêmes chez 71 (56,8 %) patients avec un GS 3+3, tandis que 54 (43,2 %) patients ont eu un surclassement. Parmi les patients avec surclassement, 70 % sont passés à un GS de 7 et 30 % sont passés à ≥8.
Le tableau 1 montre les caractéristiques démographiques et cliniques des patients avec et sans surclassement du GS. Nous avons trouvé une corrélation statistiquement significative entre le surclassement postopératoire et la valeur PSAD préopératoire (p0,001), le PSA préopératoire (p=0,039), le PV (p=0,004) et l’âge du patient ≥70 ans (p=0.011).
Caractéristiques des patients avec et sans rehaussement du score de Gleason après prostatectomie radicale.
| Caractéristiques | Mise à niveau | Non mise à niveau | p-Value |
|---|---|---|---|
| Nb. de patients (%) | 54 (43,2%) | 71 (56.8%) | |
| Age (années) | |||
| Moyenne±SD | 66.22±6,5 | 64,28±6,0 | 0,092b |
| Age (nbre)) | |||
| >70 ans | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| IMC (kg/m2) | |||
| Moyenne±SD | 26.22±4,0 | 27,14±3,1 | 0,178c |
| PSA (ng/ml) | |||
| Médiane/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c |
| Volume de la prostate (ml) | |||
| Médiane/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Moyenne±SD | .36±.27 | .19±.16 | *,c |
| Coeurs de biopsie (no.) | |||
| Moyenne±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Cœurs positifs (n°) | |||
| Moyenne±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c |
| Obésité (nbre) | |||
| Positif | 9 (16,6%) | 16 (22,5%) | 0.500a |
| Négatif | 45 (83,4%) | 55 (77.5%) | |
| DM (no.) | |||
| Positif | 16 (29,6%) | 14 (19.7%) | 0,150a |
| Négatif | 38 (70,4%) | 57 (80.3%) | |
| HBP (no.) | |||
| Positif | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Négatif | 33 (61,1%) | 41 (57.8%) | |
IQR : écart interquartile ; IMC : indice de masse corporelle ; PSA : antigène spécifique de la prostate ; PSAD : densité de l’antigène spécifique de la prostate ; DM : diabète sucré ; HBP : hypertension artérielle.
Test X2.
Test t de Student.
Test de la médiane.
Statistiquement significatif avec une valeur p
Nous avons estimé un seuil optimal de PSAD de 0.17ng/ml2 par analyse ROC, avec une AUC de 0,675 (p=0,001, 95%CI .580-.770), puis nous avons analysé les valeurs seuils proposées par d’autres auteurs et les avons comparées. Le tableau 2 et la figure 1 présentent ces résultats.
Analyse des différentes valeurs seuils du PSAD comme prédicteur de l’amélioration du GS.
| Mise à niveau | Non mise à niveau | p | Odds rapport | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (no) | ||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49 (69%) | |||||||
PSAD : antigène spécifique de la prostate.
Test X2.
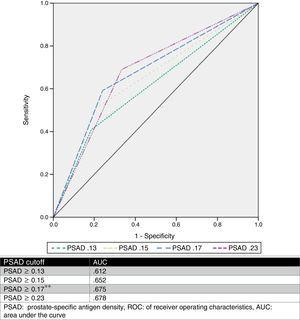
Courbe CRO.
Le tableau 3 montre les résultats de la régression univariée pour la détection des prédicteurs indépendants de la mise à niveau.
Prédicteurs indépendants de la mise à niveau (régression univariée).
| Caractéristiques | HR | 95 CI | valeur p |
|---|---|---|---|
| Âge | 0.5 | 0,99-1,11 | 0,09 |
| >70 ans d’âge | 1.06 | 1,26-6,63 | 0,039* |
| BMI | 0,072 | 0,97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Volume de la prostate | 0.02 | 1,01-1,04 | 0,008* |
| Carottes de biopsie positives | 0.06 | 0,98-1,18 | 0,24 |
| Obésité | 0,31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0,152 |
| HBP | 0,10 | 0,53-2,29 | 0.775 |
BMI : indice de masse corporelle ; PSA : antigène spécifique de la prostate ; PSAD : densité de l’antigène spécifique de la prostate ; DM : diabète sucré ; HBP : hypertension artérielle.
Discussion
Plusieurs études ont trouvé un manque de concordance entre le rapport du GS de la biopsie de la prostate et le rapport de la prostatectomie radicale. Dans une méta-analyse récente incluant 14 839 patients, les auteurs ont estimé une amélioration du GS chez 30 % des patients, 63 % seulement restant inchangés après la prostatectomie22. Une amélioration de Gleason a été trouvée dans 29-58% des cas,23 et est pire dans le sous-groupe de patients avec un GS 3+3 à la biopsie (jusqu’à 63,3%).14 Dans notre centre hospitalier, nous avons trouvé une amélioration du GS chez 42,1% de tous les patients qui ont subi une prostatectomie radicale et chez 43,2% des patients avec un score de Gleason de 3+3 à la biopsie.
De nombreux auteurs ont essayé de trouver des prédicteurs de l’amélioration du GS, en particulier avec la popularité actuellement croissante des protocoles AS. Les prédicteurs précédemment décrits sont l’âge >60 ans, la valeur du PSA >5,0ng/ml et >25% de carottes positives lors de la biopsie.24
Le PSA a été analysé et plusieurs valeurs seuils ont été décrites (telles que ≥0,13ng/ml, ≥0,15ng/ml et ≥0,23ng/ml).11,13,16,17 Néanmoins, il n’y a pas de consensus sur l’utilisation de cette valeur pour prédire avec précision un rehaussement du GS. Sur la base de nos résultats, nous avons proposé une valeur seuil de ≥0,17ng/ml, qui présentait une AUC de 0,675, une sensibilité de 75,9 %, une spécificité de 59,2 %, une VPP de 58,5 % et une VPN de 76,3 % pour la prédiction du surclassement du GS. Nous avons choisi ce point de coupure, car en analysant d’autres valeurs proposées par rapport à notre série de cas, la meilleure AUC a été obtenue avec une valeur ≥0,23ng/ml (0,678), mais elle présentait une moins bonne sensibilité et un taux de faux négatifs élevé (33,33%). En revanche, lorsque nous avons utilisé les valeurs ≥0,13ng/ml et ≥0,15ng/ml, elles présentaient un taux de faux positifs de 59 % et 49 %, respectivement. Le taux de faux négatifs et le taux de faux positifs du seuil proposé par notre équipe étaient respectivement de 24 % et 41 %, ce que nous avons considéré comme le plus utile. La figure 2 présente un graphique de notre population.

La population étudiée, montrant les différentes densités de l’antigène spécifique de la prostate et les données de mise à niveau.
Notre étude n’a inclus que les patients ayant un GS de 3+3 à la biopsie, en raison de l’importance de cette variable lorsqu’on considère un patient pour la SA. Étant donné que d’autres facteurs sont pris en considération pour la surveillance active, nous ne pouvons pas déclarer que le risque d’amélioration du GS et le PSAD sont des variables déterminantes pour proposer une stratégie thérapeutique, mais nous pensons définitivement qu’ils doivent être discutés avant de prendre une décision. Une seconde biopsie pourrait être indiquée pour les patients ayant un PSAD ≥0,17ng/ml, compte tenu du risque de sous-classification, afin de corroborer le GS. L’IRM de la prostate et les biopsies de fusion guidées par IRM ont montré une sensibilité et une spécificité élevées pour localiser un cancer significatif non identifié25. Cependant, ces options ne sont pas largement disponibles au Mexique, de sorte que la biopsie par saturation ou par gabarit guidée par échographie transrectale pourrait être une option plus viable pour augmenter la précision du diagnostic.
Des preuves récentes ont suggéré une association entre les différentes composantes du syndrome métabolique et le cancer de la prostate, augmentant le risque de présenter la maladie et d’en mourir,21 ainsi qu’un taux plus élevé de récidive biochimique après un traitement radical.22 Cependant, dans notre étude, nous n’avons pas pu démontrer une association avec la mise à niveau du score de Gleason.
Le volume de la prostate, qui est directement lié à l’âge, pourrait être un élément de distraction. Lorsqu’une biopsie échoguidée aléatoire est réalisée dans une prostate de grande taille, il existe un risque potentiel de laisser de plus grandes zones sous-échantillonnées, ce qui représente un risque plus élevé de manquer une tumeur significative.
La SA a donné des résultats prometteurs chez les patients atteints d’un cancer de la prostate à faible risque, avec une amélioration de la qualité de vie, une préservation de la fonction érectile et de la continence urinaire, et d’autres complications associées aux traitements radicaux.6 Cependant, il existe un risque de mal diagnostiquer un cancer agressif et de retarder un traitement opportun, ce qui affecte le pronostic du patient. Il existe de nombreux critères de sélection des candidats à la SA, et la classification des risques de D’Amico26 et les critères d’Epstein27 sont les plus utilisés à cette fin. La première n’inclut pas le PSAD, mais dans les critères d’Epstein, l’utilisation d’une valeur seuil ≥0,15ng/ml est suggérée. Dans notre hôpital, nous utilisons des critères très stricts et la valeur seuil de PSAD ≥0,17ng/ml sera incluse dans la discussion lors de la sélection d’un éventuel candidat à la SA.
Le caractère rétrospectif de notre étude a constitué sa principale limite. L’échantillon potentiel a été encore plus réduit en raison de données incomplètes dans les dossiers de cas cliniques. Une autre limite était le fait que nous n’avions pas toutes les données des échantillons de biopsie, nous ne pouvions donc pas analyser les patients avec les critères complets de la SA. Cependant, avec la quantité de patients inclus dans l’étude, des résultats significatifs ont été obtenus et ceux-ci peuvent être utilisés pour considérer le risque de surclassement GS chez les patients avec GS 3+3.
Conclusions
Nous concluons qu’il est important d’utiliser autant d’outils que possible pour prendre des décisions précises et identifier les patients à haut risque de surclassement pathologique qui pourraient bénéficier d’une évaluation plus méticuleuse et/ou d’un traitement agressif. Le PSAD devrait être utilisé de manière systématique pour identifier les patients atteints d’un cancer apparemment à faible risque de rehaussement du GS, ce qui permettrait une sélection plus précise des candidats à la SA. Selon nos données, nous pouvons éviter une stadification GS potentiellement incorrecte dans environ 43% des cas.
Nous avons constaté une fréquence élevée de surclassement GS dans notre population. Dans notre étude, les valeurs de PSAD étaient significativement associées au surclassement et la valeur seuil la plus précise était de 0,17ng/ml2. Nous recommandons qu’un examen local du risque de surclassement du GS et de ses prédicteurs potentiels soit effectué dans tous les centres hospitaliers avant de proposer une surveillance active aux candidats potentiels.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette étude.
Confidentialité des données
Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Droit à la vie privée et au consentement éclairé
Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Funding
Aucun soutien de quelque nature que ce soit n’a été reçu pour entreprendre cet article.
Conflit d’intérêt
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêt et qu’ils n’ont reçu aucun parrainage pour cette étude.