Lorsqu’une substance change de phase, c’est-à-dire qu’elle passe soit d’un solide à un liquide, soit d’un liquide à un gaz, l’énergie, elle a besoin d’énergie pour le faire. L’énergie potentielle stockée dans les forces interatomiques entre les molécules doit être surmontée par l’énergie cinétique le mouvement des particules avant que la substance puisse changer de phase.
Si nous mesurons la température de la substance qui est initialement solide comme nous la chauffons nous produisons un graphique comme la figure 1.
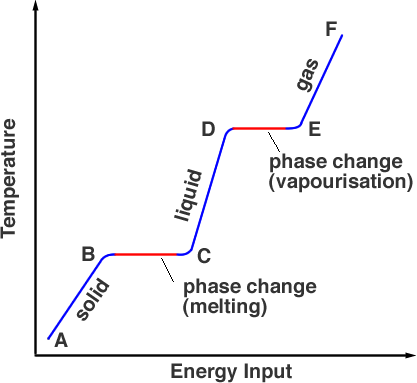
En partant d’un point A, la substance est dans sa phase solide, la chauffer amène la température à son point de fusion mais le matériau est encore un solide au point B. En le chauffant davantage, l’énergie de la source de chaleur va dans la rupture des liaisons qui maintiennent les atomes en place. Ce processus se déroule de B à C. Au point C, toute la phase solide a été transformée en phase liquide. Une fois de plus, lorsque de l’énergie est ajoutée, l’énergie va dans l’énergie cinétique des particules, ce qui augmente la température (C à D). Au point D, la température a atteint son point d’ébullition, mais la phase liquide est toujours présente. Des points D à E, l’énergie thermique surmonte les liaisons et les particules ont suffisamment d’énergie cinétique pour s’échapper du liquide. La substance entre dans la phase gazeuse. Au-delà de E, un chauffage supplémentaire sous pression permet d’augmenter encore la température c’est ainsi que fonctionne un autocuiseur.
Chaleur latente de fusion et de vaporisation
L’énergie nécessaire au changement de phase d’une substance est appelée chaleur latente. Le mot latent signifie caché. Lorsque le changement de phase est de solide à liquide, nous devons utiliser la chaleur latente de fusion, et lorsque le changement de phase est de liquide à gaz, nous devons utiliser la chaleur latente de vaporisation.
L’énergie nécessaire est Q= m L, où m est la masse de la substance et L est la chaleur latente spécifique de fusion ou de vaporisation qui mesure l’énergie thermique pour changer 1 kg d’un solide en liquide.
Tableau 1. montrent la
| Substance | Chaleur latente spécifique de fusion kJ.kg-1 |
°C | Chaleur latente spécifique de vaporisation kJ.kg-1 |
°C |
|---|---|---|---|---|
| Eau | 334 | 0 | 2258 | 100 |
| Ethanol | 109 | -114 | 838 | 78 |
| Acide éthanoïque | 192 | 17 | 395 | 118 |
| Chloroforme | 74 | -64 | 254 | 62 |
| Mercure | 11 | -39 | 294 | 357 |
| Soufre | 54 | 115 | 1406 | 445 |
| Hydrogène | 60 | -259 | 449 | -253 |
| Oxygène | 14 | -219 | 213 | -183 |
| Azote | 25 | -210 | 199 | -196 |
Les caloducs
A mesure que la densité de transitors dans un microprocesseur augmente, la quantité de chaleur dissipée augmente. Un processeur Pentium 4 (180 nm fonctionnant à 2GHz) dissipe, 55 Watts de puissance sous forme de chaleur. Sa surface n’est que de 131 mm2. Cela donne une puissance de 55 W/(131/(102)) = 42 W cm-2. En comparaison, un fer à vapeur est de 5 Wcm-2.
Une solution est le caloduc. Comme son nom l’indique, il transfère la chaleur des régions à haute température vers des régions à plus basse température où il y a plus d’espace pour les dissipateurs thermiques ou les ventilateurs de refroidissement.
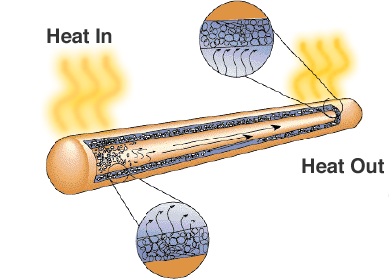
Bien qu’il ressemble simplement à un tuyau métallique scellé, il y a une mèche ou un matériau poreux et un liquide avec une chaleur latente de vaporisation élevée. Lorsque le tuyau est chauffé, le liquide utilise la chaleur pour s’évaporer et se transformer en gaz, le gaz se déplace vers une région plus froide du caloduc où il se condense et utilise la chaleur latente pour se transformer à nouveau en liquide. Les caloducs constituent une solution fiable et rentable pour les ordinateurs portables où les ventilateurs réduiraient la durée de vie de la batterie.