
Le jus de citron a un goût aigre parce qu’il contient 5 à 6 % d’acide citrique et a un pH de 2,2. (acidité élevée)
Le pH (potentiel d’hydrogène) est une échelle d’acidité de 0 à 14. Il indique le degré d’acidité ou d’alcalinité d’une substance. Des solutions plus acides, ont un pH plus faible. Les solutions plus alcalines ont un pH plus élevé. Les substances qui ne sont ni acides ni alcalines (c’est-à-dire les solutions neutres) ont généralement un pH de 7. Les acides ont un pH inférieur à 7. Les alcalins ont un pH supérieur à 7.
Le pH est une mesure de la concentration de protons (H+) dans une solution. S.P.L. Sørensen a introduit ce concept en 1909. Le p correspond à l’allemand potenz, qui signifie puissance ou concentration, et le H à l’ion hydrogène (H+).
Les substances alcalines ont, à la place des ions hydrogène, une concentration d’ions hydroxyde (OH-).
indicateurs de pH
Un indicateur de pH est un composé chimique ajouté en petite quantité à une solution pour que le pH (acidité ou basicité) de la solution puisse être vu. L’indicateur de pH est un détecteur chimique d’ions hydronium (H3O+) ou d’ions hydrogène (H+). Normalement, l’indicateur fait changer la couleur de la solution en fonction du pH.
Les indicateurs typiques sont la phénolphtaléine, l’orange de méthyle, le rouge de méthyle, le bleu de bromothymol et le bleu de thymol. Ils changent chacun de couleur à différents points de l’échelle de pH, et peuvent être utilisés ensemble comme un indicateur universel.
Une autre façon est d’utiliser le papier tournesol, qui est basé sur un indicateur de pH naturel. Le papier peut vous dire quelle est la force du produit chimique, si c’est un acide plus fort ou une base plus forte.
Certaines valeurs de pH courantes
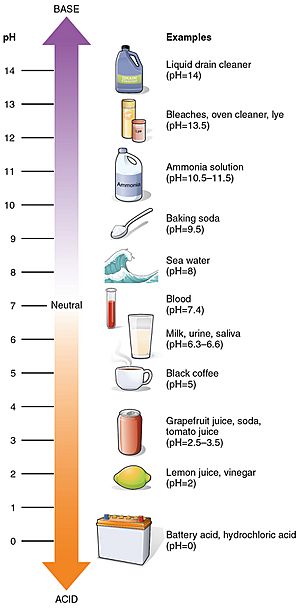
valeurs de pH de certaines substances courantes
Neutralisation
La neutralisation peut être résumée par l’équation :
H+ + OH- → H2O
(acide + base → eau)
Pages connexes
- Acide
- Base
- Alcali
- Titration
- Transpiration(Sreekanta Das).
Images pour enfants
-
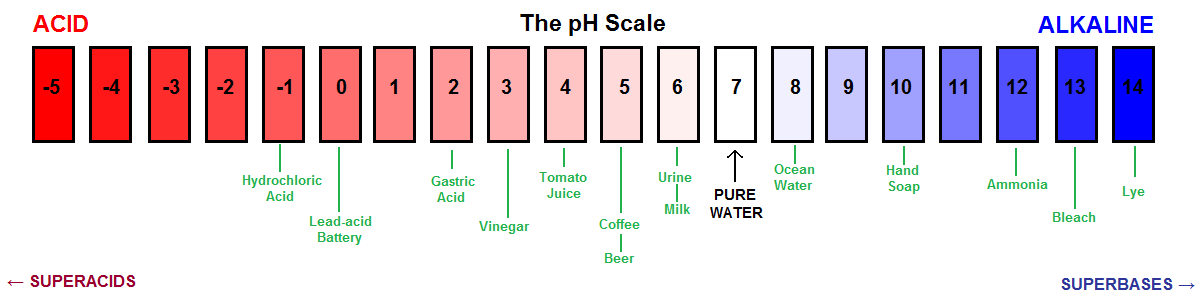
Autre représentation visuelle de l’échelle de pH.
-

Etendues de référence pour les tests sanguins, montrant la concentration de protons (violet) à gauche. On peut voir que les fourchettes sont maintenues dans une fourchette étroite, et que les protons libres font partie des composés ayant les concentrations massiques les plus faibles.
-

Chart montrant la variation de la couleur du papier indicateur universel avec le pH
.