- Introduction
- La nature des risques d’IED dans la neurophysiologie IEEG humaine
- Stratégies de traitement des EEI
- Pratiques actuelles parmi les chercheurs IEEG
- Préoccupations supplémentaires
- Conclusions
- Data Availability Statement
- Ethics Statement
- Contributions des auteurs
- Funding
- Conflit d’intérêt
- Remerciements
Introduction
L’électroencéphalographie intracrânienne (IEEG) transcende de nombreuses limites physiques de l’électroencéphalographie (EEG) de scalp et de la magnétoencéphalographie (MEG) en enregistrant les signaux directement à partir du tissu cérébral. Les progrès rapides du traitement informatique au cours des dernières décennies ont élargi les capacités logicielles et matérielles, permettant des enregistrements simultanés à partir de centaines de sites intracrâniens à la microseconde près. Ces augmentations de la résolution temporelle et spatiale ont amélioré la précision diagnostique pour la localisation des crises (Andrews et al., 2019 ; Cuello Oderiz et al., 2019) et ont conduit à une accélération de la recherche en neurophysiologie intracrânienne humaine (Chang, 2015 ; Parvizi et Kastner, 2018).
Avec les outils informatiques émergents et les capacités d’analyse des ensembles de données massives, la richesse des opportunités neuroscientifiques et des découvertes potentielles est prometteuse. Cependant, l’analyse du signal sur les enregistrements intracrâniens humains invoque des pièges inhérents qui sont vraisemblablement abordés mais minimalement reconnus dans de nombreuses études neurophysiologiques de patients humains – à savoir, les décharges épileptiformes interictales (IED). Les DEI sont des salves d’activité transitoires produites par des groupes de neurones qui sont pathologiquement connectés en raison de l’épilepsie, ce qui se traduit par des formes d’onde distinctes et proéminentes lors des enregistrements IEEG (Figure 1A). Cette Perspective attirera l’attention sur les dangers des DEI, les effets potentiels sur les stratégies d’analyse courantes et décrira des stratégies communes pour les éviter afin que la vague croissante de découvertes en neurophysiologie humaine continue d’avancer, espérons-le, sans faux pas.
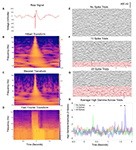
Figure 1. Contamination des données liées aux décharges épileptiformes interictales (IED). (A) Exemple d’une DEI provenant d’un seul canal au cours d’un enregistrement d’électroencéphalographie intracrânienne (IEEG) de 2 secondes. Les caractéristiques classiques sont apparentes, y compris un déplacement brusque et de grande amplitude de la tension et une onde lente qui suit, autrement avec un mélange de fréquences de base relativement normal avant et après. (B) Spectrogramme par transformée de Hilbert des données de (A). Notez l’augmentation transitoire mais substantielle de la puissance sur presque toutes les fréquences, due à la composante aiguë de la forme d’onde, et une augmentation subtile et soutenue de la puissance à basse fréquence liée à l’onde lente qui suit. (C) Spectrogramme par transformée en ondelettes des données de (A), avec des résultats similaires à ceux de (B). (D) Transformée de Fourier de A (Mitra et Bokil, 2007 ; Chronux Home, 2019) avec des fenêtres de 0,25 s se chevauchant, glissant point par point pour fournir une résolution temporelle similaire à (B,C). Résultats similaires à ceux de (B,C), avec une durée supplémentaire de l’augmentation de puissance dans les fréquences plus rapides en raison de la nature de la fenêtre temporelle cohérente entre les fréquences pour le calcul de la FFT. Les panneaux (E-G) présentent chacun les données IEEG de 50 essais, enregistrées à partir d’un seul canal pendant une tâche d’écoute de la parole (une phrase préenregistrée jouée à haute voix pour chaque essai à partir du temps zéro). Dans le panneau (F), 10 essais ont été échangés avec des essais contenant des IED, indiqués en rouge. Un hybride d’approches manuelles et automatisées (Baud et al., 2018) a été utilisé. Le panneau (G) augmente ce nombre à 20 essais avec des EEI. Le panneau (H) montre le gamma élevé moyen sur l’ensemble des essais dans chaque groupe (transformée de Hilbert, 50-200 Hz) à partir d’une électrode contactant le gyrus temporal inférieur qui n’était pas vraiment modulé par la tâche d’écoute de la phrase. Les astérisques indiquent les points de temps pendant lesquels l’un de ces groupes s’écarte significativement de la ligne de base (ANOVA à deux voies à mesures répétées, p < 0,05). Au fur et à mesure que la proportion d’essais avec des DEI augmente, des points temporels faussement positifs supplémentaires apparaissent.
La nature des risques d’IED dans la neurophysiologie IEEG humaine
Le point crucial de notre point de vue est que le paradigme de la neurophysiologie intracrânienne humaine expose les scientifiques bien intentionnés à des risques de résultats erronés en raison de deux facteurs principaux :
(1) Les électrodes sont implantées dans des régions du cerveau humain jugées susceptibles de révéler des signatures neurophysiologiques de l’épilepsie dans les contextes ictal et interictal – qui sont souvent des formes d’onde aiguës de grande amplitude.
(2) Les analyses de traitement du signal qui sont couramment utilisées pour la neurophysiologie humaine sont exquisément sensibles aux formes d’onde aigües de grande amplitude décrites au #1, qui provoquent des résultats erronés.
Par conséquent, les ensembles de données IEEG contiennent couramment des signatures électriques de l’épilepsie qui véhiculent un risque de résultats faussés lorsqu’ils sont inclus dans des analyses de signal communes telles que les mesures de puissance et de cohérence, et des méthodes connexes telles que la co-modulation puissance-phase (Kramer et al, 2008). Une façon de rendre compte de ce problème est que de nombreuses méthodes de traitement des signaux neuronaux, telles que les analyses de Fourier, d’ondelettes et de Hilbert, supposent un substrat de données sinusoïdal (van Drongelen, 2018). La convolution d’ondes de grande amplitude ou de déviations nettes (de grande ou même de petite amplitude) prédispose donc à des représentations de nombreuses fréquences qui peuvent être largement parasites, puisque de nombreuses fonctions sinusoïdales consécutives peuvent correspondre à ces éléments de la forme d’onde. Dans les figures 1B-D, nous montrons des exemples de la façon dont les EEI peuvent facilement représenter de façon erronée les signaux neurophysiologiques de cette manière à travers les méthodes spectrales couramment utilisées des transformées de Hilbert, Wavelet et Fourier. Dans les bandes de fréquences inférieures, les composantes d’ondes aiguës et lentes des EEI peuvent induire une augmentation de puissance dans n’importe quelle fréquence qui correspond à ces caractéristiques. Dans les bandes de fréquences plus élevées, cette augmentation de puissance frappante sur de vastes étendues de niveaux de fréquence continus devient encore plus évidente et peut être qualifiée de sonnerie ou de fuite spectrale (Scheffer-Teixeira et al., 2013). Ce phénomène peut être évident dans toute la bande gamma haute (50-200 Hz ou une autre gamme similaire), une question préoccupante étant donné que de nombreux laboratoires de neurophysiologie utilisent l’activité gamma haute en raison de sa valeur potentielle comme substitut de l’activité neuronale locale (Ray et al., 2008). L’exemple de la figure 1H montre comment l’inclusion cumulative (figures 1E-G) d’essais avec des pointes ajoute une variabilité parasite (risquant un faux négatif) ou influence autrement la signification statistique (risquant un faux positif).
Ce problème pourrait être plus répandu que dans les enregistrements EEG ou MEG en raison du contact direct avec le tissu neural, qui peut transmettre des amplitudes de pointes plus importantes et des déviations plus nettes, en particulier dans le cas des EEI, contaminant les analyses neurophysiologiques. En outre, les électrodes intracrâniennes sont spécifiquement placées dans des régions qui sont susceptibles d’être cliniquement associées au foyer de la crise épileptique, ce qui entraîne des DEI forts et/ou fréquents dans certains ensembles de données IEEG.
Anecdotiquement, la plupart des chercheurs en neurophysiologie humaine conviendraient que la contamination des données par les DEI est de notoriété publique, bien que l’impact de celle-ci puisse varier pour certains types d’analyses (Meisler et al., 2019). En fait, on pourrait s’attendre à ce que de nombreux laboratoires de recherche aient mis en place des stratégies pour contourner, ou du moins minimiser, ce problème. Cependant, lors de l’évaluation pratique, ce problème et ses ramifications potentielles peuvent être beaucoup plus répandus que prévu. Un troisième facteur de complication peut illustrer comment cela peut être le cas :
(3) Les chercheurs en neurophysiologie (en particulier les premiers stagiaires comme les étudiants et les chercheurs postdoctoraux) peuvent ne pas recevoir de formation directe à l’identification des EEI ou des artefacts électriques. En outre, le spectre des morphologies potentielles des EEI, et la façon dont leurs caractéristiques distinctes peuvent s’attendre à contaminer les analyses de signaux, peuvent ne pas être ancrés dans la formation standard.
Comme une autre complication, la concordance inter-juges pour la détection des EEI est étonnamment faible, même parmi les épileptologues pleinement formés (Barkmeier et al…, 2012 ; Janca et al., 2015).
Stratégies de traitement des EEI
Il existe une variété d’approches lorsqu’on rencontre des EEI dans les données, qui peuvent ou non dépendre de leur taux et de leur étendue spatiale (par exemple, un chercheur peut ne pas être enclin à curer et à » nettoyer » un ensemble de données pour un pic par minute, mais peut le faire pour 10 pics par minute). Nous avons distillé les approches potentielles des chercheurs en quatre stratégies principales. La première consiste à identifier et à supprimer manuellement tous les essais ou périodes au cours desquels des EEI se produisent, ce que nous appelons ici la stratégie 1. Les données sont passées au crible en examinant les tracés des données enregistrées avec ou sans un certain prétraitement (filtre coupe-bande et/ou filtre passe-bande) et les segments de données qui contiennent des EEI sont marqués de sorte que tous les essais qui se chevauchent avec ces segments peuvent être laissés de côté dans les analyses ou convertis en valeurs manquantes.
Certains chercheurs ont reçu une formation clinique formelle dans la lecture de l’EEG/iEEG, bien que cela soit moins fréquent pour de nombreux chercheurs non cliniques qui sont formés par des voies académiques de sciences supérieures. Si beaucoup d’entre eux ont reçu une formation didactique et/ou individuelle sur la façon d’identifier et de supprimer les essais de DEI des ensembles de données, certains ne l’ont pas fait. Pour compliquer les choses, les ensembles de données IEEG sont loin d’être standardisés en raison des différences d’enregistrement : la disposition des réseaux générateurs de crises diffère pour chaque patient, ce qui entraîne un nombre variable d’électrodes, sans parler des différences individuelles dans la neuroanatomie et la latéralité de l’implantation. Il existe des modes de contact mixtes (grilles, bandes, profondeurs) de densités variables, ainsi qu’un ordonnancement personnalisé des canaux (montages). Tous ces facteurs entraînent une difficulté accrue dans l’interprétation des analyses IEEG, en particulier pour ceux qui n’ont pas reçu une formation adéquate (formelle ou informelle) pour l’identification des EEI dans ces schémas d’enregistrement. Enfin, à mesure que la durée des enregistrements augmente, la stratégie 1 perd de sa praticité en raison des contraintes de temps et d’effort.
Des algorithmes informatisés de détection des pointes ont été développés au cours des dernières décennies afin de doter la prochaine génération de scientifiques de capacités de détection des pointes efficaces et standardisées, de gagner du temps et de contourner l’erreur humaine. L’utilisation de détecteurs d’EEI et le retrait des essais/données affectés de manière automatisée constituent une autre approche, que nous appellerons stratégie 2. Heureusement, les EEI ont tendance à avoir les caractéristiques qui sont souvent saillantes pour de nombreux algorithmes : des composantes de grande amplitude, nettes, et parfois avec des oscillations haute fréquence pathophysiologiques qui sont moins souvent rencontrées dans le cerveau normal (voir cependant Frauscher et al., 2018b). Idéalement, un algorithme maximisera à la fois la sensibilité et la spécificité, tout en diminuant ou en supprimant la contribution (supervision, telle que la fixation de seuils) requise de l’utilisateur. Il est cependant difficile de satisfaire complètement cette liste de souhaits, et c’est pourquoi de nombreux algorithmes ont été développés en utilisant une variété d’approches automatisées et non supervisées. Il s’agit notamment de dérivations EEG (White et al., 2006), de transformées de longueur de ligne et de puissance (Esteller et al., 2001 ; Bergstrom et al., 2013), de fonctions de transfert dirigées adaptatives (Wilke et al., 2009), de filtres spatiaux (Liu et al., 2015) et d’algorithmes de mise en correspondance des pointes et des templates, tels que la régression spatio-temporelle (Tousseyn et al., 2014) et la factorisation de matrices non négatives (Baud et al., 2018), parmi de nombreuses autres approches. Tous les outils présentent des compromis en termes de sensibilité et de spécificité ; aucune approche n’offre une certitude à 100 %, ce qui est encore compliqué par l’absence d’un gold standard humain fiable. Plus précisément, la faible concordance inter-juges de la détection manuelle chez les personnes hautement qualifiées notée ci-dessus, et la » zone grise quantitative » de petits EEI douteux qu’ils peuvent ignorer, sont des mises en garde fondamentales pour les tests d’algorithmes. Enfin, bien que presque toutes les nouvelles méthodes soient comparées à la détection manuelle ou à une autre méthode automatisée, une comparaison générale de la plupart ou de toutes les méthodes automatisées est difficile en raison des défis techniques que représente la mise en œuvre de chacune d’entre elles sur un ensemble de données suffisamment grand (Westover et al., 2017). Néanmoins, la suppression automatisée des pointes interictales à l’aide d’approches non supervisées et/ou supervisées peut permettre de gagner du temps, de normaliser l’approche et d’améliorer la qualité des données neurophysiologiques.
En raison des mises en garde (et des sophismes potentiels) des algorithmes de détection automatisée, certains chercheurs qui les emploient peuvent hésiter à laisser toute latitude à ce mécanisme. Étant donné que les approches de détection automatisée peuvent augmenter considérablement l’efficacité pour la plupart des détections évidentes, une troisième stratégie (stratégie 3) est une approche hybride des stratégies 1 et 2, dans laquelle les détections automatisées sont également filtrées manuellement (souvent dans cet ordre, bien que l’ordre inverse ou des itérations multiples puissent également être appliqués). Un exemple de cet hybride est l’utilisation de distributions de caractéristiques morphologiques (par exemple, la pente, les mesures de puissance, etc.) auxquelles un seuil peut être appliqué, suivi d’une inspection manuelle pour les faux positifs et/ou négatifs potentiels.
Compte tenu de la complexité de la collecte de ces précieuses données et de leur rareté associée, un inconvénient commun aux stratégies 1, 2 ou 3 est que la suppression des essais réduit la puissance statistique. En conséquence, un autre biais – en faveur de la conservation d’un plus grand nombre d’essais – permet d’introduire davantage de résultats potentiels de signaux parasites, ajoutant le risque de faux négatifs et positifs tel que décrit ci-dessus.
La préférence pour conserver le plus grand nombre d’essais possible introduit une stratégie différente pour traiter les DEI : l’agnosticisme, dans lequel les DEI sont ignorés (non évalués) et aucun essai n’est retiré (stratégie 4). On pourrait naturellement supposer que les données affectées par les EEI seront suffisamment peu fréquentes et aléatoires pour que les points temporels affectés se fondent dans l’arrière-plan d’un signal moyen, ajoutant de la variabilité mais ne biaisant pas significativement les résultats. Pendant ce temps, les signatures neurophysiologiques liées à la tâche devraient émerger de l’analyse et prévaloir, si elles sont présentes, en vertu de leur cohérence entre les essais. En tant que problème de rapport signal/bruit, cette hypothèse peut être valable pour les EEI peu fréquents, en particulier avec une taille d’effet expérimental forte (bien qu’une couche de sécurité supplémentaire d’utilisation de statistiques non paramétriques puisse être conseillée). Cependant, des EEI plus fréquents (Figures 1E-H) et/ou plus grands ou plus pointus peuvent miner cette approche. Néanmoins, une puissance statistique robuste est toujours préférable et nécessite souvent un grand nombre d’essais qui sont plus susceptibles d’être atteints dans l’approche agnostique de la stratégie 4, en particulier pour les effets de taille subtile. En fait, une étude récente (Meisler et al., 2019) a formellement évalué si la suppression manuelle, automatisée ou non des EEI affectait leurs résultats neurophysiologiques dans une tâche de mémoire épisodique – ils n’ont trouvé aucun effet clair d’aucune approche, mais ont souligné l’importance d’un nombre suffisant d’essais. Sur une note connexe, les analyses d’apprentissage automatique plus récentes nécessitent de grands volumes de données d’entraînement pour construire des modèles précis – ceux-ci ainsi que les approches d’apprentissage profond peuvent apprendre à différencier les signaux neurophysiologiques normaux des formes d’onde IED pathologiques, à condition que les données d’entraînement précédentes soient étiquetées avec précision (souvent manuellement). Ainsi, la stratégie agnostique a un certain attrait (y compris un faible effort) et pourrait être un bon défaut pour certaines études, en supposant qu’il y ait suffisamment de données pour l’employer.
Pratiques actuelles parmi les chercheurs IEEG
Avec ces diverses stratégies générales à l’esprit, comment les IED sont-ils actuellement traités par les chercheurs en neurophysiologie humaine ? Nous avons évalué cette question des « pratiques actuelles » en résumant d’abord comment les chercheurs décrivent leurs méthodes dans la littérature publiée. Nous avons effectué une recherche dans PubMed en utilisant deux requêtes générales : (intracrânien ET eeg ; électrocorticographie) et avons filtré les résultats pour inclure uniquement les études publiées en 2018. Nous avons limité les résultats de la recherche en examinant chaque article (613 articles uniques) et n’avons inclus que ceux qui mesuraient des signaux neurophysiologiques intracrâniens chez l’homme et semblaient tirer des conclusions concernant la neurophysiologie normale (91 au total). Bien que ces conditions de recherche ne soient pas exhaustives, elles donnent un aperçu contemporain de divers groupes dans le monde qui étudient la neurophysiologie humaine normale in vivo. Nous avons constaté que la majorité de ces publications faisaient allusion à l’utilisation de méthodes manuelles (Figure 2A), y compris l’identification directe des EEI, ou une approche similaire (mais plus conservatrice) consistant à identifier et à exclure les électrodes qui couvraient les foyers de crise. Moins de 5% des manuscrits ont utilisé des méthodes entièrement automatisées, et aucun des articles inclus n’a utilisé l’approche agnostique (stratégie 4). Encore une fois, notre échantillon d’articles inclus était limité et ces résultats peuvent ne pas représenter pleinement le domaine.
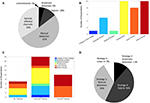
Figure 2. Pratiques actuelles de manipulation des EEI parmi les chercheurs en EEG. (A) Méthodes de traitement des EEI telles que rapportées par les manuscrits de 2018 qui correspondaient à nos critères de recherche et de sélection PubMed. (B) Niveaux de carrière parmi les répondants à l’enquête. (C) Formation concernant l’identification et/ou le retrait des EEI parmi les répondants à l’enquête. (D) Stratégie utilisée pour la manipulation des EEI parmi les répondants à l’enquête.
Comme les méthodes de manipulation des EEI ne semblaient pas être décrites en détail dans de nombreux articles, nous avons évalué plus avant notre question sur les « pratiques actuelles » en concevant une enquête anonyme. Cette enquête (d’environ ~2 min) consistait en des questions concernant le niveau de carrière, s’ils étaient familiers avec les IED en IEEG, et s’ils avaient une formation formelle ou informelle ou aucune formation sur l’identification et le retrait des IED, ainsi qu’une sélection des stratégies (1-4) ci-dessus qu’ils avaient tendance à utiliser (ou autre). Nous avons envoyé un courrier électronique aux auteurs correspondants des articles décrits ci-dessus (79 au total, car certains articles se chevauchaient ou avaient plusieurs auteurs correspondants) pour leur demander de participer volontairement à l’enquête, qui serait anonyme (exemptée des exigences de l’IRB selon le bureau de l’UCSF IRB). Nous avons demandé à ces personnes de faire suivre l’enquête à d’autres collègues et collaborateurs.
Nous avons reçu un taux de réponse de 44%, avec des répondants à l’enquête pondérés vers les post-doctorants et les membres du corps enseignant, probablement en raison d’un biais d’échantillonnage via l’envoi d’un courriel à une population d’auteurs correspondants (Figure 2B). Il convient de noter que les réponses de ces membres expérimentés du laboratoire peuvent probablement représenter la pratique de leur laboratoire dans son ensemble sur leur stratégie IED, bien que cela soit moins applicable pour les questions de familiarité et de formation IED. Tous les répondants ont indiqué qu’ils étaient familiers avec les EEI, un résultat rassurant, bien que possiblement influencé par la nature du sondage. En ce qui concerne la formation sur la reconnaissance des EEI et les méthodes de manipulation, la majorité a été formée de manière informelle (Figure 2C), et certains n’ont pas été formés du tout. Il n’est pas surprenant de constater que ceux qui ont indiqué avoir reçu une formation formelle étaient des professeurs juniors et seniors, ce qui correspond aux exigences cliniques du niveau de la bourse de recherche pour une formation EEG formelle dans la plupart des contextes. La majorité des personnes interrogées ont utilisé une approche manuelle, que ce soit de manière isolée ou sous la forme d’un hybride manuel-automatique (stratégies 1 et 3 ; figure 2D), ce qui est généralement comparable à l’analyse de la littérature (figure 2A), comme prévu. Il est intéressant de noter qu’aucun article n’indiquait explicitement l’utilisation de la stratégie 4 (« agnostique »), bien que 9 % des répondants se soient identifiés comme tels, et que l’incorporation de méthodes automatisées (stratégies 2 et 3) était plus représentée dans les réponses à l’enquête (55 %) que dans l’analyse documentaire (14 %). Ces divergences pourraient toutefois s’expliquer par un biais de déclaration, étant donné les différents contextes des méthodes de manuscrits par rapport à une enquête directe, et par un biais d’échantillonnage (taux de réponse à l’enquête).
Préoccupations supplémentaires
Bien que cet article se concentre principalement sur les EEI, les dangers et les stratégies décrits ici peuvent et doivent être étendus à d’autres artefacts électriques ou non physiologiques (mouvements de câbles, pops d’électrodes, saturation de l’amplificateur, etc.), car ils peuvent impliquer des déflexions nettes similaires de grande amplitude. En ce qui concerne l’exclusion des canaux, les canaux présentant des DEI abondants sont particulièrement problématiques pour les méthodes automatisées qui reposent sur des estimations du bruit de fond. De plus, si l’on veut étudier la neurophysiologie normale, il faut exclure d’emblée ces canaux et tous ceux dont on sait qu’ils se trouvent dans des tissus lésionnels (Frauscher et al, 2018a) ; cette pratique était reflétée dans environ un tiers des manuscrits de notre revue de la littérature (figure 2A).
En ce qui concerne le contrôle expérimental approprié, il est souvent primordial que le marquage des IED soit effectué en aveugle des événements de la tâche et des conditions expérimentales (le plus pertinent pour les stratégies manuelles 1 et 3), afin d’éviter les biais qui pourraient influencer les résultats de l’étude (par exemple, retirer les essais avec des IED plus souvent d’une condition qu’une autre). En ce qui concerne les confusions potentielles dans les études basées sur des essais, on suppose souvent que les EEI se produisent de façon imprévisible, même au point d’être aléatoires : cette hypothèse est favorable si l’on laisse les EEI dans les données (Stratégie 4) puisque les faux positifs et négatifs seraient diminués par la moyenne des essais qui améliore le rapport signal-bruit neurophysiologique. Toutefois, il convient de noter que le moment où se produisent les EEI n’est pas nécessairement aléatoire dans une tâche comportementale. La modulation du moment ou de la quantité de DEI en fonction de la tâche a été décrite (Matsumoto et al., 2013), ce qui pourrait potentiellement brouiller les résultats en pondérant préférentiellement les résultats erronés dans certains segments d’essai plus que dans d’autres. Cela plaiderait contre l’utilisation de la stratégie 4, bien qu’encore une fois, l’énigme du nombre d’essais et de la puissance statistique peut être problématique comme indiqué ci-dessus.
En dernier lieu, en dehors des implications du traitement du signal, il convient de mentionner que les IED peuvent également perturber transitoirement le dysfonctionnement neuronal local de la région dans laquelle ils se produisent (Krauss et al., 1997 ; Kleen et al., 2013 ; Horak et al., 2017 ; Ung et al., 2017). Cela pourrait conduire à des erreurs cognitives qui pourraient influencer les analyses basées sur les essais et d’autres analyses, posant un argument distinct pour l’exclusion des essais avec des IED lors de la formulation de conclusions concernant le traitement cognitif « normal ».
Conclusions
L’accélération de la neurophysiologie intracrânienne humaine véhicule une grande excitation pour les découvertes et les capacités imminentes, y compris l’expansion des neurosciences fondamentales, l’amélioration de la thérapeutique clinique et le développement d’interfaces cerveau-machine. Cependant, les IED posent des pièges de résultats fallacieux, difficiles à éviter par la nature du tissu épileptique in vivo à partir duquel les données sont enregistrées. Une vigilance accrue est nécessaire pour éviter les EEI dans les données, le cas échéant, ce qui peut être rendu possible par l’examen et l’utilisation des stratégies énumérées ci-dessus. Nous suggérons également que les chercheurs de niveau intermédiaire et supérieur s’efforcent d’améliorer et de fournir des présentations ou des simulations de formation standardisées dans leurs laboratoires pour les méthodes d’identification, de détection et d’élimination des EEI. Cela permettra aux jeunes chercheurs d’acquérir un ensemble de compétences importantes pour comprendre et examiner de façon constructive leurs propres données et celles des autres. En outre, des améliorations dans la communication scientifique sont nécessaires (Suthana et al., 2018), de sorte que les manuscrits sur la neurophysiologie humaine normale devraient clairement transmettre l’approche utilisée pour traiter les EEI et sa justification dans le contexte de leur étude. De telles pratiques de vigilance accrue et de communication claire amélioreront, nous l’espérons, la reproductibilité afin que le domaine puisse poursuivre son accélération sans revers prévisibles.
Data Availability Statement
Les données d’enquête de cet article peuvent être téléchargées à partir du site doi : 10.5281/zenodo.3626105.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le conseil d’examen institutionnel de l’Université de Californie San Francisco. Le consentement éclairé écrit pour la participation n’était pas requis pour cette étude, conformément à la législation nationale et aux exigences institutionnelles.
Contributions des auteurs
SA et JK ont développé le concept du manuscrit, créé et distribué l’enquête, effectué la recherche documentaire et rédigé le manuscrit. ML et EC ont fourni des commentaires et des révisions importants au manuscrit. Tous les auteurs ont lu et approuvé le manuscrit soumis.
Funding
SA a été financé par un supplément de diversité NIH sous R01-DC012379. JK a été financé par les subventions R25NS070680 et K23NS110920 des National Institutes of Health/National Institute of Neurological Disorders and Stroke (NIH/NINDS). ML a été financée par les subventions NIH R01-DC015504, F32-DC013486 et l’Institut Kavli pour le cerveau et l’esprit et le contrat DARPA N66001-17-2-4008. EC a été financé par des subventions du NIH (R01-DC012379, R00-NS065120 et DP2-OD00862) et le Fonds Esther A. et Joseph Klingenstein.
Conflit d’intérêt
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Maxime Baud et Han Yi pour leurs discussions et commentaires utiles durant l’élaboration de ce manuscrit.
Andrews, J. P., Gummadavelli, A., Farooque, P., Bonito, J., Arencibia, C., Blumenfeld, H., et al. (2019). Association de la propagation des crises avec l’échec chirurgical dans l’épilepsie. JAMA Neurol. 76, 462-469. doi : 10.1001/jamaneurol.2018.4316
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkmeier, D. T., Shah, A. K., Flanagan, D., Atkinson, M. D., Agarwal, R., Fuerst, D. R., et al. (2012). High inter-reviewer variability of spike detection on intracranial EEG addressed by an automated multi-channel algorithm. Clin. Neurophysiol. 123, 1088-1095. doi : 10.1016/j.clinph.2011.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Baud, M. O., Kleen, J. K., Anumanchipalli, G. K., Hamilton, L. S., Tan, Y.-L., Knowlton, R., et al. (2018). Apprentissage non supervisé des décharges interictales spatiotemporelles dans l’épilepsie focale. Neurosurgery 83, 683-691. doi : 10.1093/neuros/nyx480
PubMed Abstract | CrossRef Full Text | Google Scholar
Bergstrom, R. A., Choi, J. H., Manduca, A., Shin, H.-S., Worrell, G. A., et Howe, C. L. (2013). Identification automatisée de plusieurs types d’événements épileptiformes liés aux crises et interictaux dans l’EEG de souris. Sci. Rep. 3:1483. doi : 10.1038/srep01483
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, E. F. (2015). Vers des neurotechnologies mésoscopiques à grande échelle et à base humaine. Neuron 86, 68-78. doi : 10.1016/j.neuron.2015.03.037
PubMed Abstract | CrossRef Full Text | Google Scholar
Chronux Home. (2019). Logiciel d’analyse Chronux. Disponible en ligne à : http://chronux.org/. Consulté le 25 septembre 2019.
Cuello Oderiz, C., von Ellenrieder, N., Dubeau, F., Eisenberg, A., Gotman, J., Hall, J., et al. (2019). Association de la crise induite par la stimulation corticale avec le résultat chirurgical chez les patients atteints d’épilepsie focale résistante aux médicaments. JAMA Neurol. 76, 1070-1078. doi : 10.1001/jamaneurol.2019.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Esteller, R., Echauz, J., Tcheng, T., Litt, B., et Pless, B. (2001). » Line length : an efficient feature for seizure onset detection « , dans les Actes de la conférence 2001 23e conférence internationale annuelle de la société IEEE Engineering in Medicine and Biology, Istanbul, Turquie : IEEE, 1707-1710.
Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Doležalová, I., Minotti, L., Olivier, A., et al. (2018a). Atlas de l’électroencéphalogramme intracrânien normal : activité neurophysiologique éveillée dans différentes zones corticales. Brain 141, 1130-1144. doi : 10.1093/brain/awy035
PubMed Abstract | CrossRef Full Text | Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Rogers, C., Khoa Nguyen, D., Kahane, P., et al. (2018b). Oscillations à haute fréquence dans le cerveau humain normal. Ann. Neurol. 84, 374-385. doi : 10.1002/ana.25304
PubMed Abstract | CrossRef Full Text | Google Scholar
Horak, P. C., Meisenhelter, S., Song, Y., Testorf, M. E., Kahana, M. J., Viles, W. D., et al. (2017). Les décharges épileptiformes interictales altèrent le rappel des mots dans plusieurs aires cérébrales. Epilepsia 58, 373-380. doi : 10.1111/epi.13633
PubMed Abstract | CrossRef Full Text | Google Scholar
Janca, R., Jezdik, P., Cmejla, R., Tomasek, M., Worrell, G. A., Stead, M., et al. (2015). Détection des décharges épileptiformes interictales en utilisant la modélisation de la distribution de l’enveloppe du signal : application aux enregistrements intracrâniens épileptiques et non épileptiques. Brain Topogr. 28, 172-183. doi : 10.1007/s10548-014-0379-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kleen, J. K., Scott, R. C., Holmes, G. L., Roberts, D. W., Rundle, M. M., Testorf, M., et al. (2013). L’activité épileptiforme interictale hippocampique perturbe la cognition chez l’homme. Neurology 81, 18-24. doi : 10.1212/wnl.0b013e318297ee50
PubMed Abstract | CrossRef Full Text | Google Scholar
Kramer, M. A., Tort, A. B. L., et Kopell, N. J. (2008). Artéfacts de bords aigus et couplage parasite dans les mesures de comodulation de fréquence EEG. J. Neurosci. Methods 170, 352-357. doi : 10.1016/j.jneumeth.2008.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Krauss, G. L., Summerfield, M., Brandt, J., Breiter, S., and Ruchkin, D. (1997). Mesial temporal spikes interfèrent avec la mémoire de travail. Neurology 49, 975-980. doi : 10.1212/wnl.49.4.975
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Coon, W. G., de Pesters, A., Brunner, P., et Schalk, G. (2015). Les effets du filtrage spatial et des artefacts sur les signaux électrocorticographiques. J. Neural Eng. 12:056008. doi : 10.1088/1741-2560/12/5/056008
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsumoto, J. Y., Stead, M., Kucewicz, M. T., Matsumoto, A. J., Peters, P. A., Brinkmann, B. H., et al. (2013). Les oscillations du réseau modulent le taux de pointes épileptiformes interictales pendant la mémoire humaine. Brain 136, 2444-2456. doi : 10.1093/brain/awt159
PubMed Abstract | CrossRef Full Text | Google Scholar
Meisler, S. L., Kahana, M. J., et Ezzyat, Y. (2019). Le nettoyage des données améliore-t-il la classification des états cérébraux ? J. Neurosci. Methods 328:108421. doi : 10.1016/j.jneumeth.2019.108421
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitra, P., et Bokil, H. (2007). Dynamique cérébrale observée. New York, NY : Oxford University Press.
Google Scholar
Parvizi, J., et Kastner, S. (2018). Promesses et limites de l’électroencéphalographie intracrânienne humaine. Nat. Neurosci. 21, 474-483. doi : 10.1038/s41593-018-0108-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., et Hsiao, S. S. (2008). Neural correlates of high-gamma oscillations (60-200 Hz) in macaque local field potentials and their potential implications in electrocorticography. J. Neurosci. 28, 11526-11536. doi : 10.1523/JNEUROSCI.2848-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Scheffer-Teixeira, R., Belchior, H., Leão, R. N., Ribeiro, S., et Tort, A. B. L. (2013). Sur les oscillations de champ à haute fréquence (>100 Hz) et la fuite spectrale de l’activité de spiking. J. Neurosci. 33, 1535-1539. doi : 10.1523/JNEUROSCI.4217-12.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Suthana, N., Aghajan, Z. M., Mankin, E. A., et Lin, A. (2018). Directives de déclaration et questions à considérer pour l’utilisation de la stimulation cérébrale intracrânienne dans les études de la mémoire déclarative humaine. Front. Neurosci. 12:905. doi : 10.3389/fnins.2018.00905
PubMed Abstract | CrossRef Full Text | Google Scholar
Tousseyn, S., Dupont, P., Robben, D., Goffin, K., Sunaert, S., et Van Paesschen, W. (2014). Une analyse semi-automatique fiable et économe en temps, basée sur les modèles de pointes, de l’EEG-IRM interictal. Epilepsia 55, 2048-2058. doi : 10.1111/epi.12841
PubMed Abstract | CrossRef Full Text | Google Scholar
Ung, H., Cazares, C., Nanivadekar, A., Kini, L., Wagenaar, J., Becker, D., et al. (2017). L’activité épileptiforme interictale en dehors de la zone d’apparition de la crise a un impact sur la cognition. Brain 140, 2157-2168. doi : 10.1093/brain/awx143
PubMed Abstract | CrossRef Full Text | Google Scholar
van Drongelen, W. (2018). Le traitement du signal pour les neuroscientifiques. Londres : Elsevier Academic press.
Google Scholar
Westover, M. B., Halford, J. J., et Bianchi, M. T. (2017). Ce que cela devrait signifier pour un algorithme de passer un test de turing statistique pour la détection des décharges épileptiformes. Clin. Neurophysiol. 128, 1406-1407. doi : 10.1016/j.clinph.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
White, A. M., Williams, P. A., Ferraro, D. J., Clark, S., Kadam, S. D., Dudek, F. E., et al. (2006). Efficient unsupervised algorithms for the detection of seizures in continuous eeg recordings from rats after brain injury. J. Neurosci. Methods 152, 255-266. doi : 10.1016/j.jneumeth.2005.09.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilke, C., van Drongelen, W., Kohrman, M., et He, B. (2009). Identification des foyers épileptogènes à partir de l’analyse causale de l’activité des pointes interictales de l’ECoG. Clin. Neurophysiol. 120, 1449-1456. doi : 10.1016/j.clinph.2009.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar
.