La coloscopie pour le dépistage du cancer du côlon est efficace à la fois pour réduire la mortalité par la détection précoce et pour la prévention par l’élimination des polypes précancéreux (1-8). Ces bénéfices pourraient toutefois être contrebalancés par l’insuffisance de la qualité de la coloscopie et par des complications (9-17). Les polypes manqués et la polypectomie incomplète peuvent contribuer au développement de cancers d’intervalle (cancers détectés après une coloscopie) (10-14, 18, 19). Bien que l’hémorragie post-coloscopie soit relativement rare, se produisant dans 1-6/1000 (15-17), elle est la principale complication entraînant des visites hospitalières non planifiées dans les 7 jours suivant la coloscopie (20). La polypectomie en est le principal responsable (21-26). Les facteurs de risque qui augmentent les saignements post-polypectomie comprennent la taille des polypes, le nombre de polypes, le traitement anticoagulant et l’histologie des polypes (17, 21, 27, 28). Les techniques avancées de polypectomie telles que la résection muqueuse endoscopique (RME) et la dissection sous-muqueuse endoscopique (DSE) semblent retirer plus complètement les polypes, mais augmentent également la durée de la procédure, le coût et les risques de saignement (17, 29-31).
En dehors de la RME et de la DSE, peu d’attention a été accordée à la technique de polypectomie en tant que facteur de risque de saignement postpolypectomie. En effet, la technique traditionnelle de polypectomie au collet, généralement acceptée et largement utilisée, qui consiste à guillotiner le polype piégé avec ou sans coagulation thermique, n’a pas beaucoup changé depuis près de 5 décennies (32-37). Afin de prévenir les saignements post-polypectomie, l’un des auteurs (ZJC) a mis au point la technique du stripping muqueux endoscopique (EMS), une modification de la polypectomie traditionnelle à l’aide d’un collet froid (TCSP), afin d’éviter de couper la sous-muqueuse riche en vaisseaux sanguins. En effet, tous les polypes non cancéreux, qui constituent le type de polypes le plus fréquemment observé lors des coloscopies de dépistage, sont par définition confinés à la muqueuse et ne s’étendent pas dans la sous-muqueuse. La décision a été prise le 31 décembre 2012 d’adopter systématiquement cette innovation technique car l’EMS a montré un succès précoce dans l’élimination complète des polypes non pédiculés sans lésion substantielle de la sous-muqueuse. Ce rapport a analysé l’efficacité de l’EMS dans la prévention des saignements postpolypectomie et la facilitation de l’ablation complète des polypes, en particulier pour les polypes avancés à haut risque.
- Méthodes
- Patients et conception de l’étude
- Décapage endoscopique de la muqueuse (EMS)
- Évaluation des résultats
- Coloscopie Examen
- Analyse statistique
- Résultats
- Le SMU a prévenu les hémorragies postpolypectomie nécessitant une hospitalisation
- Polypectomie complète facilitée par l’EMS
- Discussion
- Déclaration éthique
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Matériel supplémentaire
- Abréviations
Méthodes
Patients et conception de l’étude
Il s’agissait d’une enquête rétrospective des données intégrant le dossier médical électronique et les lames de pathologie au Minnesota Gastroenterology, PA (MNGI). Une exemption de l’Internal Review Board a été accordée pour l’enquête. Les patients étaient ceux qui avaient subi une coloscopie avec polypectomie au collet sous le code 45385 de la terminologie procédurale courante (CPT) par ZJC dans les centres d’endoscopie ambulatoires du MNGI au cours d’une période de 12 ans divisée en ère pré-EMS (2005-2012) et ère EMS (2013-2016). Une recherche dans la base de données a été effectuée pour les cas de saignement postpolypectomie nécessitant une hospitalisation et les polypes avancés définis comme des polypes présentant des caractéristiques villositaires, une dysplasie de haut grade, un adénome dentelé sessile avec dysplasie cytologique (SSACD) ainsi que tous les polypes adénomateux de 10 mm ou plus. Parce que le MNGI avait une couverture étendue de la pratique locale et une ligne téléphonique de complication avec du personnel 24 heures sur 24, il avait un taux de capture presque complet pour les complications qui ont été examinées par des pairs et renvoyées aux endoscopistes impliqués pour l’amélioration de la qualité.
Décapage endoscopique de la muqueuse (EMS)
Le décapage endoscopique de la muqueuse (EMS) est l’élimination endoscopique de la muqueuse contenant des polypes par décapage mécanique à l’aide d’un collet froid. Il s’agit d’une modification de la TCSP en ce sens que l’EMS détache la muqueuse de la sous-muqueuse piégée au niveau de l’espace potentiel qui les sépare (figure 1, vidéo supplémentaire) plutôt que de guillotiner l’ensemble du tissu piégé comme cela a été décrit à l’origine pour la TCSP (36, 37). L’EMS devrait donc minimiser les lésions de la sous-muqueuse et les saignements immédiats et tardifs associés. Pour les rares polypes pédiculés, nous utilisons toujours la polypectomie par cautérisation à chaud, car les lésions tissulaires induites par la cautérisation peuvent être largement limitées au pédoncule intraluminal et ne s’étendent pas profondément dans la paroi colique. Par conséquent, nous avons appliqué l’EMS exclusivement aux polypes non pédiculés sans caractéristiques évocatrices de malignité. Ci-dessous, nous détaillons les spécificités des techniques de SME en fonction de la taille du polype.
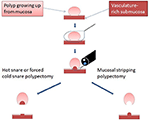
Figure 1. Diagramme illustrant la différence essentielle entre l’EMS et la polypectomie traditionnelle au collet. Réimprimé à partir de Chen et Batts (38), Copyright (2017) avec la permission d’Elsevier pour une utilisation en tant que contenu en libre accès sous licence d’utilisation CC-BY.
Pour les petits polypes (≤ 5 mm), l’EMS fonctionne généralement bien. Pour assurer une résection complète, nous préférons le collet aux pinces à biopsie, sauf pour les polypes diminutifs de 2 mm ou moins (25) et nous enlevons systématiquement 2 à 3 mm de muqueuse adjacente pendant la polypectomie. Cependant, la sous-muqueuse peut rester coincée à l’intérieur du collet, ce qui empêche la fermeture complète du collet sans l’aide d’une guillotine ou d’une coagulation thermique (collet chaud). Dans ce cas, le fait de tirer doucement et régulièrement le collet dans le scope tout en maintenant le collet fermement mais pas hermétiquement fermé permet généralement de retirer la muqueuse contenant les polypes, laissant derrière elle la sous-muqueuse piégée qui forme un pseudo-raccord transitoirement surélevé (figure 2A). À l’endoscopie, la muqueuse décollée est généralement en un seul morceau, tandis que la sous-muqueuse reste largement intacte, sans dommage pour les vaisseaux sanguins (figure 2B). La déchirure muqueuse causée par le SME crée généralement un site de polypectomie légèrement plus grand mais beaucoup moins sanglant que celui qui serait causé par le TCSP. Pour que le SME soit efficace, il est essentiel de maintenir le collier fermement, mais pas trop, fermé pendant le stripping. Une fermeture insuffisante du collier entraînera un glissement du collier, tandis qu’une fermeture trop serrée entraînera des dommages sous-muqueux tels que la formation d’un hématome et l’échec du stripping. Un endoscopiste expérimenté peut facilement percevoir cette subtilité et indiquer à l’infirmière d’endoscopie assistante d’ajuster la fermeté appropriée de la prise lors de la traction du collet.
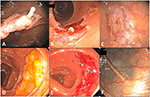
Figure 2. Polypectomies EMS. (A) Pseudo-étiquette sous-muqueuse après polypectomie d’un adénome tubulaire cæcal sessile de 10 mm. (B) Un morceau intact de muqueuse contenant un polype après l’ablation (en haut à droite) et le site de polypectomie sans polype avec une pseudo-tige visible (en bas à gauche). (C) Un site de polypectomie propre sans déformation malgré un suintement capillaire transitoire mineur immédiatement après la polypectomie. Le soulèvement de la muqueuse piégée a permis d’éviter le développement de la pseudo-tige. (D) Adénome dentelé sessile du côlon transversal de 30 mm. (E) Site de polypectomie de (D) après polypectomie par morceaux. (F) Même site de polypectomie tatoué que (E) 1 an plus tard.
Bien que le piégeage sous-muqueux puisse être évité pour les polypes plus petits en plaçant le collet de manière optimale et en soulevant doucement le polype, cela peut devenir inévitable avec l’élimination de polypes plus importants. Bien que la technique décrite ci-dessus s’applique toujours, la sous-muqueuse piégée empêche souvent la séparation du collet du site de polypectomie, même après que la muqueuse contenant le polype ait été enlevée. Dans de telles circonstances, il n’est pas nécessaire de tirer davantage le collet par la force brute. Au contraire, il suffit d’ouvrir légèrement le collier et de le faire glisser sur la sous-muqueuse piégée pour libérer le collier et toute muqueuse contenant des polypes qui a été enlevée mais qui semble encore attachée au site de polypectomie. La sous-muqueuse piégée de ces plus grands polypes forme fréquemment une pseudo-tige plus épaisse, mais les lésions sous-muqueuses restent minimes.
Pour les polypes encore plus grands qui ne peuvent pas être retirés en un seul morceau, une polypectomie par morceaux EMS peut être réalisée. Comme l’absence de lésion sous-muqueuse de l’EMS crée un site de polypectomie moins sanglant ou déformé par rapport à la polypectomie traditionnelle par collet froid ou chaud, tout tissu de polype résiduel est mieux visualisé, ce qui facilite l’élimination complète du polype (figure 2).
Évaluation des résultats
1. Taux de saignement postpolypectomie nécessitant une hospitalisation pour tous les polypes du côlon et les polypes non pédiculés avant et après l’adoption de l’EMS.
2. Exhaustivité de l’élimination des polypes par SME déterminée par la biopsie du site de polypectomie et l’examen lors de la coloscopie de suivi aux intervalles recommandés par les directives des sociétés nationales (13, 14).
Coloscopie Examen
Les coloscopies ont été réalisées à l’aide de coloscopes à rigidité variable (PCF 160, CF 160, PCF 180 et CF 180 ; Olympus Corp. Tokyo, Japon) pour la plupart des cas et de coloscopes à spectre complet FUSE (EndoChoice, Alpharetta, Géorgie) pour quelques cas dans le cadre d’un essai. Les polypectomies ont été réalisées en utilisant principalement des collets ovales (100600 à 100602, ConMed, Utica, NY) et, dans quelques cas, des collets en spirale (SD-230U-20, Olympus Corp, Tokyo, Japon) et des collets Exacto (BX00711115, US Endoscopy, Mentor, OH).
Dans le cadre de la mesure de la qualité du MNGI, les statistiques annuelles de coloscopie suivantes ont été rapportées pour ZJC pour 2014 et 2016 : taux d’atteinte du cæcum de 99,5 à 100 %, taux de détection de polypes adénomateux par coloscopie de dépistage de 50,3 à 60,1 % pour les hommes et de 42.1-54,0% pour les femmes.
Analyse statistique
L’analyse statistique a été réalisée à l’aide du test exact de Fisher.
Résultats
Le SMU a prévenu les hémorragies postpolypectomie nécessitant une hospitalisation
Un total de 5 142 coloscopies avec polypectomie au collet réalisées par ZJC dans les centres d’endoscopie ambulatoire du MNGI pendant 12 ans ont été divisées en ère pré- SMU (2005-2012, n = 2973) et ère SMU (2013-2016, n = 2169) (tableau 1). La dernière hémorragie post-polypectomie nécessitant une hospitalisation est survenue en septembre 2012. Aucun n’a été trouvé pendant l’ère EMS (taux 0%) alors que dix (dont 2 polypes pédonculés) ont été trouvés pendant l’ère pré-EMS (taux 0,336%). Les hospitalisations ont eu lieu 1 à 16 jours après les coloscopies. Cette différence était statistiquement significative (P = 0,0055) et le restait après exclusion des 2 cas de polypes pédonculés (P = 0,012).
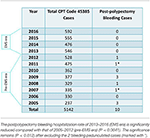
Tableau 1. Cas de saignement post-polypectomie et cas de polypectomie totale au collet (code CPT #45385) en 12 ans.
Sur les 12 cas de saignement, un total de 18 polypes ont été retirés. À l’exception de deux adénomes tubulaires (AT) de 2-3 mm qui ont été retirés à l’aide d’un collet froid, tous ont été retirés à l’aide d’un collet chaud. Il s’agissait de dix TA de 8-40 mm (dont deux polypes pédonculés de 11-15 mm et 36-40 mm, respectivement), d’un adénome tubulovilliforme (TVA) de 25 mm, de quatre adénomes dentelés sessiles (SSA) de 6-10 mm et d’un lipome de 5 mm. À l’exception d’un cas qui n’a bénéficié que d’une extraction partielle du polype réséqué et qui n’avait pas de sous-muqueuse au microscope, les neuf autres cas présentaient des signes de sous-muqueuse cautérisée, souvent avec des vaisseaux sanguins visibles près du bord cautérisé, comme l’illustre la figure 3C. Ces résultats indiquent que les dommages sous-muqueux pendant la polypectomie par collet chaud ont contribué aux saignements post-polypectomie.
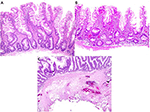
Figure 3. Comparaison histopathologique de polypes avancés enlevés avec une polypectomie par EMS et par collier chaud. (A,B) Les polypes retirés à l’aide de l’EMS présentent généralement un aspect profond de la musculeuse avec une paucité de la sous-muqueuse et une absence de vaisseaux sanguins. (C) Le faible grossissement d’un polype retiré à l’aide d’un collet chaud montre une quantité typique de sous-muqueuse avec des dommages tissulaires causés par la cautérisation.
Pour comparaison, nous avons également examiné au microscope 20 cas consécutifs de polypes du côlon avancés retirés à l’aide de l’EMS. Ces polypes ne contenaient qu’une quantité variable de musculeuse et une sous-muqueuse peu abondante, voire inexistante, sans vaisseaux sanguins (tableau 2, figures 3A,B). Ces résultats indiquent que l’EMS a prévenu les saignements post-polypectomie en évitant les dommages sous-muqueux.
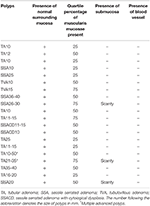
Tableau 2. Caractéristiques de 20 cas consécutifs de polypes avancés du côlon enlevés à l’aide d’un EMS.
Polypectomie complète facilitée par l’EMS
Des biopsies extensives ont été réalisées sur le bord (x4) et la pseudo-tige (x1) de 10 sites de polypes avancés choisis au hasard après une ablation complète par endoscopie à l’aide d’un EMS. Aucun résidu de polype n’a été trouvé dans les échantillons. Quatre-vingt-dix-sept sites de polypectomie néoplasique par SME ont été suivis de 6 mois à 4 ans, dont 38 sites de polypectomie chez 23 patients après ablation de polypes avancés. Aucun des 59 sites de polypes néoplasiques non avancés (< 10 mm et sans caractéristiques avancées) n’a présenté de polypes résiduels ou récurrents lors de la coloscopie de suivi. La grande majorité (33 sur 38 ; 87 %) des sites de polypes avancés ne présentaient pas non plus de polypes lors de la coloscopie de suivi (tableau 3). Deux petits polypes ont été trouvés près du site du polype n° 12 un an plus tard, mais ils étaient d’un type différent de l’original (SSA vs TA). En ce qui concerne les polypes 13, 22 et 25, bien que les coloscopies de suivi effectuées 1 à 3,5 ans plus tard aient permis de trouver un petit polype (2 à 5 mm) du même type (TA) près du site de polypectomie initial dans chaque cas, il a été difficile de déterminer si les polypes étaient nouvellement formés ou s’il s’agissait de résidus, car ils sont tous survenus dans des cas de polypose où 24, 10 et 14 polypes adénomateux avaient été enlevés lors des coloscopies initiales et de suivi combinées, respectivement. Un type différent de petits polypes (SSA plutôt que TA) a également été découvert près des sites de polypectomie originaux des polypes n° 13 et n° 25 lors de la coloscopie de suivi, ce qui suggère une nouvelle croissance des polypes plutôt qu’une polypectomie incomplète. Un SSA de 10 mm a été trouvé 14 mois plus tard derrière un pli près du site de polypectomie tatoué du SSA plat de 50 mm (#26). Il pourrait s’agir d’une polypectomie incomplète, peut-être en raison de la taille extra-large du polype original, mais il pourrait aussi s’agir d’un polype séparé en expansion qui a échappé à la coloscopie originale en raison de son emplacement très caché derrière un pli que l’on voit mieux en rétroflexion (Figure 4). Ainsi, aucun cas convaincant et au plus 4/97 (4,1 %) de tous les polypes néoplasiques suivis ou 4/38 (10,5 %) des polypes avancés retirés à l’aide du SME présentaient une polypectomie incomplète. Ces taux se comparent très favorablement à ceux rapportés pour les techniques traditionnelles de polypectomie au collet (18).
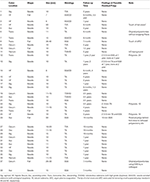
Tableau 3. Suivi de 38 polypes avancés du côlon enlevés à l’aide du SME chez 23 patients.
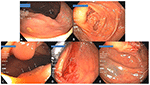
Figure 4. (A) Un grand adénome dentelé sessile de 50 mm (Polyp#26 dans le tableau 3) dans le côlon ascendant proximal avec la VCI visible en arrière-plan (flèche). (B) Vue d’ensemble du site de polypectomie 14 mois plus tard avec un des tatouages visible à droite (flèches). (C) Un SSA de 10 mm caché derrière un pli (flèches) près du site de polypectomie. (D) Site de polypectomie du polype de (C) sur une vue en rétroflexion. (E) Espace relatif d’un des tatouages (en bas à gauche) et du pli derrière lequel se cachait le polype en (C) (flèche).
Discussion
Nos analyses de données confirment que l’EMS a empêché les saignements postpolypectomie et a facilité l’élimination complète des polypes par rapport aux techniques traditionnelles de polypectomie au collet. L’EMS pourrait donc rendre la coloscopie plus sûre et plus efficace en tant qu’outil de prévention du cancer du côlon.
Les complications liées à la coloscopie, telles que les hémorragies et les perforations postpolypectomie, se produisent en raison de la blessure de la sous-muqueuse et des tissus plus profonds. De telles blessures ne sont pas nécessaires pour enlever les polypes précancéreux du côlon et doivent être évitées.
La sous-muqueuse est riche en tissu conjonctif et en vaisseaux sanguins. Son piégeage se produit souvent pendant la polypectomie du collet empêchant la fermeture complète du collet sans guillotine à force brute ou coagulation à chaud. La technique TCSP, qui consiste à guillotiner l’ensemble du tissu piégé, endommage la sous-muqueuse piégée, mais dans une moindre mesure que la technique du collet chaud (39). L’augmentation du taux de saignement immédiat avec la TCSP, nécessitant une intervention hémostatique telle que le clippage, pourrait non seulement nuire à la détection des résidus de polypes, mais aussi limiter son application aux polypes de grande taille (39-42). En évitant de couper entièrement la sous-muqueuse, le SME prévient les saignements immédiats et différés et semble sûr pour les polypes plus grands, même sans arrêter les traitements anticoagulants et antiplaquettaires (figure 5).

Figure 5. (A) Adénome dentelé sessile transversal du côlon de 15 mm avec dysplasie cytologique (polype n° 7 du tableau 3). (B) Site de polypectomie immédiatement après l’ablation du polype de (A). (C) Même site de polypectomie que (B) 6 mois plus tard. Ce patient n’a pas arrêté le clopidogrel au moment de la polypectomie. Compte tenu du profil de sécurité de l’EMS, la décision a été prise de procéder à la polypectomie en considérant qu’elle pourrait avoir une coloscopie répétée difficile en raison de son âge avancé (4 mois avant l’âge de 80 ans) et d’un côlon long et tortueux avec constipation. Elle a finalement subi une coloscopie 6 mois plus tard pour l’histopathologie à haut risque du polype.
Une préoccupation potentielle est l’exhaustivité de la polypectomie du SGE, en particulier dans le pseudo-stalk. Nos données de biopsie du site de polypectomie et l’analyse par d’autres du pseudo-tronc après une polypectomie au collet froid (43) ont montré une élimination complète des polypes. Cette conclusion est étayée par la fréquence à laquelle nous avons détecté d’éventuels polypes résiduels aux sites de polypectomie du SME lors de la coloscopie de suivi (probablement 0 % et au maximum 4,1 % de tous les polypes néoplasiques ou 10,5 % de polypes avancés), ce qui est beaucoup plus faible que ce qui a été rapporté précédemment (18). En se basant sur des échantillonnages des bords des polypectomies endoscopiques » complètes « , Pohl et al ont noté des néoplasmes persistants inattendus dans 10,1 % de toutes les polypectomies, 17,3 % des polypes néoplasiques de 10-20 mm, des taux plus élevés pour les SSA que pour les TA (31 contre 7,2 %), et 47,6 % de tous les grands SSA (10-20 mm) ont été enlevés de manière incomplète (18). Zhang et al. ont également rapporté des TCSP incomplètes de polypes (6-9 mm) (8,5 % en moyenne et 13 % pour la résection par morceaux) avec des saignements immédiats nécessitant un clippage survenant à un taux de 1,8 et 2,7 % par polype et par patient, respectivement (40). Cette différence s’explique probablement par le fait que les sites de polypectomie de l’EMS étaient moins traumatisants, avec des saignements ou des déformations minimes par rapport à ceux de la polypectomie traditionnelle par collier froid ou chaud. Cela a non seulement facilité la détection et l’élimination des résidus de polype, mais a également permis une résection muqueuse plus généreuse sans crainte de saignement ou d’autres complications. La polypectomie complète est importante pour prévenir les cancers du côlon d’intervalle, qui représentent 2,6 à 9,0 % de l’ensemble des cancers du côlon (19).
Les polypes pédiculés peuvent présenter un risque élevé de saignement postpolypectomie, car une blessure sous-muqueuse est inévitable. Le gain d’expérience peut avoir conduit à une réduction des saignements de ces polypes rares, car ZJC a déplacé la coupe loin de la paroi du côlon et près du polype sur le pédoncule. Mais la réduction des saignements post-polypectomie dus aux polypes pédonculés avant et après le SME n’était pas statistiquement significative. Nous pensons que c’est le SME plutôt que le gain d’expérience qui a conduit à l’élimination des saignements postpolypectomie des polypes non pédiculés.
Un hématome pourrait rarement se développer à partir d’un vaisseau sous-muqueux déchiré pendant le SME de grands polypes. Cependant, la sous-muqueuse intacte empêche tout hématome de s’élargir et de se vider de son sang. Dans notre expérience, la barrière naturelle fournie par la sous-muqueuse intacte semblait supérieure à la coagulation fournie par le collier chaud pour prévenir les saignements postpolypectomie tardifs.
Par rapport à l’EMS, l’EMS est beaucoup plus facile à réaliser et peut atteindre le même résultat de polypectomie même pour certaines grandes lésions à propagation latérale (tableau 3) sans ressources supplémentaires et avec un risque de saignement beaucoup plus réduit. D’autres études sont nécessaires pour comparer directement l’EMS et l’EMR, en particulier pour l’ablation de gros polypes.
Parce que l’EMS n’enlève que la muqueuse, tout cancer précoce avec invasion sous-muqueuse est hors de sa portée. À noter que nous avons rencontré un cas de polype sessile cancéreux du côlon de 10 mm insoupçonné pendant la période d’étude. Fait intéressant, le site de polypectomie a continué à suinter et a nécessité un hémoclipping. Le diagnostic n’a été obtenu qu’après l’ablation du polype et le patient a ensuite été envoyé en chirurgie sans incidence. Le diagnostic de motif de fosse agrandi aurait pu être utile pour un prédiagnostic dans ce cas et un examen minutieux du polype est toujours encouragé avant la SME pour éviter de couper un polype cancéreux. Cependant, aucune issue défavorable n’est survenue dans ce cas.
La SME peut être réalisée avec des collets spiralés ou Exacto et en combinaison avec une injection sous-muqueuse pour soulever la muqueuse, une coagulation au plasma d’argon ou une ablation de l’extrémité chaude du collet. Il reste à voir si elles améliorent encore l’efficacité de l’EMS.
L’EMS a été adoptée avec succès par pas mal de collègues MNGI (tableau 3, n°37-38) mais la généralisation de ses avantages nécessite des études de confirmation supplémentaires. Néanmoins, cette innovation relativement simple mais efficace dans la technique de polypectomie pourrait représenter une nouvelle frontière pour une prévention plus sûre et plus efficace du cancer du côlon par coloscopie.
Déclaration éthique
Cette étude rétrospective a reçu une exemption de la détermination de l’examen de l’IRB le 12 mai 2016 (IRB ID : 5502) par Sterling IRB (www.sterlingirb.com) et a été réalisée conformément au protocole approuvé de Clinical and Histopathological Review of Mucosal Stripping as a Colonoscopy Polypectomy Technical Innovation et aux recommandations du Minnesota Gastroenterology Quality Committee. Tous les sujets ont donné un consentement éclairé écrit aux procédures de coloscopie et au traitement conformément à la Déclaration d’Helsinki.
Contributions des auteurs
ZC a initié le concept et la conception de l’enquête, l’acquisition, l’analyse et l’interprétation des données, la rédaction et la révision du manuscrit. KB a participé à l’acquisition, l’analyse et l’interprétation des données ainsi qu’à la révision critique du manuscrit.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Douglas Nelson MD, Robert Ganz MD, John Allen MD, David Lieberman MD, Douglas Rex MD, Linda Rabeneck MD, Aasma Shaukat MD, Zong-ming Eric Chen MD PhD, Jeffrey Rank MD, Joshua Colton MD et Cecil Chally MD pour leur revue critique et leurs suggestions utiles, Zengri Wang et Yongquan Xue PhD pour leur assistance dans l’analyse statistique, Brian Hardwig pour son aide dans la mise en place de l’enregistrement vidéo, Carlie Leyde, Amy Lounsbury, Martha Carland, JaNelle Gorg, Siri McCord, Karen Lang et Marit Brock pour leur assistance administrative. Nous remercions également les infirmières d’endoscopie de Minnesota Gastroenterology pour l’aide à la polypectomie du SAMU.
Un poster des résultats préliminaires de cette enquête a été présenté à la DDW 2017 à Chicago, aux États-Unis. Un résumé de l’affiche a été publié dans Gastrointestinal Endoscopy 2017 ; 85:AB520.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fmed.2018.00312/full#supplementary-material
Abréviations
EMS, stripping muqueux endoscopique ; EMR, résection muqueuse endoscopique ; ESD, dissection sous-muqueuse endoscopique ; TCSP, polypectomie traditionnelle au collet froid ; TA, adénome tubulaire ; TVA(HD), adénome tubulovillaire (avec dysplasie de haut grade) ; SSA(CD), adénome dentelé sessile (avec dysplasie cytologique) ; CU, colite ulcéreuse.
1. Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. Le groupe de travail de l’étude nationale sur les polypes. N Engl J Med. (1993) 329:1977-81. doi : 10.1056/NEJM199312303292701
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med. (2012) 366:687-96. doi : 10.1056/NEJMoa1100370
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. Incidence et mortalité à long terme du cancer colorectal après une endoscopie inférieure. N Engl J Med. (2013) 369:1095-105. doi : 10.1056/NEJMoa1301969
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Amri R, Bordeianou LG, Sylla P, Berger DL. Impact de la coloscopie de dépistage sur les résultats de la chirurgie du cancer du côlon. JAMA Surg. (2013) 148:747-54. doi : 10.1001/jamasurg.2013.8
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brenner H, Stock C, Hoffmeister M. Effet de la sigmoïdoscopie de dépistage et de la coloscopie de dépistage sur l’incidence du cancer colorectal et la mortalité : revue systématique et méta-analyse des essais contrôlés randomisés et des études observationnelles. BMJ (2014) 348:g2467-78. doi : 10.1136/bmj.g2467
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Sonnenberg A, Delcò F, Inadomi JM. Coût-efficacité de la coloscopie dans le dépistage du cancer colorectal. Ann Intern Med. (2000) 133:573-84. doi : 10.7326/0003-4819-133-8-200010170-00007
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Cost-effectiveness of colorectal cancer screening. Epidemiol Rev. (2011) 33:88-100. doi : 10.1093/epirev/mxr004
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Lieberman DA Dépistage du cancer colorectal chez les personnes à risque moyen : méthodes actuelles et problèmes émergents. JAMA Intern Med. (2014) 174:10-11. doi : 10.1001/jamainternmed.2013.11499
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Temps de retrait coloscopique et détection des adénomes pendant la coloscopie de dépistage. N Engl J Med. (2006) 355:2533-41. doi : 10.1056/NEJMoa055498
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, et al. Indicateurs de qualité pour la coloscopie et le risque de cancer de l’intervalle. N Engl J Med. (2010) 362:1795-803. doi : 10.1056/NEJMoa0907667
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, et al. Taux de détection des adénomes et risque de cancer colorectal et de décès. N Engl J Med. (2014) 370:1298-306. doi : 10.1056/NEJMoa1309086
CrossRef Full Text | Google Scholar
12. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy : a systematic review. Am J Gastroenterol. (2006) 101:343-50. doi : 10.1111/j.1572-0241.2006.00390.x
CrossRef Full Text | Google Scholar
13. Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Lignes directrices pour la surveillance par coloscopie après le dépistage et la polypectomie : une mise à jour du consensus par le groupe de travail multisociété américain sur le cancer colorectal. Gastroenterology (2012) 143:844-57. doi : 10.1053/j.gastro.2012.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB, et al. Indicateurs de qualité pour la coloscopie. Gastrointest Endosc. (2015) 81:31-53. doi : 10.1016/j.gie.2014.07.058
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Waye JD, Lewis BS, Yessayan S. Colonoscopy : a prospective report of complications. J Clin Gastroenterol. (1992) 15:347-51. doi : 10.1097/00004836-199212000-00018
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ko CW, Dominitz JA. Complications de la coloscopie : ampleur et gestion. Gastrointest Endosc Clin N Am. (2010) 20:659-71. doi : 10.1016/j.giec.2010.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ASGE Standards of Practice Committee, Fisher, DA, Maple, JT, Ben-Menachem, T, Cash, BD, Decker, GA, et al. Complications of colonoscopy. Gastrointest Endosc. (2011) 74:745-52. doi : 10.1016/j.gie.2011.07.025
CrossRef Full Text | Google Scholar
18. Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Résection incomplète de polypes pendant une coloscopie – résultats de l’étude CARE (complete adenoma resection). Gastroenterology (2013) 144:74-80. doi : 10.1053/j.gastro.2012.09.043
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Adler J, Robertson DJ. Intervalle de cancer colorectal après coloscopie : exploration des explications et des solutions. Am J Gastroenterol. (2015) 110:1657-64. doi : 10.1038/ajg.2015.365
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Ranasinghe I, Parzynski CS, Searfoss R, Montague J, Lin Z, Allen J, et al. Differences in colonoscopy quality among facilities : development of a post-colonoscopy risk-standardized rate of unplanned hospital visits. Gastroenterology (2016) 150:103-13. doi : 10.1053/j.gastro.2015.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Rosen L, Bub DS, Reed JF, Nastasee SA. Hémorragie après une polypectomie coloscopique. Dis Colon Rectum. (1993) 36:1126-31. doi : 10.1007/BF02052261
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Gibbs DH, Opelka FG, Beck DE, Hicks TC, Timmcke AE, Gathright JB. Hémorragie colique post-polypectomie. Dis Colon Rectum. (1996) 39:806-10. doi : 10.1007/BF02054448
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Hémorragie digestive basse postpolypectomie : analyse descriptive. Gastrointest Endosc. (2000) 51:690-6. doi : 10.1067/mge.2000.105773
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, et al. Complications of colonoscopy in an integrated health care delivery system. Ann Intern Med. (2006) 145:880-6. doi : 10.7326/0003-4819-145-12-200612190-00004
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Tolliver KA, Rex DK. La polypectomie coloscopique. Gastroenterol Clin North Am. (2008) 37:229-51, ix. doi : 10.1016/j.gtc.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Rabeneck L, Paszat LF, Hilsden RJ, Saskin R, Leddin D, Grunfeld E, et al. Bleeding and perforation after outpatient colonoscopy and their risk factors in usual clinical practice. Gastroenterology (2008) 135:1899-906. doi : 10.1053/j.gastro.2008.08.058
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, et al. Événements indésirables après une coloscopie ambulatoire dans la population Medicare. Ann Intern Med. (2009) 150:849-57. doi : 10.7326/0003-4819-150-12-200906160-00008
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Facteurs de risque de saignement postpolypectomie retardé grave. Endoscopy (2008) 40:115-9. doi : 10.1055/s-2007-966959
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions. Endoscopy (2011) 43:506-11. doi : 10.1055/s-0030-1256346
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Bahin FF, Rasouli KN, Byth K, Hourigan LF, Singh R, Brown GJ, et al. Prediction of clinical significant bleeding following wide-field endoscopic resection of large sessile and laterally spreading colorectal lesions : a clinical risk score. Am J Gastroenterol. (2016) 111:1115-22. doi : 10.1038/ajg.2016.235
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Albéniz E, Fraile M, Ibáñez B, Alonso-Aguirre P, Martínez-Ares D, Soto S, et al. Un système de notation pour déterminer le risque de saignement tardif après résection muqueuse endoscopique de grandes lésions colorectales. Clin Gastroenterol Hepatol. (2016) 14:1140-7. doi : 10.1016/j.cgh.2016.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Wolff WI, Shinya H. Diagnostic précoce du cancer du côlon par endoscopie colique (coloscopie). Cancer (1974) 34:912-34.
Google Scholar
33. Tedesco FJ. Polypectomie coloscopique. In : Silvia SE, éditeur. Therapeutic Gastrointestinal Endoscopy (1984) New York, NY : Igaku-Shoin. p. 269-88.
Google Scholar
34. Waye JD. Polypectomie – principes de base. In : Waye JD, Rex DK, Williams CB, éditeurs. Principes et pratique de la coloscopie. Malden, MA ; Oxford : Carlton (2003) p. 410-9. doi : 10.1002/9780470986943.ch35
CrossRef Full Text | Google Scholar
35. Waye JD. Polypectomie : principes de base. In : Waye JD, Rex DK, Williams CB, éditeurs. Principes et pratique de la coloscopie. Oxford ; Hoboken, NJ : Wiley-Blackwell (2009) p. 572-81.
Google Scholar
36. Meeroff JC. Suppression de polypes sessiles coliques de taille moyenne sans diathermie. Gastrointest Endosc. (1989) 35:136. doi : 10.1016/S0016-5107(89)72740-1
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Tappero G, Gaia E, De Giuli P, Martini S, Gubetta L, Emanuelli G. Cold snare excision of small colorectal polyps. Gastrointest Endosc. (1992) 38:310-3. doi : 10.1016/S0016-5107(92)70422-2
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Chen ZJ., Batts K. P. (2017). Mo2011 élimination des saignements post-polypectomie et élimination plus complète des polypes avec le stripping mucosal endoscopique (EMS). Gastroenterol. Endos. 85(Suppl. 5):AB520. Résumé Mo2011. doi : 10.1016/j.gie.2017.03.1198
CrossRef Full Text | Google Scholar
39. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Suppression de petits polypes colorectaux chez les patients anticoagulés : une comparaison prospective randomisée du collier froid et de la polypectomie conventionnelle. Gastrointest Endosc. (2014) 79:417-23. doi : 10.1016/j.gie.2013.08.040
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Zhang Q, Gao P, Han B, Xu J, Shen Y. Polypectomie pour la résection endoscopique complète des petits polypes colorectaux. Gastrointest Endosc. (2017). 87(3):733-740. doi : 10.1016/j.gie.2017.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Paspatis GA, Tribonias G, Konstantinidis K, Theodoropoulou A, Vardas E, Voudoukis E, et al. Une comparaison prospective randomisée de la polypectomie au collet froid vs chaud dans la survenue de saignements postpolypectomie dans les petits polypes coliques. Colorectal Dis. (2011) 13:e345-8. doi : 10.1111/j.1463-1318.2011.02696.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Repici A, Hassan C, Vitetta E, Ferrara E, Manes G, Gullotti G, et al. Sécurité de la polypectomie à froid pour les polypes de < 10 mm à la coloscopie : une étude prospective multicentrique. Endoscopie. (2012) 44:27-31. doi : 10.1055/s-0031-1291387
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Tutticci N, Burgess NG, Pellise M, Mcleod D, Bourke MJ. Caractérisation et signification des protrusions dans le défaut muqueux après une polypectomie au collet froid. Gastrointest Endosc. (2015) 82:523-8. doi : 10.1016/j.gie.2015.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
.