- Introduction
- Matériel et méthodes
- Sujets et paradigme expérimental
- Imagerie par résonance magnétique fonctionnelle et signaux dépendant du taux d’oxygène dans le sang
- Sélection des régions d’intérêt pour les signaux dépendant du taux d’oxygène sanguin provenant du cervelet/du tronc cérébral
- Calcul de la moyenne des ondes dépendant du taux d’oxygène dans le sang, de l’intervalle entre les battements et de la respiration
- Résultats
- Discussion
- Coincidence des ondes respiratoires et de l’artefact respiratoire dépendant du niveau de sang et d’oxygène
- Activation neuronale rythmique associée à l’oscillation neuronale dépendant du taux d’oxygène dans le sang
- L’activité neuronale agit comme une « force motrice » pour les oscillations lentes de la fréquence cardiaque
- Limitations et perspectives d’avenir
- Conclusion
- Data Availability
- Ethics Statement
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Abréviations
Introduction
L’arythmie du sinus respiratoire (RSA) reflète l’accélération de la fréquence cardiaque (HR) pendant l’inspiration et la décélération de la HR pendant l’expiration. C’est un principe fondamental (Yasuma et Hayano, 2004) et le phénomène central de la respiration de résonance rythmée à 6/min associée à une variabilité de la fréquence cardiaque (VRC) amplifiée à basse fréquence, un bien-être émotionnel accru (Mather et Thayer, 2018) et un meilleur traitement des émotions négatives (Zaccaro et al., 2018). Il est intéressant de noter qu’il existe des exceptions au RSA avec des augmentations de l’intervalle battement à battement (RRI) de la FC pendant l’inspiration et avec une avance de phase du RRI par rapport au rythme respiratoire (Rassler et al., 2018). Ce RSA paradoxal inhabituel a été trouvé chez une minorité de participants sains pendant un balayage d’imagerie par résonance magnétique fonctionnelle (IRMf), une situation inconfortable, parfois claustrophobe, généralement associée à une augmentation de l’anxiété d’état (Munn et al., 2015 ; Pfurtscheller et al., 2018).
Les vagues de respiration spontanée lente avec un taux entre 6 et 9 respirations/min sont également accompagnées d’une VRC élevée et pourraient ainsi faciliter le traitement des émotions désagréables comme l’anxiété et le stress (Thayer et Lane, 2009). En raison du rôle prépondérant de l’IRR sur les oscillations respiratoires lors de l’arrêt inhabituel de l’ASR (Rassler et al., 2018), il semble probable qu’un oscillateur neuronal autonome (pacemaker central ; Julien, 2006) dans le cerveau agisse comme une source pour les oscillations lentes de l’IRR. Il convient de noter que Perlitz et al. (2004) ont signalé un nouveau type de rythme cardiovasculaire dans la bande de 0,15 Hz chez l’homme et le chien, avec une origine commune dans le tronc cérébral. La caractéristique la plus intéressante de ce « rythme de 0,15 Hz » à large bande (comprenant également des composantes de fréquence proches de 0,1 Hz) est que les périodes d’ondes fusiformes sont couplées en phase avec la respiration dans un rapport de 1:1. Notre principal intérêt de recherche était d’identifier ce stimulateur cardiaque, dont on pense qu’il est situé dans le tronc cérébral (Lambertz et Langhorst, 1998 ; Perlitz et al, Le signal BOLD ne quantifie pas directement l’activité neuronale elle-même, mais il est sensible aux changements du taux métabolique cérébral, du débit sanguin cérébral et du volume sanguin cérébral (Obrig et al., 2000 ; Buxton et al., 2004) et à plusieurs types de mouvements (mouvements de la poitrine et des vaisseaux sanguins ; Birn et al., 2006). Par conséquent, les signaux BOLD peuvent être composés de composantes neurales et non neurales (par exemple, le mouvement des vaisseaux). On s’attend à ce que deux signaux BOLD d’origine différente puissent être identifiés dans le tronc cérébral avec son gros vaisseau sanguin (artère basilaire) et la source neuronale postulée de 0,15 Hz (Perlitz et al., 2004). Nous supposons que l’une d’entre elles résulte du mouvement des vaisseaux sanguins (BOLDv) et indique le début d’une action respiratoire lente car elle se produit presque simultanément avec l’activation neuronale des neurones respiratoires. L’autre serait associée à l’activation neuronale (BOLDn) retardée par le temps de couplage neurovasculaire de 2-3 s (Mateo et al., 2017). Nous spéculons que les deux signaux BOLD pointent vers un pacemaker central dans le tronc cérébral.
Matériel et méthodes
Sujets et paradigme expérimental
Le groupe de sujets étudiés était le même (âge 23,8 ± 3,3 ans) que celui analysé récemment par Rassler et al. (2018). L’enregistrement et le prétraitement de l’ECG et de la respiration ont été décrits dans cet article. Tous les participants ont donné leur consentement écrit éclairé au protocole de l’étude, qui avait été approuvé par le comité d’éthique local de l’Université de Graz.
Imagerie par résonance magnétique fonctionnelle et signaux dépendant du taux d’oxygène dans le sang
Les images fonctionnelles ont été acquises avec un scanner 3 T (Magnetom Skyra) en utilisant une séquence GE-EPI multibande (Moeller et al, 2010) avec une acquisition simultanée à six bandes avec TE/TR = 34/871 ms, un angle de bascule de 52°, une taille de voxel de 2 mm × 2 mm × 2 mm, 66 coupes axiales contiguës (11 × 6), une matrice d’acquisition de 90 × 104 et un FOV de 180 mm × 208 mm. Cette fréquence de balayage de 871 ms (fréquence d’échantillonnage de 1,15 Hz) permet d’étudier les oscillations lentes dans la gamme 0,1-0,15 Hz. Pour plus de détails sur le prétraitement, voir Pfurtscheller et al. (2018). L’atlas de marquage anatomique automatisé (AAL) (Tzourio-Mazoyer et al., 2002) a été utilisé pour extraire les cours temporels des signaux BOLD dans 116 régions d’intérêt (ROI). Cet atlas ne présente aucune ROI dans le tronc cérébral, mais seulement à proximité du cervelet et du vermis. En raison de la proximité de ces régions et en raison de la contiguïté d’une artère principale, il est raisonnable de supposer que le signal recueilli à partir des ROIs AAL étiquetés « cervelet » reflète partiellement l’activité du tronc cérébral.
Sélection des régions d’intérêt pour les signaux dépendant du taux d’oxygène sanguin provenant du cervelet/du tronc cérébral
Parmi les 116 ROI de l’atlas AAL, les ROI 91 à ROI 108 correspondent à des coupes axiales du cervelet incluant le tronc cérébral (Tzourio-Mazoyer et al, 2002). Les images T1 de la coupe axiale (espace de Talairach z = -34) documentent la proximité du cervelet et du tronc cérébral (Figure 1). En raison de leur faible nombre de voxels (<200), les ROIs 107 et 108 ont été exclus de l’analyse. Les ROIs du cervelet/tronc cérébral ont été inspectés visuellement afin de rechercher les ROIs appropriés, c’est-à-dire les ROIs présentant un bon rapport signal/bruit et des ondes BOLD lentes dominantes. Les ROIs suivants ont été identifiés : 96, 98, 100, 103 et 105. Les chiffres indiquent les étiquettes des ROIs selon l’atlas AAL. Les numéros impairs et pairs indiquent les hémisphères gauche et droit, respectivement.
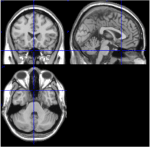
Figure 1. Images T1 des coupes médiane, sagittale et axiale d’un sujet (espace de Talairach 0, 20, -34). Dans la coupe sagittale (image supérieure droite), le pons est clairement visible, et dans la coupe axiale (en bas), la proximité du cervelet et du tronc cérébral est documentée.
Calcul de la moyenne des ondes dépendant du taux d’oxygène dans le sang, de l’intervalle entre les battements et de la respiration
La moyenne permet d’améliorer le rapport signal/bruit mais nécessite l’utilisation d’un déclencheur. Comme aucun déclencheur de ce type n’est disponible dans les données de l’état de repos, les maxima (pics) du signal de l’IRR survenant de manière rythmique ont été utilisés (Pfurtscheller et al., 2017) : Tout d’abord, les pics les plus marquants des signaux RRI, espacés d’au moins plusieurs secondes, ont été identifiés. Dans le cas des oscillations de 0,1 Hz, ces intervalles entre les pics étaient d’environ 10 s, et dans le cas des oscillations de 0,15 Hz, ils étaient d’environ 7 s (un exemple est représenté sur la figure 2 par les lignes verticales en pointillés presque équidistantes). Les pics RRI marqués ont été utilisés comme déclencheurs pour le calcul de la moyenne (époques avec 6 s avant et 6 s après le déclencheur) à travers les signaux BOLD, RRI et respiration.
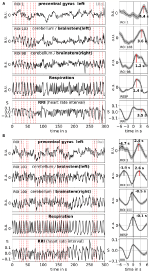
Figure 2. Exemples de signaux BOLD, RRI et respiratoires continus et d’ondes moyennes correspondantes (±SE) pour deux sujets, l’un avec des oscillations dominantes de 0,1 Hz et l’autre avec des oscillations dominantes de 0,15 Hz . Les lignes pointillées verticales dans les panneaux de gauche indiquent les maxima (pics) des oscillations RRI utilisées comme déclencheur pour le calcul de la moyenne. Les pics des ondes moyennées sont indiqués dans les panneaux du côté droit.
Résultats
Les oscillations BOLD lentes dans le cervelet/tronc cérébral sont caractérisées par leur qualité de signal favorable mais, plus important encore, par leur coïncidence avec les oscillations de l’IRR et de la respiration. Comme le rapportent Rassler et al. (2018), les oscillations de 0,1-Hz ont prévalu pendant ~37 % du temps d’enregistrement, tandis que les oscillations de 0,15-Hz ont prévalu dans ~45 %. Deux exemples caractéristiques d’oscillations de 0,1-Hz (sujet 1Rb1) et de 0,15-Hz (sujet 11Ra1) sont présentés dans la figure 2. Dans les deux cas, les oscillations RRI de grande amplitude coïncident avec la respiration sous la forme d’une augmentation RRI pendant l’inspiration et sont également clairement reflétées dans les signaux BOLD dans le tronc cérébral. Il convient de noter que la dynamique variable des oscillations spontanées et des ondes uniques, respectivement, à l’état de repos, montre clairement qu’il existe non seulement un mais plusieurs rythmes cardiovasculaires avec des composantes de fréquence proches de 0,1 et 0,15 Hz. Certains de ces rythmes sont amplifiés pendant le traitement de l’anxiété, d’autres non, et certains sont synchronisés dans le cortex préfrontal et le tronc cérébral, d’autres non.
Des exemples de signaux spontanés et d’ondes moyennées de deux sujets caractéristiques sont présentés dans la figure 2. Les ondes moyennes avec des latences de pic marquées (distance du pic de l’IRR) de tous les sujets sont affichées dans la figure 3. À noter que la variance relativement faible des ondes BOLD moyennées dans le tronc cérébral souligne la fiabilité des mesures de pic.
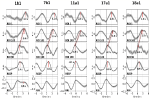
Figure 3. Ondes moyennes (±SE) des signaux BOLD du gyrus précentral gauche (ROI 1), du tronc cérébral gauche (BOLDn, ROIs 103, 105), du tronc cérébral droit (BOLDv, 96, 98, 100), de la respiration et des intervalles RR (de haut en bas) des cinq sujets. Les latences des pics (différence avec le pic de l’IRR) des pics importants sont marquées. Le décalage temporel de 2-3 s entre les deux signaux BOLD du cervelet/tronc cérébral est indiqué par une ligne pointillée.
L’onde BOLD de l’hémisphère droit précédant l’onde respiratoire de 0,3 ± 0,2 s a été interprétée comme BOLDv, et l’onde BOLD de l’hémisphère gauche retardant l’onde respiratoire de 2,3 ± 0,5 s a été prise comme BOLDn. La différence maximale entre les ondes BOLDv et BOLDn était de 2,6 ± 0,4 s.
Les ondes moyennes de la figure 3 mettent en évidence le net déphasage entre les deux signaux BOLD dans le tronc cérébral (BOLDn, BOLDv) chez les cinq sujets. Les différences de pics sont indiquées par des lignes pointillées. En plus des deux signaux BOLD du tronc cérébral, le signal BOLD du gyrus précentral gauche (ROI 1) a été analysé comme contrôle. Bien que les ondes BOLD moyennes du cortex préfrontal (CPF) présentent une variance (SE) élevée, elles correspondent étonnamment bien aux ondes BOLDn du cervelet/tronc cérébral. Cela confirme la forte interaction entre le PFC et le tronc cérébral dans la gamme de fréquences lentes autour de 0,1 Hz.
Discussion
Coincidence des ondes respiratoires et de l’artefact respiratoire dépendant du niveau de sang et d’oxygène
La respiration est accompagnée non seulement d’un mouvement de la poitrine mais aussi d’un mouvement des vaisseaux sanguins cérébraux (Birn et al., 2006). Un décalage temporel stable de 0,3 ± 0,2 s a été observé entre le pic positif du signal BOLDv dans le cervelet/tronc cérébral droit et le maximum de chaque onde respiratoire (début de l’expiration). La respiration était spontanée et le pic respiratoire était décalé par rapport au pic BOLDv, ce qui pourrait indiquer une vasomotion rapide de l’artère basilaire, un gros vaisseau sanguin proche du côté rostral du cône. Cette vasomotion pourrait être considérée comme un artefact respiratoire induit par une modulation respiratoire des neurones sympatho-excitateurs dans le noyau réticulaire rostroventrolatéral. Une influence marquée du générateur central du schéma respiratoire sur l’activité des nerfs sympathiques a été observée chez de nombreuses espèces, y compris l’homme (Haselton et Guyenet, 1989 ; Häbler et Jänig, 1995 ; Eckberg, 2003 ; Mandel et Schreihofer, 2006). La diminution de l’activité de ces neurones dans la moelle rostroventrolatérale (c’est-à-dire la dépression sympathique) pendant l’inspiration et la ré-augmentation brutale de l’activité à l’arrêt des salves phréniques est l’un des schémas prédominants du couplage respiratoire-sympathique (Haselton et Guyenet, 1989). Ces oscillations sympathiques modulées par la respiration provoquent une vasodilatation maximale à la fin de l’inspiration (c’est-à-dire le maximum du signal BOLD précédant immédiatement le début de l’expiration) et une vasoconstriction pendant l’expiration (minimum du signal BOLD précédant juste le début de l’inspiration).
Activation neuronale rythmique associée à l’oscillation neuronale dépendant du taux d’oxygène dans le sang
Les oscillations BOLD (BOLDn) ont pris du retard sur l’artefact respiratoire périodique (BOLDv) de 2.6 ± 0,4 s. Les deux oscillations BOLD ont été enregistrées simultanément dans des tranches axiales, la BOLDn étant associée à l’activité neuronale comme force motrice de la respiration spontanée et la BOLDv reflétant un mouvement de vaisseau associé au début de l’expiration. Ce délai de 2-3 s correspond au temps de couplage neurovasculaire (Mateo et al., 2017).
Diverses influences externes sur l’émotion suscitées par la position inconfortable en décubitus dorsal avec la tête du sujet dans un espace bruyant limité peuvent activer d’abord les zones sensorielles primaires et être suivies par la projection corticale vers les neurones respiratoires du tronc cérébral. En outre, les influences internes et comportementales provenant des centres supérieurs modifient les schémas respiratoires métaboliques. La sortie respiratoire finale implique une interaction complexe entre les structures corticales, le tronc cérébral et le système limbique et est caractéristique de la respiration émotionnelle (Homma et Masaoka, 2008 ; Kato et al., 2018). Par conséquent, il est tout à fait plausible que les oscillations dans le gyrus précentral gauche (ROI 1) aient été synchronisées avec les oscillations BOLD lentes, induites par les neurones, dans le cervelet/tronc cérébral.
L’activité neuronale agit comme une « force motrice » pour les oscillations lentes de la fréquence cardiaque
La dynamique variable des modèles de couplage observés à l’état de repos indique une variété de rythmes cardiovasculaires dans la bande de fréquence entre 0,1 et 0,15 Hz. Cela souligne l’importance, la flexibilité et la complexité de l’interaction cerveau-cœur et mérite de nouvelles recherches intensives.
Chez les cinq participants, le schéma de couplage entre la respiration et la FC était tout à fait contraire au RSA typique (Rassler et al., 2018), à savoir que le RRI augmentait pendant l’inspiration et diminuait pendant l’expiration. Lors de situations anxiogènes, la respiration a tendance à être plus rapide et l’activité vagale diminuée, ce qui entraîne une FC plus élevée (RRI plus courte). En revanche, lorsque la respiration est ralentie de manière inconsciente/autonome dans une situation anxiogène, l’activité vagale peut augmenter, ce qui entraîne une FC plus faible (IRR plus élevé). Il semble que non seulement l’activation corticale induit une augmentation presque simultanée de l’IRR (Barry, 1983 ; Damen et Brunia, 1987 ; Pfurtscheller et Lopes da Silva, 1999 ; Pfurtscheller et al., 2013), mais notre étude fournit la première preuve qu’un stimulateur central dans le cervelet/tronc cérébral peut également agir comme force motrice pour les oscillations intrinsèques de l’IRR et les vagues de respiration lente spontanée. Cette constatation appuie fortement les travaux de Perlitz et al. (2004) sur le « rythme de 0,15-Hz. »
Limitations et perspectives d’avenir
La sélection des ROIs avec des signaux BOLD de bonne qualité dans le cervelet/tronc cérébral a été faite par inspection visuelle. Il s’agissait notamment de différencier les oscillations BOLD d’origine neuronale des artefacts de mouvement. Ces derniers désignent les signaux BOLD synchronisés avec la respiration. Pour des études ultérieures, il est recommandé de calculer les valeurs de verrouillage de phase (PLV ; Pfurtscheller et al.2017) entre l’IRR et les signaux BOLD individuels dans le cervelet/le tronc cérébral. En outre, l’évaluation synchrone des métriques de ventilation, telles que le volume courant/volume respiratoire par temps, la pCO2 end-tidale et le type de respiration (nez vs bouche), ainsi que l’utilisation de diverses méthodes de débruitage dans des contextes expérimentaux cliniques et animaux, pourraient donner un aperçu plus approfondi des interactions complexes des systèmes de régulation impliqués.
La « mise hors tension » de l’arythmie sinusale respiratoire est une exception d’un phénomène physiologique fondamental qui peut se produire, par exemple, dans des situations anxiogènes. Parmi les 23 participants sains d’une étude IRMf, seuls cinq sujets présentaient ce schéma de couplage paradoxal.
Une condition préalable à l’analyse BOLD (Bn et Bv) dans le tronc cérébral est une coïncidence entre la respiration lente et les oscillations RRI ; cependant, un tel couplage 1:1 ne peut être trouvé que chez une minorité de participants. Par conséquent, ce type d’analyse est limité à ces rares cas. Néanmoins, nous supposons qu’un stimulateur central dans le tronc cérébral est également répandu chez les personnes présentant un RSA normal et un couplage 1:2 ou 1:3 (deux ou trois respirations pendant un cycle RRI). Les premiers résultats du calcul du couplage de phase (PLV) entre les oscillations BOLD du tronc cérébral et les oscillations RRI dans la bande de 0,1 à 0,15 Hz confirment cette hypothèse. Avec cette méthode, il est possible de mesurer l’activité du pacemaker dans le tronc cérébral indépendamment de la fréquence respiratoire. Ce travail est en cours.
Il faut noter que le niveau d’anxiété d’état chez les individus présentant une respiration spontanée lente variait entre AS = 14 et AS = 28 (plage possible des scores AS : 10-40) et que tous les individus présentant des scores d’anxiété élevés ne présentaient pas ce type de respiration lente. Nous concluons donc qu’il n’existe pas de relation claire entre la respiration spontanée lente et le traitement de l’anxiété.
Conclusion
1. Les oscillations BOLD à l’état de repos provenant du cervelet/tronc cérébral peuvent avoir des fréquences alternées entre 0,1 et 0,15 Hz, similaires à celles rapportées dans les signaux de l’IRR et de la respiration (Rassler et al., 2018).
2. Certains signaux BOLD provenant du cervelet/tronc cérébral peuvent être influencés par la vasomotion (artère basilaire), tandis que d’autres peuvent être associés à une activité de pacemaker central dans le tronc cérébral. Par conséquent, le moment réel du début de la respiration ainsi que sa source neuronale pourraient être détectés dans les signaux BOLD.
3. Les deux signaux BOLD avec des origines différentes enregistrés simultanément caractérisent une source commune, ce qui soutient le travail de Perlitz et al. (2004).
4. Les résultats suggèrent qu’il existe des preuves d’une respiration émotionnelle inconsciente à 6-9/min (0,1-0,15 Hz), qui – de manière similaire à la respiration de résonance consciente à 6/min (0.1 Hz) favorisant le bien-être psychologique (Mather et Thayer, 2018) – élève également la VRC et peut faciliter le traitement des émotions négatives.
Data Availability
Les ensembles de données générés pour cette étude sont disponibles sur demande auprès de l’auteur correspondant.
Ethics Statement
Cette étude a été réalisée conformément aux recommandations de la Déclaration d’Helsinki de 1964 avec le consentement éclairé écrit de tous les sujets. Tous les sujets ont donné leur consentement éclairé écrit conformément à la déclaration d’Helsinki. Le protocole a été approuvé par le comité d’éthique de l’Université de Graz.
Contributions des auteurs
GP a contribué à la conceptualisation et à la version originale. BR et AA ont contribué à la méthodologie, au traitement des données, aux statistiques, à la rédaction et à la visualisation. AS, BR, GS, WK et JT ont revu et édité le manuscrit.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Les auteurs tiennent à remercier Thomas Zussner, David Fink et Karl Koschutnig, de l’Université de Graz, pour leur soutien dans l’acquisition des données.
Abréviations
BOLD, Blood-oxygenation-level-dependent ; ECG, Electrocardiogramme ; (f)IRM, Imagerie par résonance magnétique (fonctionnelle) ; HR, Fréquence cardiaque ; HRV, Variabilité de la fréquence cardiaque ; PFC, Cortex préfrontal ; ROI, Région d’intérêt ; RRI, Intervalle battement à battement ; RSA, Arythmie sinusale respiratoire.
Barry, R. J. (1983). La bradycardie primaire et la réponse cardiaque évoquée dans le contexte du bloc opératoire. Physiol. Psychol. 11, 135-140. doi : 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., et Bandettini, P. A. (2006). Séparation des fluctuations liées aux variations respiratoires des fluctuations liées à l’activité neuronale en IRMf. NeuroImage 31, 1536-1548. doi : 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., and Liu, T. T. (2004). Modélisation de la réponse hémodynamique à l’activation du cerveau. NeuroImage 23, 220-233. doi : 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., et Brunia, C. H. M. (1987). Changements de la fréquence cardiaque et des potentiels cérébraux lents liés à la préparation motrice et à l’anticipation du stimulus dans une tâche d’estimation du temps. Psychophysiologie 24, 700-713. doi : 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). La porte respiratoire humaine. J. Physiol. 548, 339-352. doi : 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., et Jänig, W. (1995). Coordination des systèmes sympathique et respiratoire : expériences neurophysiologiques. Clin. Exp. Hypertens. 17, 223-235. doi : 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., and Guyenet, P. G. (1989). Modulation respiratoire centrale des neurones sympatho-excitateurs médullaires chez le rat. Am. J. Phys. 256, R739-R750. doi : 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., et Masaoka, Y. (2008). Rythmes respiratoires et émotions. Exp. Physiol. 93, 1011-1021. doi : 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). L’énigme des ondes de Mayer : faits et modèles. Cardiovasc. Res. 70, 12-21. doi : 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., et Homma, I. (2018). Relations entre les traits et les paramètres respiratoires pendant la respiration calme chez les sujets normaux. J. Physiol. Sci. 68, 369-376. doi : 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., et Langhorst, P. (1998). Changements simultanés de l’organisation rythmique dans les neurones du tronc cérébral, la respiration, le système cardiovasculaire et l’EEG entre 0,05 Hz et 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., et Schreihofer, A. M. (2006). Modulation respiratoire centrale des neurones barosensibles dans la médulla ventrolatérale caudale du rat. J. Physiol. 572, 881-896. doi : 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., et Kleinfeld, D. (2017). L’entraînement des fluctuations vasomotrices artérielles par l’activité neuronale est une base de la connectivité « état de repos » dépendante du niveau d’oxygénation du sang. Neuron 96, 1-13. doi : 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., et Thayer, J. (2018). Comment la variabilité de la fréquence cardiaque affecte les réseaux cérébraux de régulation des émotions. Curr. Opin. Behav. Sci. 19, 98-104. doi : 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI at 7 Tesla, with 16-fold acceleration using partial parallel imaging with application to high spatial and temporal whole-brain fMRI. Magn. Reson. Med. 63, 1144-1153. doi : 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., et Murphy, F. (2015). La claustrophobie en imagerie par résonance magnétique : une revue systématique. Radiographie 21, e59-e63. doi : 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontaneous low frequency oscillations of ccerebral hemodynamics and metabolism in human adults. NeuroImage 12, 623-639. doi : 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Rythmes cardiovasculaires dans la bande de 0,15 Hz : origine commune de phénomènes identiques chez l’homme et le chien dans la formation réticulaire du tronc cérébral ? Eur. J. Phys. 448, 579-591. doi : 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., et Lopes da Silva, F. (1999). Synchronisation et désynchronisation EEG/MEG liées aux événements : principes de base. Clin. Neurophysiol. 110, 1842-1857. doi : 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Communication cerveau-cœur : preuves d’oscillations « pacemaker central » avec une fréquence dominante à 0,1 Hz dans le cingulum. Clin. Neurophysiol. 128, 183-193. doi : 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Synchronisation des oscillations intrinsèques de 0,1 Hz dépendantes du niveau d’oxygène sanguin dans l’amygdale et le cortex préfrontal chez les sujets présentant une anxiété d’état accrue. Eur. J. Neurosci. 47, 417-426. doi : 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., et Müller-Putz, G. R. (2013). Fréquence cardiaque vive et changements EEG pendant l’exécution et la retenue de l’imagerie motrice du pied au rythme d’un indice. Front. Hum. Neurosci. 7:379. doi : 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., et Pfurtscheller, G. (2018). « Switch-off » de l’arythmie du sinus respiratoire peut se produire chez une minorité de sujets pendant l’imagerie par résonance magnétique fonctionnelle (IRMf). Front. Physiol. 9:1688. doi : 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., et Lane, R. D. (2009). Claude Bernard et la connexion cœur-cerveau : poursuite de l’élaboration d’un modèle d’intégration neuroviscérale. Neurosci. Biobehav. Rev. 33, 81-88. doi : 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage 15, 273-289. doi : 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., et Hayano, J. (2004). Arythmie sinusale respiratoire : pourquoi le rythme cardiaque se synchronise-t-il avec le rythme respiratoire ? Chest 125, 683-690. doi : 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Comment le contrôle de la respiration peut changer votre vie : une revue systématique sur les corrélats psycho-phyiologiques de la respiration lente. Front. Hum. Neurosci. 12:353. doi : 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar
.