Introduction
Les neutrophiles sont la population la plus abondante de globules blancs circulants et la première ligne de défense de l’hôte contre les agents pathogènes envahissants . Dans des conditions normales, les neutrophiles circulants ont une demi-vie de 6-12 h et sont fonctionnellement quiescents. Pendant l’inflammation, les neutrophiles arrivent rapidement sur les sites d’infection et de blessure, renforcent l’activité antimicrobienne et meurent dans les tissus infiltrés. Ils jouent des rôles importants dans le système immunitaire inné, et des réponses neutrophiles significatives sont observées dans les inflammations systémiques telles que les traumatismes, les brûlures, les septicémies et les chirurgies majeures .
Cependant, la dérégulation des réponses neutrophiles telles que la libération excessive ou incontrôlée de cytokines pro-inflammatoires peut causer des dommages aux tissus ou aux organes de l’hôte lors de septicémies graves, et de maladies auto-immunes .
La thérapie d’élimination des leucocytes (LRT), la leucocytaphérèse (LCAP) ou l’aphérèse granulocytaire/monocytaire (GMA) est une méthode d’aphérèse thérapeutique qui élimine les leucocytes périphériques par circulation extracorporelle. Elle a été utilisée comme traitement non pharmacologique de la colite ulcéreuse (CU) et de la maladie de Crohn (MC), et a montré une excellente efficacité à court terme.
La CPL utilisant Cellsorba, une colonne de fibres de polyéthylène téléphtalate (Asahi-Kasei Medical, Tokyo, Japon), a été rapportée pour éliminer ~100% des granulocytes/monocytes, ~60% des lymphocytes et ~50% des plaquettes à l’entrée et à la sortie de l’appareil Cellsorba . Bien que les mécanismes exacts du TLR n’aient pas été entièrement explorés, leurs mécanismes potentiels ont été signalés, qui comprennent une réduction du nombre de leucocytes activés ou de cytokines pro-inflammatoires telles que le facteur de nécrose tumorale (TNF)-α, l’interleukine (IL)-1β, IL-6 et IL-8 .
L’infection du site opératoire (ISO) reste l’une des causes les plus fréquentes de morbidité en chirurgie majeure, ce qui prolonge l’hospitalisation et augmente les coûts médicaux . La surveillance prospective multicentrique japonaise a montré que 19,5 % des patients atteints de RCH ont développé une ISO après l’opération.
Dans une étude cas-témoins, nous avons comparé rétrospectivement l’incidence des ISO entre les patients subissant une proctocolectomie avec anastomose iléale (IPAA) (n=29) et ceux subissant une IPAA avec LCAP postopératoire (n=43). La LCAP postopératoire a réduit de manière significative les ISO chez les patients atteints de RCH subissant une proctocolectomie avec IPAA (p<0,01). Dans une étude prospective multicentrique que nous avons menée, l’incidence des ISO a été comparée entre les patients atteints de RCH subissant une chirurgie (groupe témoin ; n=103) et ceux subissant une chirurgie avec LCAP postopératoire (n=40). Les ISO sont survenues chez 4 des 37 patients (10,8 %) du groupe LCAP, alors qu’elles sont survenues chez 29 des 103 patients (28,2 %) du groupe témoin, bien que la différence n’ait pas atteint la signification statistique (p=0,069) .
Ces observations cliniques suggèrent que la LCAP élimine les leucocytes activés producteurs de cytokines proinflammatoires dans l’inflammation systémique postopératoire due à une chirurgie colorectale majeure, et pourrait supprimer l’apparition d’ISO. Nous avons signalé une association entre le dysfonctionnement des neutrophiles et les complications infectieuses postopératoires.
Les neutrophiles sont les cellules les plus abondantes parmi les leucocytes circulants et peuvent être les plus fréquemment éliminés par la LCAP . Ainsi, nous nous sommes concentrés sur les fonctions des neutrophiles circulants isolés avant et après la LCAP, afin de clarifier les mécanismes thérapeutiques de la LCAP postopératoire sur la survenue d’ISO chez les patients atteints de RCH après une intervention chirurgicale.
Matériel et méthode
Patients
Quarante-trois patients atteints de RCH subissant une IPAA ont reçu une LCAP postopératoire au département de chirurgie gastro-intestinale et pédiatrique de l’école supérieure de médecine de l’université de Mie de 2004 à 2008. Le diagnostic de RCH était basé sur les données cliniques, radiographiques, endoscopiques, chirurgicales et histopathologiques. Avant l’opération, les patients ont reçu divers traitements médicaux, notamment des anti-inflammatoires (aminosalicylates, corticostéroïdes) ou des immunosuppresseurs (azathioprine, mercaptopurine, cyclosporine), ou les deux. La LCAP postopératoire a été effectuée une fois dans les 2 heures suivant l’opération. Les patients présentant des symptômes cliniques de septicémie ont été exclus de l’étude. Les patients présentant une hémodynamique instable après la chirurgie ont également été exclus selon le protocole. Un consentement éclairé écrit a été obtenu de tous les patients avant le début de cette étude, qui a été réalisée conformément à la déclaration d’Helsinki et approuvée par le conseil d’examen institutionnel (n° 474).
Isolation des neutrophiles
Les neutrophiles pré et post-LCAP ont été isolés chez les mêmes patients avant et après la chirurgie. L’isolement des neutrophiles était basé sur une procédure décrite précédemment . Les échantillons de sang (10 ml) ont été dilués avec un volume égal de solution saline tamponnée au phosphate (PBS), superposés à un volume de Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canada) et centrifugés à 600 × g pendant 30 min à température ambiante. Après élimination des cellules mononucléaires, du plasma et du Ficoll-Paque PLUS, le culot a été remis en suspension dans 12 mL de solution de chlorure d’ammonium pour lyser les globules rouges, puis lavé deux fois dans du PBS et remis en suspension dans du PBS. Les neutrophiles ont été lavés deux fois avec du PBS et remis en suspension dans du TCM-10 . Les préparations cellulaires ont été testées pour leur viabilité (>99%) par exclusion au bleu trypan et pour leur pureté (>95% de granulocytes CD13+, CD33+) par cytométrie de flux.
Activité phagocytaire
L’activité phagocytaire ex vivo des neutrophiles circulants contre Escherichia coli a été comparée entre les neutrophiles pré et post-LCAP isolés de patients identiques.
La phagocytose des neutrophiles a été mesurée en utilisant des bioparticules fluorescentes . Pour opsoniser les bioparticules bactériennes, le réactif opsonisant reconstitué et les bioparticules bactériennes (5 × 105) ont été mélangés, vortexés et incubés pendant 1 h à 37°C dans un incubateur humidifié à 5% de CO2. Après deux lavages avec du PBS, séparés par centrifugation à basse vitesse (1500 × g, 15 min, 4°C), les culots ont été incubés avec des neutrophiles (5 × 105) dans 1 mL de milieu sans antibiotique pendant 3 h à 37°C dans un incubateur humidifié à 5% de CO2. Après 3 h d’incubation, l’activité phagocytaire des neutrophiles contre E. coli a été analysée à l’aide d’un FACScan (Becton-Dickinson, San Jose, CA, USA) et 10 000 événements ont été comptés par échantillon.
Préparation d’E. coli
Escherichia coli (ATCC25922) a été acheté auprès de l’American Type Culture Collection (Manassas, VA, USA), et cultivé dans le milieu d’Eagle modifié de Dulbecco (Invitrogen, Tokyo, Japon) pendant 10 h à 37°C. Le milieu de culture a été centrifugé à 1 700 × g pendant 10 min à température ambiante pour obtenir un culot, qui a été lavé deux fois et remis en suspension dans du sérum physiologique stérile. Une aliquote (100 μL) de la suspension a été diluée en série avec du sérum physiologique stérile, plaquée sur de l’Agar-B (Qbiogene, Carlsbad, CA, USA) et incubée pendant 18 h pour déterminer la concentration bactérienne. Le reste a été conservé à -80°C jusqu’à utilisation.
Co-culture de neutrophiles avec E. coli
Juste avant utilisation, la suspension d’E. coli a été diluée dans du milieu pour atteindre une concentration finale de 2,5 × 106 cfu/mL. Après opsonisation des E. coli à l’aide de sérum autologue pendant 30 min à 37°C, les neutrophiles (2,5 × 105 /mL) ont été coculturés dans 1 mL de milieu sans antibiotique pendant 3 h à 37°C dans un incubateur humidifié à 5% de CO2. Après centrifugation des cellules à 600 × g pendant 10 min à 4°C, les surnageants ont été recueillis pour analyser la production de cytokines, l’élastase neutrophile (NE) et la viabilité des neutrophiles.
Viabilité des neutrophiles
La viabilité ex vivo des neutrophiles circulants contre E. coli a été comparée entre les neutrophiles pré et post-LCAP isolés de patients identiques. Pour évaluer la viabilité des neutrophiles après la co-culture avec E. coli, un test d’apoptose a été réalisé.
L’apoptose des neutrophiles après la co-culture avec E. coli a été quantifiée par cytométrie de flux en utilisant un kit de détection d’apoptose Annexin V (BioVision Research Products, Palo Alto, CA, USA). Les neutrophiles ont été incubés dans un tampon de liaison 1X auquel ont été ajoutés 5 μL d’isothiocyanate de fluorescéine (FITC) d’Annexin V et 5 μL d’iodure de propidium (PI). Après incubation à température ambiante pendant 5 min dans l’obscurité, les cellules ont été analysées à l’aide d’un FACScan et 10 000 événements ont été comptés par échantillon.
La combinaison de l’Annexin V-FITC et du PI a permis de distinguer les cellules apoptotiques précoces (Annexin V+, PI-), les cellules nécrotiques (Annexin V-, PI+), les cellules apoptotiques tardives ou nécrotiques secondaires (Annexin V+, PI+) et les cellules viables (Annexin V-, PI-).
Dosage immuno-enzymatique (ELISA)
Les cytokines présentes dans le sérum des patients avant et après la LCAP et dans les surnageants après la co-culture de neutrophiles pré et post-LCAP avec E. coli ont été mesurées par ELISA selon les instructions du fabricant. Les cytokines comprenaient le TNF-α, l’antagoniste du récepteur de l’IL-1 (IL-1Ra), l’IL-6, l’IL-8 et le NE. Les kits ELISA TNF-α, IL-1Ra, IL-6 et IL-8 ont été achetés auprès de R&D Systems (Minneapolis, MN, USA). Le kit ELISA NE a été acheté auprès de Immundiagnostik (Bensheim, Allemagne). Les limites de détection du TNF-α, de l’IL-1Ra, de l’IL-6, de l’IL-8 et du NE étaient respectivement de 1, 2, 0,01 et 2 pg/mL et de 0,12 ng/mL, et les niveaux inférieurs à ces limites ont été considérés comme indétectables. Le niveau de chaque cytokine a été évalué en double et la valeur moyenne de la cytokine a été calculée.
Analyse statistique
Toutes les analyses statistiques ont été effectuées à l’aide de JMP version 5 (SAS Institute, Cary, NC, USA). Les associations entre les variables continues et catégorielles ont été évaluées à l’aide du test U de Mann-Whitney ou du test t apparié, le cas échéant. P<0,05 a été considéré comme statistiquement significatif.
Résultats
Caractéristiques des patients
Vingt-neuf patients atteints de RCH subissant une IPAA ont reçu une LCAP postopératoire. Les caractéristiques des patients sont présentées dans le tableau 1. L’âge moyen au moment du diagnostic était de 27 ans (de 15 à 54 ans) et l’âge moyen au moment de la chirurgie était de 33 ans (de 16 à 61 ans). La durée de la maladie était de 6,9 ans (de 0,1 à 28 ans). La colite du côté gauche était chez 6/29 (21%) patients et la pan-colite chez 23/29 (79%) patients.La gravité de la maladie de la colite a été classée comme légère (7 ; 24%), modérée (11 ; 38%), et sévère (4 ; 38%).
| Caractéristiques des patients | |
|---|---|
| Variables | Patients (n=29) Nombre |
| Genre. | |
| Homme | 19 |
| Femme | 10 |
| Age au moment du diagnostic | 27( 15-54) |
| Age au moment de la chirurgie | 33(16-61) |
| Durée de la maladie | 6.9 (0.1-28) |
| Sévérité de la maladie | |
| médiocre | 7 |
| modérée | 11 |
| sévère | 4 |
| Etendue de la maladie | |
| Colite du côté gauche | |
| .gauche | 6 |
| Colite pan- colite | 23 |
| Système de classification des malts | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Dose totale de stéroïdes (mg) | 17285 (800-70000) |
| Utilisation d’immunosuppresseurs | |
| Oui | 5 |
| Non | 24 |
| Temps opératoire (min) | 262.4 (118-496) |
| Perte sanguine (ml) | 307,9 (17-826) |
Tableau 1 : caractéristiques des patients.
Variation dans le temps de la numération des GB, des neutrophiles et des plaquettes
Les GB, les neutrophiles et les plaquettes ont été comptés respectivement avant la chirurgie, avant la LCAP (après la chirurgie) et après la LCAP (dans les 12 heures suivant la LCAP). Comme le montre la figure 1, la numération des globules blancs, des neutrophiles et des plaquettes était significativement plus faible après la LCAP qu’avant la LCAP. Tous les patients recevant la LCAP postopératoire n’ont pas eu d’effet indésirable hématologique.
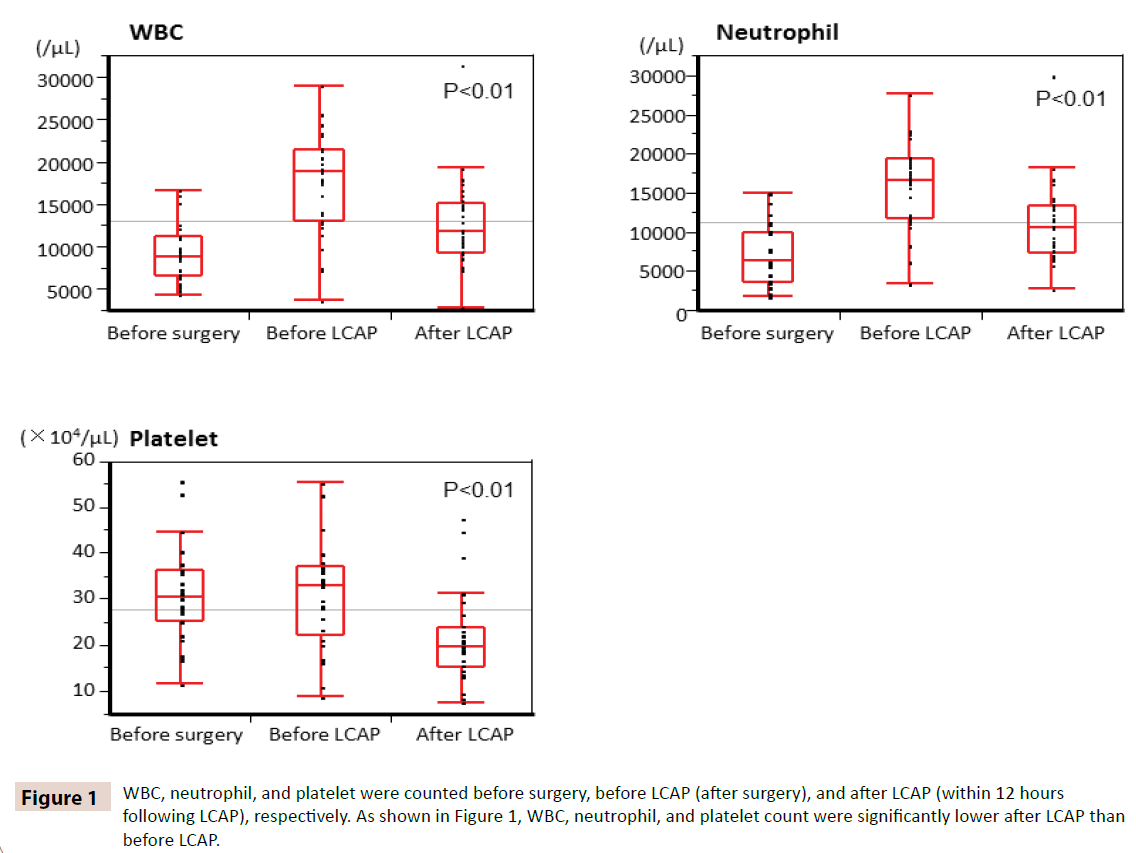
Figure 1 : La numération des WBC, des neutrophiles et des plaquettes ont été comptées avant la chirurgie, avant la LCAP (après la chirurgie) et après la LCAP (dans les 12 heures suivant la LCAP), respectivement. Comme le montre la figure 1, le nombre de WBC, de neutrophiles et de plaquettes était significativement plus faible après la LCAP qu’avant la LCAP.
Activité phagocytaire des neutrophiles contre E. coli
Pour clarifier si la LCAP influence l’activité phagocytaire des neutrophiles circulants, l’activité phagocytaire contre E. coli a été comparée entre les neutrophiles pré et post-LCAP. Comme le montre la figure 2, aucune différence significative dans l’activité phagocytaire des neutrophiles (intensité fluorescente moyenne) contre E. coli n’a été observée entre les neutrophiles pré-LCAP (médiane 1259,4, plage 50,8-3505,6) et post-LCAP (médiane 1077,6, plage 24,4-4152,1) (P=0,72). Ces résultats suggèrent que la LCAP n’affecte pas l’activité phagocytaire des neutrophiles circulants contre E. coli.
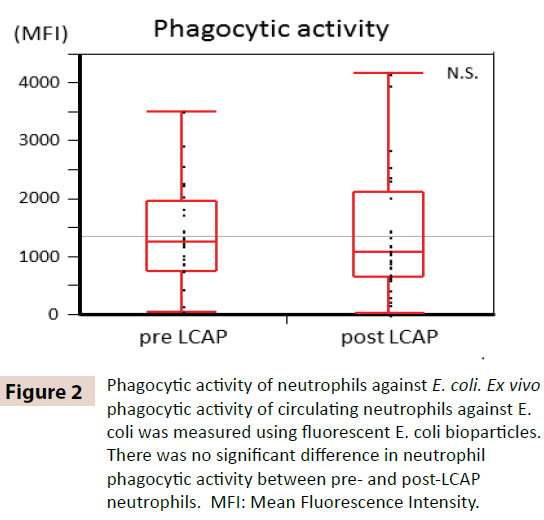
Figure 2 : Activité phagocytaire des neutrophiles contre E. coli. L’activité phagocytaire ex vivo des neutrophiles circulants contre E. coli a été mesurée en utilisant des bioparticules fluorescentes d’E. coli. Il n’y avait pas de différence significative dans l’activité phagocytaire des neutrophiles entre les neutrophiles pré et post-LCAP. MFI : Intensité de Fluorescence Moyenne.
Viabilité des neutrophiles après co-culture avec E. coli
Pour clarifier si la LCAP influence la réponse des neutrophiles contre l’infection bactérienne, la viabilité des neutrophiles contre E. coli a été comparée entre les neutrophiles pré et post-LCAP. Les pourcentages de cellules viables (Annexin V-, PI-), de cellules apoptotiques précoces (Annexin V+, PI-), de cellules nécrotiques (Annexin V-, PI+), et de cellules apoptotiques tardives ou nécrotiques secondaires (Annexin V+, PI+) ont été comparés entre les neutrophiles pré et post-LCAP. Comme le montre la figure 3, le pourcentage médian de neutrophiles viables en coculture avec E. coli était plus élevé dans les neutrophiles post-LCAP (médiane 34,2 %, fourchette 1,16- 77,7 %) que dans les neutrophiles pré-LCAP (médiane 27,9 %, fourchette 0,53-89,7 %), bien que la différence n’ait pas atteint la signification statistique (P=0,82). Le pourcentage de neutrophiles nécrotiques en coculture avec E. coli était significativement plus faible dans les neutrophiles post-LCAP (médiane 0,73%, intervalle 0,0-26,0%) que dans les neutrophiles pré-LCAP (médiane 1,14%, intervalle 0,0-26,0%) (P=0,0232).
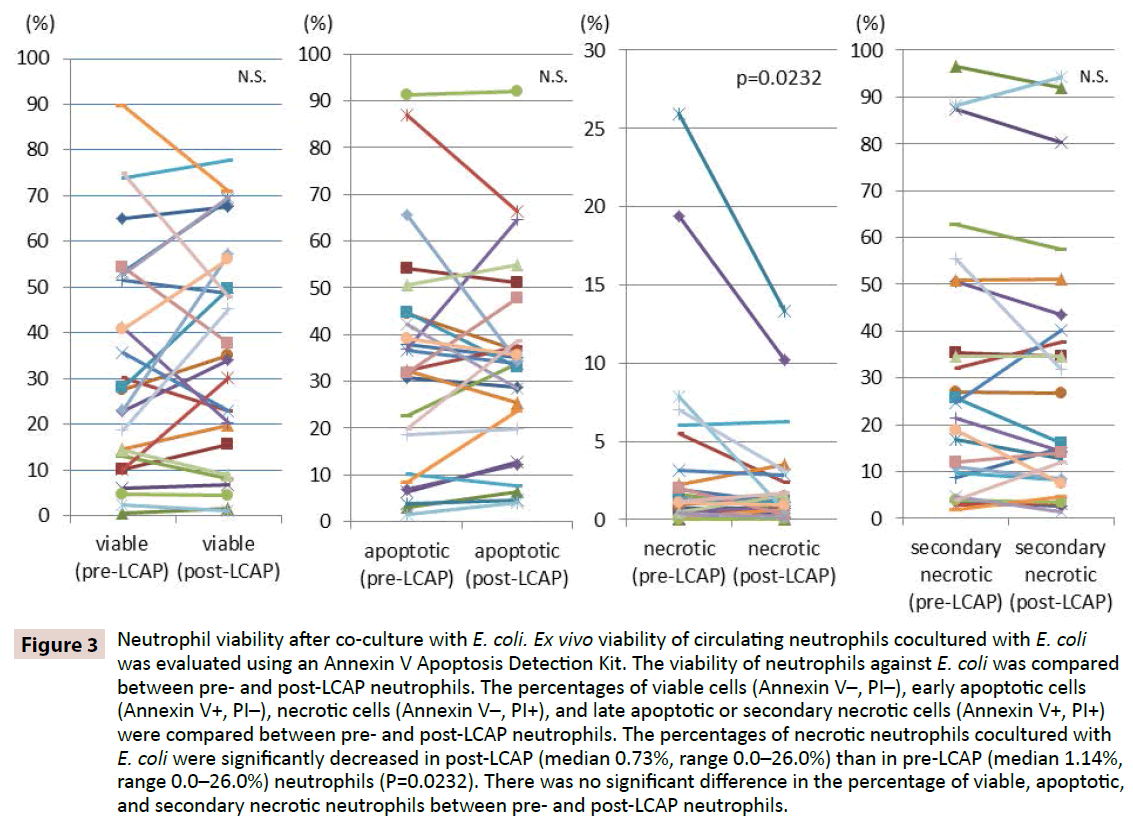
Figure 3 : Viabilité des neutrophiles après coculture avec E. coli. La viabilité ex vivo des neutrophiles circulants coculturés avec E. coli a été évaluée à l’aide d’un kit de détection de l’apoptose par l’Annexin V. La viabilité des neutrophiles face à E. coli a été comparée entre les neutrophiles pré et post-LCAP. Les pourcentages de cellules viables (Annexin V-, PI-), de cellules apoptotiques précoces (Annexin V+, PI-), de cellules nécrotiques (Annexin V-, PI+), et de cellules apoptotiques tardives ou nécrotiques secondaires (Annexin V+, PI+) ont été comparés entre les neutrophiles pré et post-LCAP. Les pourcentages de neutrophiles nécrotiques co-cultivés avec E. coli étaient significativement plus faibles dans les neutrophiles post-LCAP (médiane 0,73 %, intervalle 0,0-26,0 %) que dans les neutrophiles pré-LCAP (médiane 1,14 %, intervalle 0,0-26,0 %) (P=0,0232). Il n’y avait pas de différence significative dans le pourcentage de neutrophiles viables, apoptotiques et nécrotiques secondaires entre les neutrophiles pré et post-LCAP.
Aucune différence significative dans le pourcentage de neutrophiles apoptotiques coculturés avec E. coli n’a été observée entre les neutrophiles pré-LCAP (médiane 32,3 %, plage 1,51-91,2 %) et post-LCAP (médiane 33,8 %, plage 4,0-92,1 %) (P=0,57). Aucune différence significative dans le pourcentage de neutrophiles apoptotiques tardifs ou nécrotiques secondaires en coculture avec E. coli n’a également été observée entre les neutrophiles pré-LCAP (médiane 23,1 %, plage 1,81-96,5 %) et post-LCAP (médiane 16,1 %, plage 1,44-94,3 %) (P=0.13).
Ces résultats suggèrent que la LCAP peut diminuer le sous-ensemble distinct de neutrophiles circulants qui induisent la nécrose contre une infection bactérienne, et augmenter le nombre de neutrophiles viables (probablement non amorcés) dans la circulation systémique.
Production de cytokines par les neutrophiles après une coculture avec E. coli
Pour clarifier si la LCAP influence la production de cytokines par les neutrophiles circulants, les niveaux de cytokines dans les surnageants de culture après une coculture avec E. coli ont été comparés entre les neutrophiles pré et post LCAP. Comme le montre la figure 4, il n’y avait pas de différence significative dans les niveaux de NE, TNF-α, IL-6, IL-8 et IL-1Ra dans les surnageants de culture entre les neutrophiles avant et après LCAP. Ces résultats suggèrent que la LCAP n’affecte pas la production de cytokines des neutrophiles circulants contre E. coli.
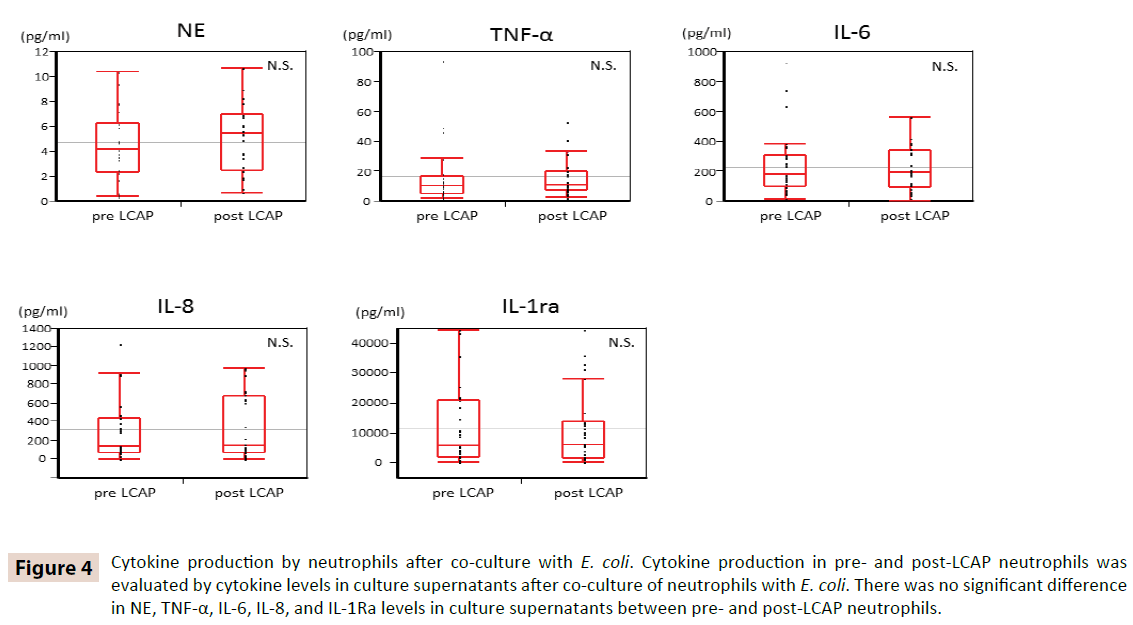
Figure 4 : Production de cytokines par les neutrophiles après une coculture avec E. coli. La production de cytokines dans les neutrophiles pré et post-LCAP a été évaluée par les niveaux de cytokines dans les surnageants de culture après la co-culture des neutrophiles avec E. coli. Il n’y avait pas de différence significative dans les niveaux de NE, TNF-α, IL-6, IL-8 et IL-1Ra dans les surnageants de culture entre les neutrophiles pré et post-LCAP.
Cytokines sériques avant et après la LCAP
Pour clarifier si la LCAP influence la réponse inflammatoire systémique de l’hôte, les cytokines sériques ont été mesurées en utilisant des échantillons de sang prélevés avant et après la LCAP. Comme le montre la figure 5, le sérum NE après la LCAP (médiane 5,62 pg/mL, plage 0,16-10,4 pg/mL) était significativement plus élevé que celui avant la LCAP (médiane 2,87 pg/mL, plage 0,15-7,61 pg/mL) (P=0,0251). Aucune différence significative n’a été trouvée dans les taux sériques de TNF-α, IL-6, IL-8 et IL-1Ra avant et après la LCAP.
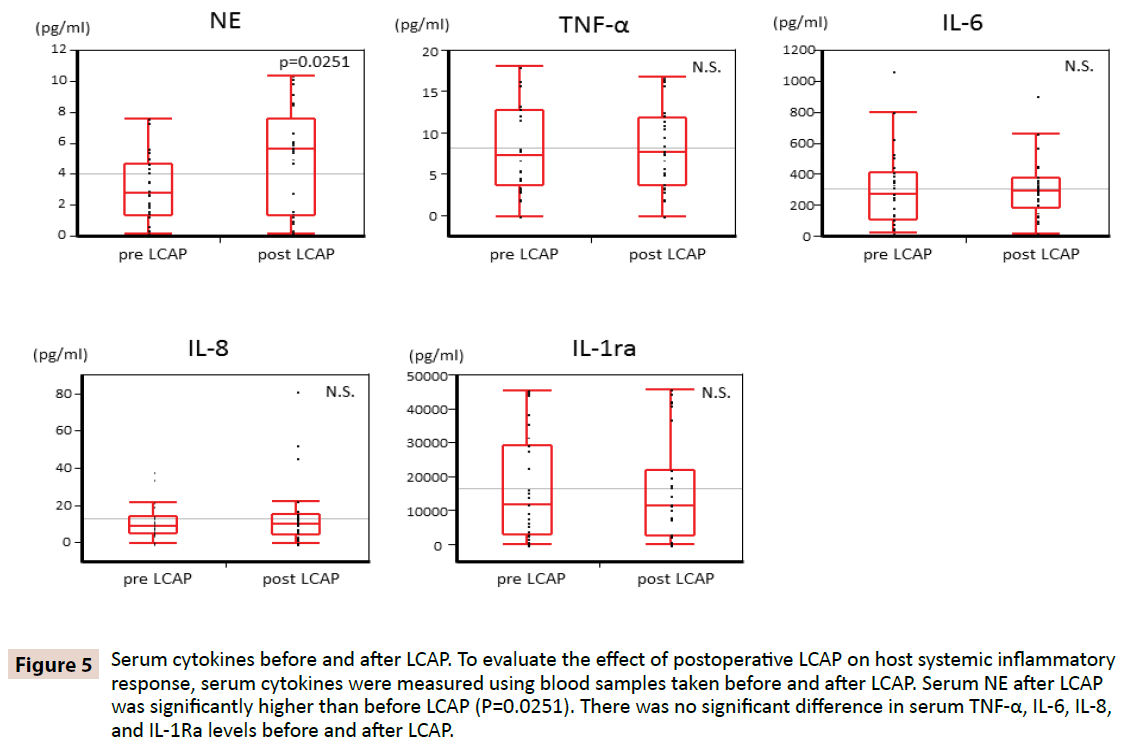
Figure 5 : Cytokines sériques avant et après la LCAP. Pour évaluer l’effet de la LCAP postopératoire sur la réponse inflammatoire systémique de l’hôte, les cytokines sériques ont été mesurées à partir d’échantillons de sang prélevés avant et après la LCAP. La NE sérique après LCAP était significativement plus élevée qu’avant LCAP (P=0.0251). Il n’y avait pas de différence significative dans les taux sériques de TNF-α, IL-6, IL-8, et IL-1Ra avant et après LCAP.
Associations des fonctions neutrophiles post-LCAP avec le temps opératoire ou le nombre de neutrophiles postopératoires
Pour clarifier si les fonctions neutrophiles circulantes après LCAP influencent la survenue des ISO, nous avons examiné l’association entre l’activité phagocytaire ou la production de cytokines des neutrophiles post-LCAP et les facteurs de risque d’ISO liés au stress chirurgical, tels que le temps opératoire, la perte de sang et le nombre de neutrophiles postopératoires.
Comme le montre la figure 6, la NE dans les surnageants après la coculture de neutrophiles post-LCAP avec E. coli était significativement plus élevée chez les patients ayant une durée d’opération >3 h (médiane 5,65 pg/mL, intervalle 0,97-10.7 pg/mL) que chez ceux dont le temps d’opération était <3 h (médiane 1,05 pg/mL, intervalle 0,72-2,44 pg/mL) (P=0,0158).
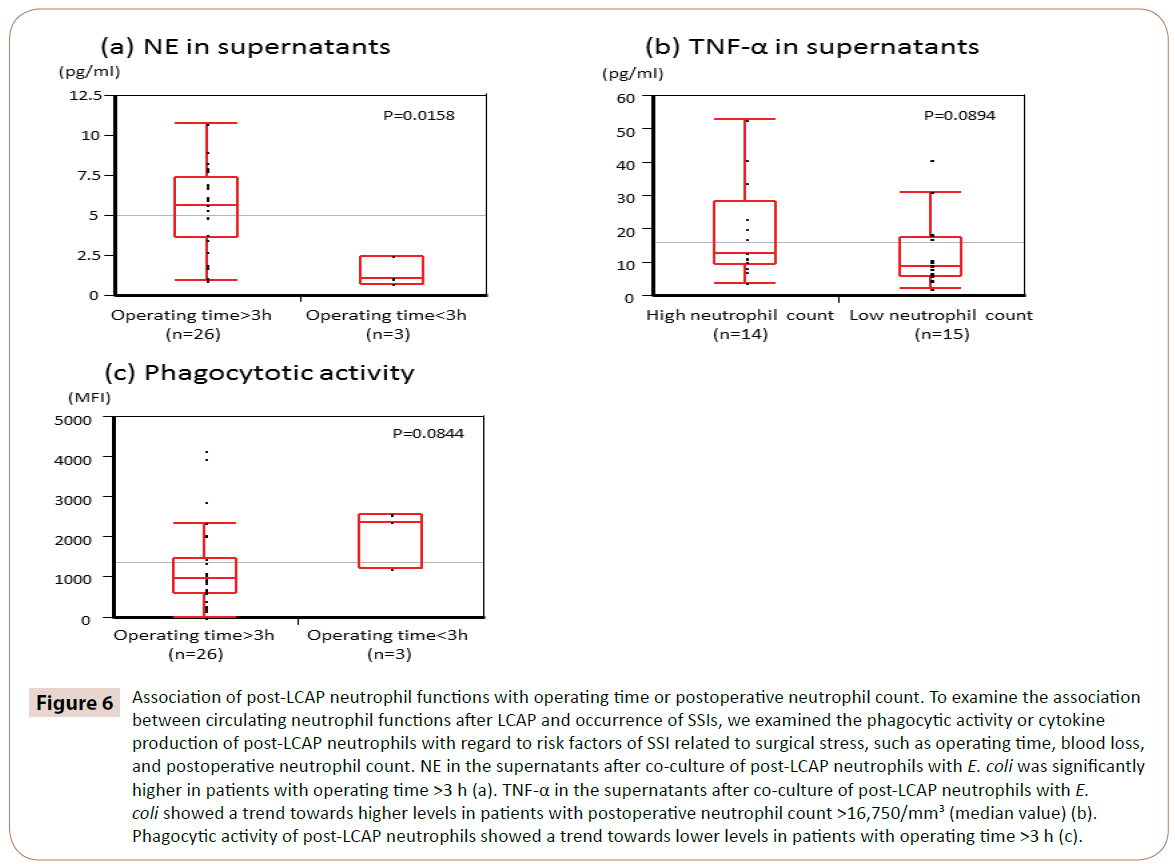
Figure 6 : Association des fonctions neutrophiles post-LCAP avec le temps d’opération ou le nombre de neutrophiles postopératoires. Pour examiner l’association entre les fonctions des neutrophiles circulants après LCAP et la survenue d’ISO, nous avons examiné l’activité phagocytaire ou la production de cytokines des neutrophiles post-LCAP par rapport aux facteurs de risque d’ISO liés au stress chirurgical, tels que le temps opératoire, la perte de sang et le nombre de neutrophiles postopératoires. Le NE dans les surnageants après la co-culture de neutrophiles post-LCAP avec E. coli était significativement plus élevé chez les patients ayant une durée d’opération >3 h (a). Le TNF-α dans les surnageants après la co-culture de neutrophiles post-LCAP avec E. coli a montré une tendance vers des niveaux plus élevés chez les patients avec un nombre de neutrophiles postopératoires >16 750/mm3 (valeur médiane) (b). L’activité phagocytaire des neutrophiles post-LCAP a montré une tendance vers des niveaux plus faibles chez les patients avec une durée d’opération >3 h (c).
TNF-α dans les surnageants après la co-culture de neutrophiles post-LCAP avec E. coli a montré une tendance vers des niveaux plus élevés chez les patients ayant un nombre de neutrophiles postopératoires >16 750/mm3 (valeur médiane) (P=0,0894).
L’activité phagocytaire des neutrophiles post-LCAP contre E. coli a montré une tendance vers des niveaux plus faibles chez les patients ayant une durée d’opération >3 h (P=0,0844).
Associations entre le TNF-α sérique après LCAP et les ISO
Pour clarifier si la réponse inflammatoire systémique de l’hôte après LCAP influence la survenue des ISO, nous avons examiné l’association entre les niveaux de cytokines sériques après LCAP et la survenue des ISO.
Comme le montre la figure 7, le TNF-α sérique après LCAP a montré une tendance à des niveaux plus élevés chez les patients qui ont développé des ISO que chez ceux qui n’en ont pas développé (P=0,0714).
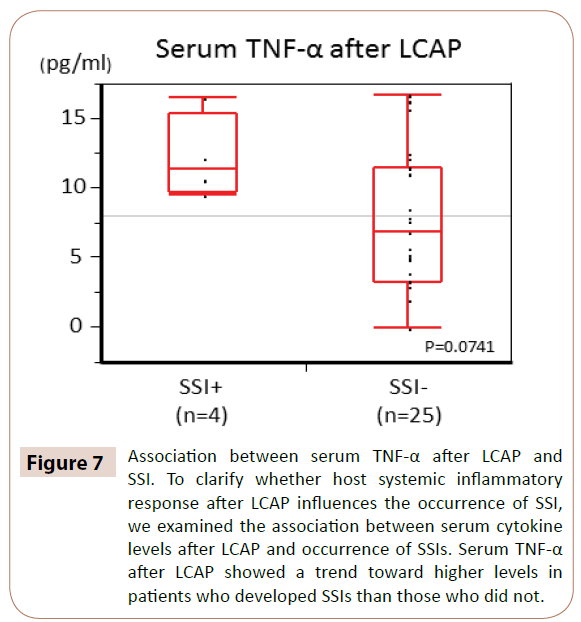
Figure 7 : Association entre le TNF-α sérique après LCAP et les ISO. Pour clarifier si la réponse inflammatoire systémique de l’hôte après LCAP influence la survenue d’ISO, nous avons examiné l’association entre les niveaux de cytokines sériques après LCAP et la survenue d’ISO. Le TNF-α sérique après LCAP a montré une tendance à des niveaux plus élevés chez les patients qui ont développé des ISO que chez ceux qui n’en ont pas développé.
Il n’y avait pas de différence significative entre les niveaux sériques d’IL-6, IL-8 et IL-1Ra après LCAP et la survenue d’ISO.
Discussion
Plusieurs mécanismes d’action possibles de LCAP ou de GMA ont été rapportés , bien que leurs mécanismes exacts n’aient pas été entièrement étudiés. La variabilité des résultats semble dépendre des différences entre les cellules sanguines utilisées pour les analyses (granulocytes, monocytes ou lymphocytes), les méthodes de prélèvement sanguin (prises dans la ligne d’entrée ou de sortie, ou dans la veine périphérique), et les sujets de l’étude (volontaires sains ou patients malades).
La plupart des chercheurs ont utilisé des leucocytes tels que des neutrophiles, des monocytes ou des lymphocytes prélevés dans les lignes d’entrée et de sortie d’un dispositif de circulation extracorporelle . Les leucocytes provenant des lignes de sortie sont les cellules restantes filtrées par le LCAP. Ils sont immédiatement remis dans la circulation systémique des patients et remélangés aux leucocytes circulants. Les leucocytes des lignes de sortie représentent la petite proportion de tous les leucocytes circulants après la LCAP. Pour clarifier l’effet systémique de la LCAP sur le système immunitaire de l’hôte, nous avons utilisé des neutrophiles circulants isolés des veines périphériques de patients atteints de RCH.
À proprement parler, la leucocytaphérèse (LCAP) devrait être qualifiée de leucocytafiltration car elle peut non seulement éliminer les leucocytes mais aussi les activer à travers le filtre. En fait, la LCAP ne peut pas absorber et éliminer toutes les cellules sanguines qui y sont entrées. Un certain nombre de cellules sanguines peuvent passer à travers le filtre et retourner ensuite dans la circulation. On pense que les cellules sanguines filtrées sont activées par la filtration de la LCAP.
Les neutrophiles sont la population la plus abondante de leucocytes et les cellules les plus efficacement éliminées par la LCAP. Le nombre estimé de leucocytes filtrés est de près de 1,1 × 1010 cellules par session unique de LCAP , ce qui pourrait être comparable à l’élimination de près de la moitié du nombre de neutrophiles circulants (2 × 10-3 × 1010 cellules). Nous avons donc étudié la différence fonctionnelle entre les neutrophiles pré-LCAP et post-LCAP en ce qui concerne la réponse à E. coli afin de clarifier les mécanismes potentiels de l’observation clinique selon laquelle la LCAP postopératoire réduit l’incidence des ISO. Cependant, la LCAP utilisant Cellsorba peut éliminer et activer non seulement les neutrophiles, mais aussi les autres cellules sanguines (monocytes, lymphocytes et plaquettes) avec une efficacité d’élimination différente. Par conséquent, il est nécessaire d’étudier le changement de la réponse à E. coli non seulement sur les neutrophiles, mais aussi sur les autres cellules sanguines entre le pré et le post-LCAP, bien qu’ils n’aient pas été évalués dans cette étude.
L’un des résultats les plus significatifs de la présente étude est le fait que le pourcentage de neutrophiles nécrotiques était significativement réduit lorsque les neutrophiles post-LCAP étaient co-cultivés avec E. coli, par rapport aux neutrophiles pré-LCAP. Cette observation suggère que la LCAP diminue la proportion de neutrophiles qui induisent à la nécrose par E. coli, et augmente la proportion de neutrophiles viables (probablement non amorcés) dans la circulation systémique.
Une grande variation du pourcentage de viabilité, d’apoptose ou de nécrose des neutrophiles en co-culture avec E. coli a été observée. Dans nos récentes données non publiées, le pourcentage d’apoptose précoce (Annexin V+, PI-) dans les neutrophiles circulants variait largement d’environ 10 % à 90 % chez les patients présentant une inflammation systémique telle qu’une protéine C-réactive élevée >0,3 mg/L. Ces observations suggèrent que les neutrophiles peuvent être déjà apoptotiques sans coculture d’E. coli en raison d’insultes chirurgicales plus élevées.
La nécrose est considérée comme une mort cellulaire incontrôlée, et elle semble libérer des espèces d’oxygène toxiques et des enzymes protéolytiques de manière inattendue . La nécrose des neutrophiles est connue pour être la principale cause de dommages aux voies respiratoires et aux poumons dans les poumons intensément enflammés des patients atteints de mucoviscidose . La LCAP postopératoire peut induire le recrutement d’un sous-ensemble de neutrophiles résistant à une mort cellulaire nécrotique inattendue ou incontrôlée contre une infection bactérienne dans la circulation systémique, en plus de l’élimination des leucocytes activés qui provoquent une inflammation systémique.
Contrairement aux résultats ci-dessus des expériences ex vivo, la NE sérique après la LCAP était significativement augmentée. La réduction immédiate de la NE sérique par la LCAP n’a pas été observée. Une explication possible est qu’une seule séance de LCAP peut ne pas supprimer suffisamment la libération de NE par les neutrophiles du corps entier dans l’inflammation systémique induite par la chirurgie
Les neutrophiles circulants après LCAP isolés des patients ayant une durée d’opération plus longue (>3 h) ou un nombre de neutrophiles postopératoire plus élevé (>16 750/mm3 ; valeur médiane) ont montré non seulement une activité de production plus élevée de NE ou de TNF-α, mais aussi une activité phagocytaire plus faible contre E. coli. Ces résultats suggèrent que les neutrophiles isolés de patients soumis à un stress chirurgical élevé présentent une production excessive de cytokines pro-inflammatoires ou une activité phagocytaire altérée, même après le renouvellement des neutrophiles par LCAP postopératoire.
Parmi les 29 patients atteints de RCH avec LCAP postopératoire, seuls quatre patients (13,8%) ont développé des ISO. Leur TNF-α sérique après LCAP était plus élevé que celui des patients sans ISO, bien que la différence n’ait pas atteint la signification statistique. Par conséquent, le TNF-α sérique peut être utile pour identifier les patients qui développeront des ISO après une LCAP postopératoire. Cependant, aucune association entre le développement des ISO et la viabilité, l’apoptose ou la nécrose des neutrophiles en coculture avec E. coli n’a été observée, ce qui peut être partiellement dû à la petite taille de l’échantillon.
Récemment, les neutrophiles circulants ont été reconnus comme une population fonctionnellement hétérogène et différentiellement amorcée contre diverses insultes . Nous avons signalé l’importance clinique des neutrophiles circulants dans l’inflammation systémique . Nous pensons que les neutrophiles circulants peuvent être la cible principale pour explorer l’effet systémique de la LCAP sur le système immunitaire de l’hôte.
En outre, certains chercheurs ont signalé que la déleucocytation, qui élimine les cellules polymorphonucléaires de la circulation systémique à l’aide de filtres à leucocytes, entraîne une amélioration significative de la fonction pulmonaire et rénale des patients qui développent un syndrome de réponse inflammatoire systémique (SIRS) après une dérivation cardiopulmonaire . Le ciblage de la déleucocytation des neutrophiles peut être bénéfique pour prévenir la défaillance des organes due au SIRS .
En conclusion, il s’agirait du premier rapport démontrant que la LCAP postopératoire diminue le sous-ensemble de neutrophiles circulants qui induisent la nécrose contre une infection bactérienne. Il pourrait être bénéfique pour la prévention des ISO de réduire la mort cellulaire nécrotique inattendue ou incontrôlée causée par la libération de substances toxiques ou protéolytiques dans la circulation systémique.
Reconnaissance
Les auteurs remercient Motoko Ueeda et Chihiro Hibi pour leur excellente assistance technique.
Contribution des auteurs
K.T., T.A., et M.K. ont conçu et réalisé les expériences, analysé et interprété les données, et rédigé le manuscrit. S.Y., Y.O., et S.K. ont réalisé les expériences et analysé les données. Y.T., M.I., M.O., M.K., Y.I., K.U. et Y.M. ont conçu les expériences et ont analysé et interprété les données. C.M. et M.K. ont conçu les expériences et interprété les données.
Soutien financier et divulgation des arrangements financiers
Ce travail a été soutenu en partie par des subventions du ministère de l’Éducation, de la Culture, des Sports, de la Science et de la Technologie du Japon (KAKENHI 23791523 à S.Y., 25861181 à Y.O., et 24791887 à M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Vivre et mourir pour l’inflammation : neutrophiles, éosinophiles, basophiles. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Dysfonctionnement des neutrophiles circulants dans l’insuffisance hépatique aiguë. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) État actuel et perspectives futures de la leucocytaphérèse pour les maladies inflammatoires de l’intestin. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Facteurs affectant les effets à court et à long terme de la thérapie d’élimination des leucocytes dans la colite ulcéreuse active. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Évaluation de la leucocytaphérèse par filtration pour une utilisation dans le traitement des patients atteints de polyarthrite rhumatoïde. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leucocytaphérèse utilisant un filtre d’élimination des leucocytes. TherApher6 : 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) Un nouveau paradigme dans la colite ulcéreuse : les cellules T régulatrices sont un facteur clé qui induit/exacerbe la CU par un déséquilibre immunitaire. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Effets immunomodulateurs de l’aphérèse d’adsorption des granulocytes et des monocytes comme traitement des patients atteints de colite ulcéreuse. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) Évaluation in vitro et in vivo de l’adacolumncytaphérèse chez des sujets sains. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)Une revue systématique des facteurs de risque associés aux infections du site opératoire chez les patients chirurgicaux. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013)Facteurs de risque d’infection du site chirurgical chez les patients japonais atteints de colite ulcéreuse : une étude prospective multicentrique. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Application postopératoire précoce de l’aphérèse leucocytaire extracorporelle chez les patients atteints de colite ulcéreuse : résultats d’un essai pilote pour prévenir les complications septiques postopératoires. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Efficacité de la leucocytaphérèse dans la suppression de l’apparition d’infections du site chirurgical après une chirurgie pour la colite ulcéreuse. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factors predicting postoperative infectious complications and early induction of inflammatory mediators in ulcerative colitis patients. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Dysfonctionnement des neutrophiles chez les patients atteints de colite ulcéreuse surdosés en stéroïdes : pertinence potentielle du facteur d’inhibition de la migration des macrophages dans l’augmentation de la morbidité postopératoire. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Classification de la mort cellulaire : recommandations du Comité de nomenclature sur la mort cellulaire 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mécanisme de dysfonctionnement des neutrophiles : les sérines protéases des neutrophiles clivent et inactivent le récepteur C5a. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Preuve directe de la nécrose secondaire des neutrophiles pendant une inflammation pulmonaire intense. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Nécrose des neutrophiles et dégradation de l’annexine 1 associées à l’inflammation des voies respiratoires chez les transplantés pulmonaires atteints de mucoviscidose. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Hétérogénéité fonctionnelle et amorçage différentiel des neutrophiles circulants dans l’endotoxémie expérimentale humaine. J LeukocBiol88:211-220.
- Mócsai A (2013)Diverses nouvelles fonctions des neutrophiles dans l’immunité, l’inflammation et au-delà. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)Les effets de la leucodéplétion chez les patients qui développent le syndrome de réponse inflammatoire systémique après un pontage cardio-pulmonaire. Perfusion. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013)Déplétion des neutrophiles sanguins des patients atteints de sepsis : un traitement d’avenir ? IntImmunopharmacol17:1226-1232.