4.3 Liaisons covalentes multiples
Objectif d’apprentissage
- Reconnaître les molécules qui sont susceptibles d’avoir des liaisons covalentes multiples.
Dans de nombreuses molécules, la règle de l’octuor ne serait pas satisfaite si chaque paire d’atomes liés partage deux électrons. Prenons l’exemple du dioxyde de carbone (CO2). Si chaque atome d’oxygène partage un électron avec l’atome de carbone, nous obtenons ce qui suit :
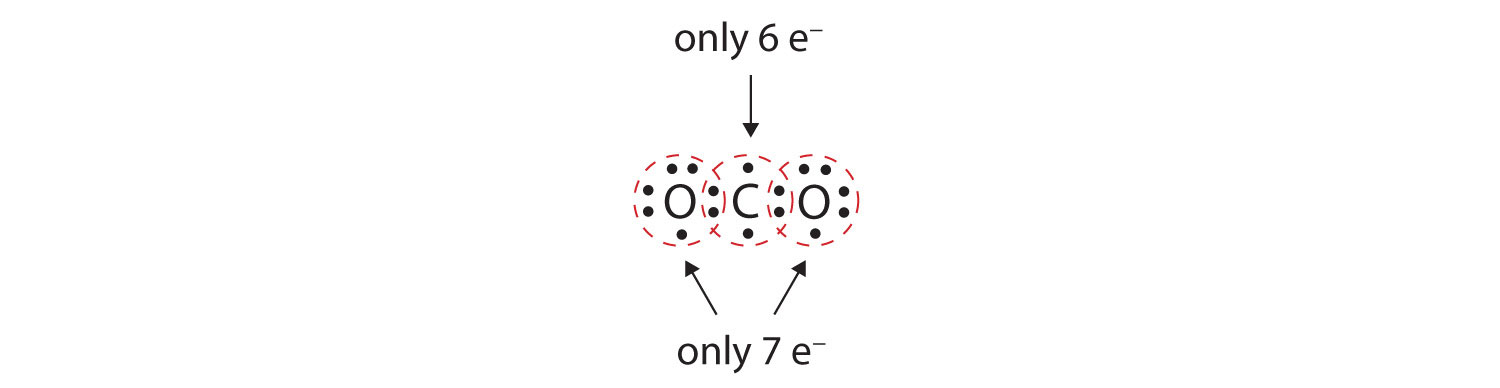
Cela ne donne pas à l’atome de carbone un octuor complet ; vous ne trouverez que six électrons dans sa coquille de valence. De plus, chaque atome d’oxygène ne possède que sept électrons dans sa coquille de valence. Enfin, aucun atome ne fait le nombre de liaisons qu’il forme habituellement (figure 4.2 » Combien de liaisons covalentes sont formées ? « ). Cette disposition des électrons partagés est loin d’être satisfaisante.
Parfois, plus d’une paire d’électrons doit être partagée entre deux atomes pour que les deux atomes aient un octuor. Dans le dioxyde de carbone, un deuxième électron de chaque atome d’oxygène est également partagé avec l’atome de carbone central, et l’atome de carbone partage un électron supplémentaire avec chaque atome d’oxygène :
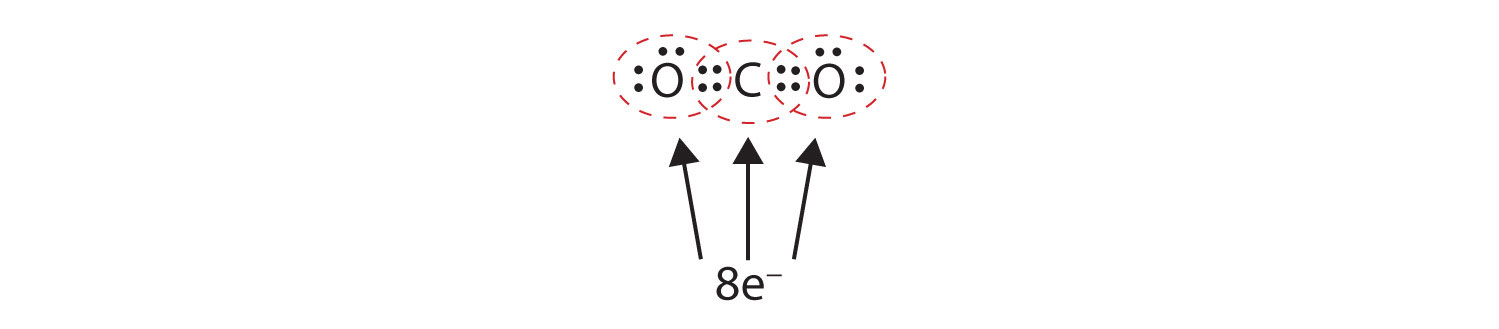
Dans cet arrangement, l’atome de carbone partage quatre électrons (deux paires) avec l’atome d’oxygène à gauche et quatre électrons avec l’atome d’oxygène à droite. Il y a maintenant huit électrons autour de chaque atome. Deux paires d’électrons partagées entre deux atomes forment une double liaisonDeux paires d’électrons partagées par deux atomes dans une molécule. entre les atomes, qui est représentée par un double tiret :
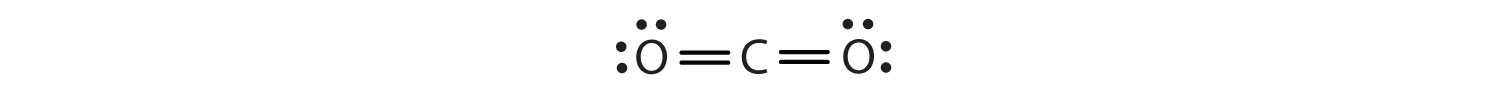
Certaines molécules contiennent des liaisons triplesTrois paires d’électrons partagées par deux atomes dans une molécule, des liaisons covalentes dans lesquelles trois paires d’électrons sont partagées par deux atomes. Un composé simple qui possède une triple liaison est l’acétylène (C2H2), dont le diagramme de Lewis est le suivant :

Exemple 5
Dessinez le diagramme de Lewis pour chaque molécule.
- N2
- CH2O (L’atome de carbone est l’atome central.)
Solution
-
La liaison entre les deux atomes d’azote est une triple liaison. Le diagramme de Lewis de N2 est le suivant :

-
Dans CH2O, l’atome central est entouré de deux types d’atomes différents. Le diagramme de Lewis qui remplit la coquille électronique de valence de chaque atome est le suivant :

Note
Une application du CH2O, également appelé formaldéhyde, est la conservation des spécimens biologiques. Les solutions aqueuses de CH2O sont appelées formol et ont une odeur forte et caractéristique (piquante).
Exercice de construction de compétences
-
O2
-
C2H4
Dessinez le diagramme de Lewis pour chaque molécule.
Exercice de révision des concepts
-
Quel est l’indice qu’une molécule possède une liaison multiple ?
Réponse
-
Si les liaisons simples entre tous les atomes ne donnent pas à tous les atomes (sauf l’hydrogène) un octuor, des liaisons covalentes multiples peuvent être présentes.
Clef à retenir
- Certaines molécules doivent avoir des liaisons covalentes multiples entre les atomes pour satisfaire la règle de l’octuor.
Exercices
-
Chaque molécule contient des liaisons multiples. Dessinez le diagramme de Lewis pour chacune d’elles. Le premier élément est l’atome central.
- CS2
- C2F4
- COCl2
-
Chaque molécule contient des liaisons doubles. Dessinez le diagramme de Lewis pour chacune d’elles. Supposez que le premier élément est l’atome central, sauf indication contraire.
- N2
- HCN (L’atome de carbone est l’atome central.)
- POCl (L’atome de phosphore est l’atome central.)
-
Expliquez pourquoi les atomes d’hydrogène ne forment pas de double liaison.
-
Pourquoi est-il incorrect de dessiner une double liaison dans le diagramme de Lewis pour MgO ?
Réponses
-
-
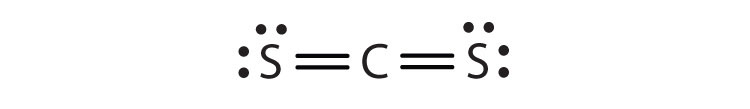
-
.
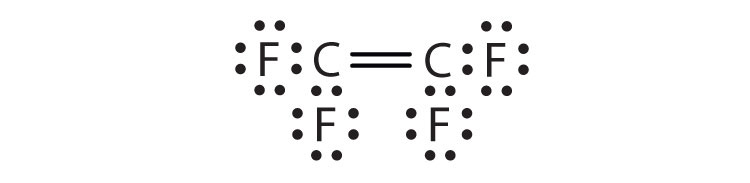
-
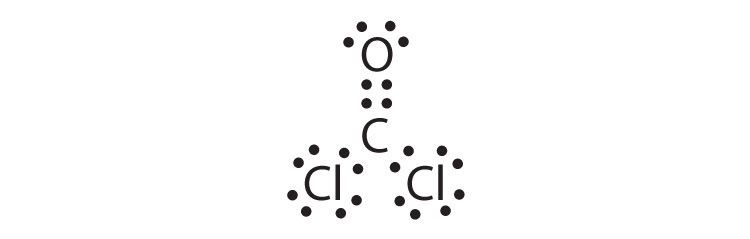
-
-
L’hydrogène ne peut accepter qu’un seul électron supplémentaire ; les liaisons multiples nécessitent le partage de plus d’une paire d’électrons.