L’uvée, une section hautement vascularisée de l’œil située sous la sclérotique, alimente la plupart des structures oculaires en nutriments via les branches antérieures et postérieures de l’artère ophtalmique.
L’uvée est constituée de l’iris, du corps ciliaire et de la choroïde. L’iris contrôle la quantité de lumière qui entre dans l’œil, tandis que le corps ciliaire produit l’humeur aqueuse et contrôle son écoulement en contractant et en élargissant le réseau trabéculaire. Le corps ciliaire contrôle également l’accommodation en se contractant et en se relâchant.
Le troisième élément, la choroïde, est un tissu hautement vascularisé et pigmenté qui nourrit les couches rétiniennes externes et absorbe l’excès de lumière. L’inflammation de l’une de ces structures est connue sous le nom d’uvéite.
Un synonyme d’uvéite est l’iritis, et bien que l’iritis soit plus spécifique techniquement et anatomiquement, les cliniciens utilisent souvent les termes de manière interchangeable. La forme la plus courante de cette maladie est l’uvéite antérieure non granulomateuse, qui peut se présenter comme unilatérale ou bilatérale ; chronique ou aiguë ; et idiopathique, infectieuse, immunologique ou néoplasique.
Les symptômes classiques comprennent la rougeur, la photophobie et la douleur souvent décrite comme une douleur sourde ; cependant, dans les formes chroniques de la maladie, ces symptômes peuvent être complètement absents. Souvent, une histoire médicale et oculaire suffisante peut révéler la cause précipitante, bien que même les tests de laboratoire ne puissent pas découvrir l’étiologie sous-jacente dans tous les cas.
Quoi qu’il en soit, il est important de classer correctement l’uvéite afin de diagnostiquer et de traiter correctement le patient, éliminant ainsi le potentiel de complications supplémentaires, y compris la cécité. Cet article passera en revue les signes et symptômes typiques de l’uvéite antérieure, et abordera les considérations essentielles en matière de traitement.
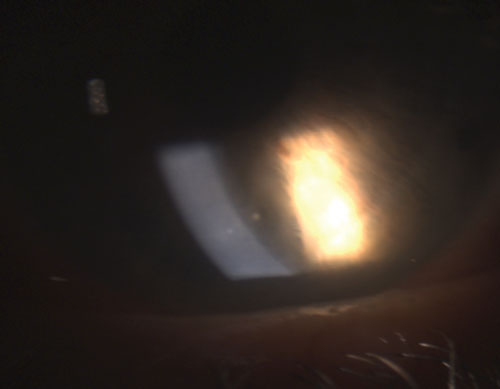
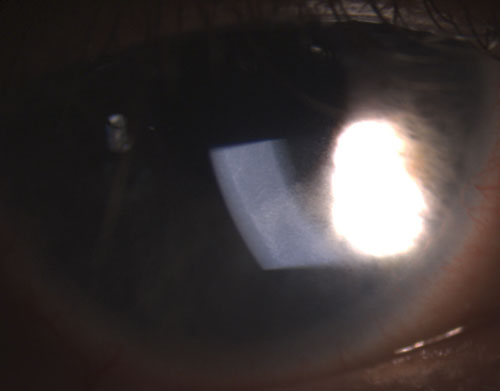
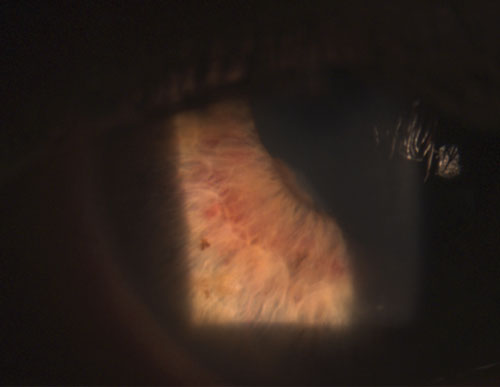
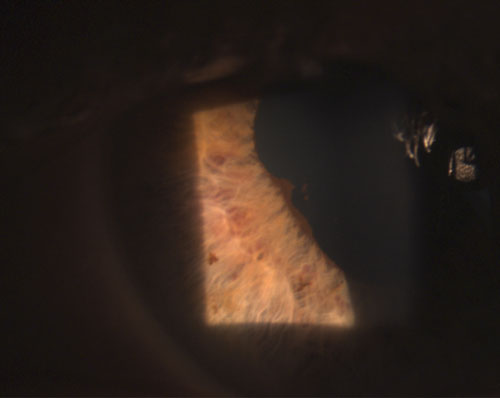
4. Synéchie postérieure partiellement rompue après instillation de phényléphrine 10% et d’atropine 1%.
Classification de la maladie, bilan et diagnostic
Lorsque vous diagnostiquez une uvéite antérieure, vous devez prendre en compte une variété de signes de présentation et de caractéristiques associées. Comme nous l’avons déjà noté, les symptômes caractéristiques comprennent une douleur sous la forme d’une douleur sourde, une rougeur et une photophobie. Sur le plan visuel, on observe souvent le flush ciliaire habituel (circumlimbal flush) et la pupille peut être mi-dilatée. Pour un diagnostic officiel, cependant, des cellules doivent être observées dans la chambre antérieure, et le flare peut être présent ou non. Il est important de noter que le flare peut parfois être vu dans la chambre antérieure alors qu’aucune inflammation active n’est présente, car une uvéite chronique de longue date endommage l’intégrité de la vascularisation de l’iris et du corps ciliaire.1
Pour diagnostiquer et gérer correctement une uvéite, il faut d’abord la catégoriser. L’inflammation antérieure confinée à l’iris et à la chambre antérieure est appelée iritis. Lorsque l’inflammation concerne également le corps ciliaire, comme en témoigne la présence de cellules vitréennes antérieures, on parle d’iridocyclite. Cependant, lorsque seul le corps ciliaire est enflammé, on parle simplement de cyclitis (bien que ce terme ne soit généralement pas cliniquement significatif). L’uvéite intermédiaire, ou pars planitis, implique une inflammation de la pars plana, la partie médiane du corps ciliaire. Des agrégats de globules blancs, ou opacités en boule de neige, accumulés près de la rétine inférieure sont typiquement observés dans la pars planitis.1
L’uvéite postérieure implique une inflammation dans le segment postérieur, y compris la rétine, la choroïde, le vitré et parfois la sclère, tandis que la pan-uvéite implique toutes les structures de l’uvée en plus des tissus adjacents. Il convient de noter que plus l’uvéite progresse dans le segment postérieur de l’œil, plus le risque de maladie systémique associée est élevé, plus elle sera difficile à traiter et plus le risque de complications sera grand. Dans tous les cas, la différence entre les sémantiques spécifiques aide le médecin dans son diagnostic clinique et dirige l’attention vers les zones de préoccupation appropriées.
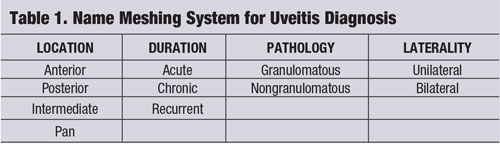
Une stratégie de « maillage des noms » (voir « Système de maillage des noms pour le diagnostic de l’uvéite ») est un outil qui peut être utilisé pour focaliser la pensée clinique et fournir une évaluation et une gestion adaptées et rentables de la maladie du patient.2-4 L’entité uvéitique doit être décomposée par sa localisation, sa durée, sa pathologie et sa latéralité1-4.
En référence à l’inflammation oculaire, le terme « granulomateux » désigne généralement une forme plus sévère d’uvéite, avec des caractéristiques distinctives telles que des granulomes iriens, des nodules de Koeppe sur le bord pupillaire, des nodules de Busacca dans le stroma irien et des précipités kératiques (PK) sur l’endothélium cornéen qui sont gros, globulaires et gras, connus sous le nom de PK de graisse de mouton (figure 1).1-3,5 Un hypopion peut se former dans la chambre antérieure si l’inflammation n’est pas maîtrisée.
Les uvéites granulomateuses courantes comprennent la tuberculose, la sarcoïdose et la maladie de Lyme2. L’inflammation oculaire non granulomateuse, en revanche, est moins sévère et se caractérise par des KP plus petits (figure 2), moins de nodules (s’il y en a) et une probabilité moindre de formation de synéchies (figures 3 et 4).2,3 Dans l’ensemble, l’uvéite granulomateuse est plus susceptible d’être associée à une maladie systémique et plus difficile à traiter avec un plus grand risque de complications que l’uvéite non granulomateuse.
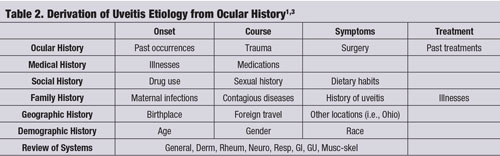
Souvent, une histoire oculaire spécifique – en conjonction avec un examen minutieux à la lampe à fente – peut conduire à l’étiologie correcte de l’uvéite sans aucun autre test ou étude de laboratoire. (Voir « Dérivation de l’étiologie de l’uvéite à partir de l’histoire oculaire », page 60.)1
Le « système des neuf « I » », qui classe les inflammations des tissus oculaires dans une rubrique spécifique, est un autre instrument de classification utile (voir « Le système des neuf « I » ».) N’importe lequel des neuf « I » peut être la cause profonde de l’uvéite, jusqu’à 38% des cas étant idiopathiques6.
Les indices sanglants
L’uvéite aiguë non granulomateuse peut être associée à l’antigène leucocytaire humain B27 (HLA-B27). Parmi les autres entités qui peuvent être liées à l’HLA-B27, citons le syndrome de Reiter, les maladies inflammatoires du bol (c’est-à-dire la colite ulcéreuse ou la maladie de Crohn), la spondylarthrite ankylosante, la maladie de Behçet et le rhumatisme psoriasique.1,6,7 Ces entités sont généralement antérieures et unilatérales. Parmi les autres uvéites aiguës non granulomateuses figurent la maladie de Lyme et les traumatismes. Les entités chroniques non granulomateuses courantes comprennent la polyarthrite rhumatoïde juvénile et l’iridocyclite hétérochrome de Fuchs.3,4,6
L’uvéite chronique est généralement moins symptomatique que les présentations aiguës. Bien que la syphilis soit typiquement classée dans l’uvéite granulomateuse chronique avec la sarcoïdose et la tuberculose, elle peut se présenter dans n’importe laquelle de ces catégories comme un masque.4,6
Les uvéites postérieures comprennent la tuberculose, la toxoplasmose, l’histoplasmose, la sarcoïdose et l’herpès – bien que l’herpès soit aussi souvent antérieur.3,6 Bien qu’habituellement postérieure, toute forme d’uvéite postérieure peut rarement se présenter antérieurement. Une entité qui peut être classée à tort dans la catégorie des uvéites antérieures idiopathiques est la crise glaucomatocyclique (c’est-à-dire le syndrome de Posner-Schlossman).1 Il s’agit classiquement d’un œil blanc avec une légère réaction de la chambre antérieure et une PIO très élevée (30 mm Hg à 60 mm Hg). Elle a tendance à être unilatérale, récurrente et relativement asymptomatique.1,5
Des études sanguines doivent souvent être demandées dans les cas où l’histoire et l’examen physique ne permettent pas de poser un diagnostic définitif–en particulier en présence d’une uvéite bilatérale, granulomateuse ou récurrente.6 L’approche « shotgun » est coûteuse, non spécifique et peut facilement être évitée avec des compétences cliniques astucieuses.

Voici quelques-uns des tests de laboratoire les plus courants utilisés pour aider à localiser l’étiologie de l’uvéite :6-8
– La numération formule sanguine complète (NFS) avec différentiel permet de déterminer l’état de santé général du patient, et peut aider à diagnostiquer une variété de troubles, tels que l’anémie, l’infection et la leucémie.
– La protéine C-réactive (CRP) est un marqueur de l’inflammation et sert à surveiller la réponse au traitement2,4. Les tests de CRP ne peuvent cependant pas déterminer la cause ou la localisation de l’inflammation dans le corps.
– La vitesse de sédimentation des érythrocytes (ESR) est généralement demandée en conjonction avec un test de CRP. Une ESR permet de détecter l’inflammation et sert à surveiller l’étiologie sous-jacente.
– Le test des anticorps antinucléaires (ANA) permet de dépister certaines maladies auto-immunes comme le lupus érythémateux systémique, la sclérodermie, l’arthrite juvénile, la polymyosis, les maladies inflammatoires de l’intestin et le psoriasis.
– Le test du facteur rhumatoïde (FR) peut vous aider à diagnostiquer la polyarthrite rhumatoïde et le syndrome de Sjögren, entre autres, qui se chevauchent parfois avec le test ANA.
– La reprise rapide du plasma (RPR), le laboratoire de recherche des maladies vénériennes (VDRL) et le test d’absorption des anticorps tréponémiques fluorescents (FTA-ABS) sont utilisés pour dépister la syphilis. Le FTA-ABS est un test de 24 heures utilisé pour détecter les anticorps contre la bactérie Treponema pallidum et confirmer la présence de la syphilis. Le FTA-ABS n’indique toutefois pas si la maladie est active ou inactive et est généralement administré après un test de dépistage de la maladie active, le RPR ou le VDRL. D’autres tests tréponémiques sont disponibles, tels que la microhémagglutination-Treponema pallidum (MHA-TP), le test d’agglutination de particules de Treponema pallidum (TP-PA) et le test d’hémaglutination de Treponema pallidum (TPHA), mais ils ne sont pas aussi connus dans les milieux ophtalmologiques que le FTA-ABS.
|
Les deux tests RPR et VDRL se révèlent généralement positifs en cas de syphilis primaire et secondaire et négatifs en cas de syphilis tertiaire (latente) et après un traitement réussi de la maladie.4 Le RPR est généralement choisi par rapport au VDRL car il est à la fois plus facile à administrer et moins coûteux. Des faux positifs peuvent toutefois se produire avec les deux tests. Les entités qui peuvent perturber l’exactitude des résultats comprennent, sans s’y limiter, la tuberculose, le paludisme, le lymphome, le lupus, la maladie de Lyme, les infections virales, les maladies du tissu conjonctif, l’utilisation de drogues IV et la grossesse.
– L’enzyme de conversion de l’angiotensine (ECA) soutient un diagnostic de sarcoïdose et aide à surveiller l’activité de la maladie pendant le traitement. Un test de lysozyme sérique peut également être utilisé pour rechercher une sarcoïdose.
– La radiographie pulmonaire (CXR) ou la tomodensitométrie (CT) est également utile pour rechercher une tuberculose ou des nodules sarcoïdaux dans les poumons.6 Normalement, lorsque je demande une CXR pour exclure une sarcoïdose, je demande des images postérieures-antérieures et latérales (PA/LAT). Dans tous les cas, il est important d’annoter ce que vous recherchez (par exemple, exclure des nodules sarcoïdes dans le cadre d’une uvéite bilatérale) pour aider le radiologue à orienter son examen. En milieu hospitalier, il est également primordial, lors de la prescription de ces examens, d’engager le médecin de soins primaires (PCP) du patient ou le spécialiste approprié si des anomalies sont trouvées.
Pour les ophtalmologistes qui n’ont pas accès aux laboratoires ou à l’imagerie, le fait d’envoyer le patient à son PCP avec des recommandations exactes sur les tests à demander et pourquoi contribuera à la rapidité pour le patient et aidera à guider le PCP qui compte sur votre expertise pour les conditions ophtalmiques.
– L’antigène leucocytaire humain B27 (HLA-B27) se trouve à la surface des globules blancs et est associé à un certain nombre de troubles auto-immuns, tels que la spondylarthrite ankylosante et le syndrome de Reiter. Il n’est cependant pas nécessairement un marqueur spécifique d’une maladie donnée et peut en fait être le facteur déterminant singulier dans certains cas d’iritis.4
– Tests de dérivation de la protéine purifiée (PPD) pour la tuberculose latente.
– Le titre de Lyme et le test immuno-enzymatique (ELISA), ainsi que les immunoglobulines M et G (IgM/IgG) anti-Borrelia burgdorferi, sont utilisés pour détecter la présence de la maladie de Lyme. L’ELISA peut également être utilisé pour détecter le VIH, tout comme le test Western Blot.2,7
D’autres tests peu courants pour l’uvéite qui peuvent être pertinents dans certaines présentations de patients comprennent un profil d’anticorps de Sjögren (SS-A, SS-B), une analyse d’urine et une recherche d’entités virales telles que les anticorps IgG/IgM du cytomégalovirus (CMV). Rappelons en immunologie que les IgG représentent une exposition passée ou une immunité à une maladie, et les IgM une exposition récente ou une infection active probable.
Gestion de l’uvéite non traumatique
Les premiers épisodes d’iritis unilatérale légère sont souvent idiopathiques et associés à une infection virale ou sinusale, ou à un événement traumatique. Les tests diagnostiques supplémentaires peuvent généralement être évités, car l’observation et le traitement des symptômes sont généralement suffisants dans ces cas à faible risque.2 Selon la gravité de l’inflammation dans un cas d’iritis traumatique, les médicaments anti-inflammatoires peuvent parfois être suspendus. Cependant, un jugement clinique sain doit être exercé pour déterminer si et quand l’utilisation de médicaments est nécessaire.
Pour toute entreprise thérapeutique, un objectif de traitement spécifique est essentiel. De toute évidence, l’augmentation du confort du patient est primordiale dans le traitement de l’uvéite. L’objectif fondamental dans la gestion de l’uvéite s’articule autour de la réduction de l’inflammation, diminuant ainsi la morbidité et la probabilité d’autres complications plus graves, telles que la perte de vision et le glaucome.
À la lumière de ces buts, quatre objectifs principaux doivent être considérés lors du traitement d’un patient atteint d’iritis :
– Diminuer la douleur.
– Prévenir les synéchies postérieures et donc le blocage pupillaire.
– Prévenir les synéchies antérieures périphériques (SAP) et donc la fermeture de l’angle.
– Rétablir la barrière hémato-aqueuse.
L’atropine et d’autres cycloplégiques/mydriatiques similaires jouent un rôle intégral dans ces quatre objectifs.4 Les agents cycloplégiques agissent sur le système vasculaire pour aider à stabiliser la barrière hémato-aqueuse, empêchant toute fuite supplémentaire. En immobilisant l’iris, ainsi que par leur action sur la parésie du muscle ciliaire, les cycloplégiques contribuent non seulement au contrôle de la douleur, mais leur effet dilatateur est également important pour contrecarrer la fermeture de l’angle et le blocage pupillaire en évitant l’adhérence de l’iris au cristallin. Les corticostéroïdes (généralement topiques dans la plupart des cas d’uvéite antérieure) réduisent la réponse inflammatoire de l’organisme et constituent un pilier du traitement de l’iritis. Ils contribuent également à réduire la perméabilité capillaire et la vasodilatation.4,7,13
Les autres options thérapeutiques comprennent les anti-inflammatoires non stéroïdiens (AINS), les agents immunosuppresseurs/immunomodulateurs et les options chirurgicales (par exemple, iridotomie périphérique au laser ou implant périoculaire).2,3,9,12 L’utilisation de corticostéroïdes dans l’uvéite doit normalement être réduite progressivement afin de prévenir une inflammation de rebond.
L’administration précoce et fréquente de corticoïdes est classiquement prescrite pour garantir une dose de charge adaptée afin d’étouffer agressivement l’inflammation. Une diminution progressive appropriée, en fonction de la réponse clinique, assure la bonne rémission de l’uvéite sans rebond de l’inflammation.3 Cependant, si un stéroïde est prescrit dans l’uvéite traumatique, c’est généralement sur une courte période, éliminant la nécessité d’une diminution progressive de la médication – d’autant plus que le stimulus inflammatoire (traumatisme) a disparu.
L’augmentation de la PIO et la cataracte sous-capsulaire postérieure (CSP) sont deux préoccupations principales associées à l’utilisation des corticostéroïdes ; cependant, ces complications ne sont pas couramment observées après une utilisation à court terme. De même, l’augmentation de la PIO en cas d’utilisation concomitante de corticostéroïdes ne signifie pas toujours que le stéroïde est à l’origine de cette élévation. Dans l’uvéite, la PIO est généralement inférieure à la normale – bien que dans certains cas, elle puisse être supérieure à la normale, selon le moment où le patient se présente pour recevoir des soins.1,4,11 Les deux raisons possibles de la diminution de la PIO sont les suivantes :1,4
– Une augmentation de la libération de prostaglandines endogènes augmente le débit uvéoscléral.
– Une diminution de la production d’humeur aqueuse par le corps ciliaire enflammé.1,4
Les explications potentielles de l’augmentation de la PIO comprennent :
– L’obstruction du maillage trabéculaire par des cellules et des protéines inflammatoires.
– La trabéculite, ou fibres du maillage enflammées et gonflées.
– Les synéchies postérieures.
– Les synéchies antérieures périphériques.
– L’élévation de la PIO induite par les stéroïdes.
– Le fait que l’œil « malade » revienne à la normale.
Une élévation de la PIO peut survenir pendant la période de traitement par corticoïdes, mais elle n’est pas toujours secondaire aux effets secondaires du corticoïde lui-même. Ainsi, le terme « répondeur aux stéroïdes » est parfois attribué à tort à la normalisation de la production aqueuse de l’œil en voie de guérison avant que le réseau trabéculaire n’ait totalement phagocyté les globules blancs et les restes de protéines fibrineuses de l’angle de drainage4. L’arrêt prématuré du traitement stéroïdien avant la résolution inflammatoire complète peut, en fait, faire plus de mal que de bien ; il faut plutôt maintenir le traitement stéroïdien et ajouter un médicament abaissant la PIO (c’est-à-dire un suppresseur aqueux), comme un bêta-bloquant ou un inhibiteur de l’anhydrase carbonique.
Il est important de noter que les analogues de prostaglandine et les myotiques doivent être évités dans l’uvéite, car ils peuvent augmenter l’inflammation.8,10-12 Les myotiques augmentent également le risque de formation de synéchies postérieures.1 Les agonistes adrénergiques, tels que la brimonidine et l’apraclonidine, sont généralement sûrs à utiliser chez les patients atteints d’uvéite avec une augmentation de la PIO.
Lorsque l’on traite une uvéite antérieure, le schéma posologique exact relève plus de l’art que de la science, car chaque cas peut se présenter différemment et des stratégies légèrement nuancées peuvent produire des résultats positifs similaires. Un protocole de traitement typique comprend l’administration d’une goutte d’acétate de prednisolone 1,0 % toutes les heures pendant deux à trois jours, ou jusqu’à l’apparition de cellules légères (< grade 2). Ensuite, une diminution progressive planifiée du stéroïde peut être accomplie en réduisant continuellement la fréquence d’administration de moitié tous les trois jours.
Pour des présentations plus légères, le gel d’étabonate de lotéprednol 0,5% administré à une fréquence moindre pourrait être le meilleur. Cependant, pour les cas plus sévères ou récalcitrants, l’émulsion ophtalmique de difluprednate 0,05% QID ou Q2H peut être appropriée. Certains patients peuvent même avoir besoin de corticostéroïdes oraux ; un choix courant est la prednisone, qui est généralement dosée entre 20 mg et 40 mg à une fréquence de BID à QID pendant plusieurs jours. Lorsque vous prescrivez des corticostéroïdes oraux, prenez note de toute maladie systémique, ainsi que des autres médicaments que le patient utilise, en cas d’effets secondaires ou d’interactions entre les différents médicaments.
À ce titre, vous pouvez consulter le PCP du patient avant de lui prescrire des corticostéroïdes oraux. Il faut également envisager de prescrire un antihistaminique qui agit pour inhiber la production d’acide gastrique, comme la ranitidine (Zantac, GlaxoSmithKline), afin de prévenir les troubles gastro-intestinaux. À tout le moins, assurez-vous que le patient prend le corticostéroïde oral avec un peu de nourriture ou de lait.
Comme mentionné précédemment, les cycloplégiques, tels que l’homatropine 5,0% ou l’atropine 1,0%, sont nécessaires pour une bonne gestion de l’uvéite. Une approche commune peut inclure une goutte d’homatropine 5% TID pendant trois jours, BID pendant deux jours et QD pendant un jour ; cependant, une période prolongée sur plusieurs semaines peut devoir être employée pour les cas plus graves. N’oubliez pas qu’en raison de l’inflammation de l’œil, une stratégie de dosage supérieure à la demi-vie du médicament sera nécessaire. En effet, le médicament est métabolisé à un rythme beaucoup plus rapide dans un œil malade. En fonction de la gravité, le patient doit revenir pour une visite de suivi après deux à cinq jours initialement, puis selon les besoins.
Gestion de l’uvéite traumatique
La fréquence de l’uvéite aux États-Unis correspond aux chiffres internationaux, soit environ 15 cas pour 100 000 personnes6,7. Le traumatisme est la troisième cause la plus fréquente d’uvéite antérieure.6,7 La morbidité résulte généralement des symptômes, des synéchies postérieures, de l’œdème maculaire cystoïde, de l’augmentation de la PIO avec le glaucome qui en résulte, la formation de cataracte et la rétinopathie.4,6,9 Les autres complications associées à l’iritis traumatique comprennent l’hyphéma, l’iridodialyse, l’iridoschisis, la dislocation et/ou l’opacification du cristallin, la commotion rétinienne, la neuropathie optique, le décollement postérieur du vitré, les déchirures et les décollements de la rétine, la rupture de la choroïde, l’œdème cornéen et la récession de l’angle.5,9-11
L’hyphéma, s’il est présent, est un état grave qui nécessite une surveillance étroite. Les patients sont généralement confinés au lit avec une activité limitée, où leur tête doit être élevée d’au moins 30° et un écran placé sur l’œil pour une protection renforcée. Les patients doivent éviter l’aspirine, mais peuvent prendre de l’acétaminophène pour la douleur, si nécessaire.
L’atropine 1,0 % doit être administrée par injection QD à TID et l’acétate de prednisolone 1,0 % dosé Q2H à QID. L’acide aminocaproïque oral, un antifibrinolytique, doit également être administré, selon la taille de l’hyphéma.10-12
Les études de laboratoire doivent également être envisagées pour les cas d’hyphéma. Les analyses typiques commandées comprennent la numération sanguine complète (CBC) avec différentiel, le temps de prothrombine (PT), le temps de thromboplastine partielle (PTT), l’azote uréique du sang (BUN), la créatinine, les électrolytes, les études sur la drépanocytose et l’hémoglobine. Des médicaments contre la PIO (c.-à-d. des bêta-bloquants) doivent également être institués si la PIO est élevée de façon significative. Les prostaglandines et les myotiques doivent être évités, car ils peuvent ajouter à l’effet inflammatoire.8,10-12
On constate une récession de l’angle s’il y a une insertion inégale de l’iris vers l’arrière, ce qui permet de voir une bande de corps ciliaire plus grande que la normale.8 Cela peut être confirmé si les résultats gonioscopiques de l’œil controlatéral sont normaux. La récession de l’angle ne se produit pas toujours lors d’un traumatisme contondant et, si elle est présente, elle ne produit pas toujours une PIO élevée au début. Cependant, des dommages microscopiques aux cellules endothéliales du réseau trabéculaire sont possibles, avec pour conséquence une augmentation de la PIO des années après le traumatisme initial.8,10 Des examens oculaires réguliers sont nécessaires pour surveiller ces patients en vue de complications futures.
L’uvéite peut se présenter en même temps que d’autres morbidités. Par conséquent, il est prudent d’être minutieux lors de l’examen d’un patient présentant une inflammation du segment antérieur. Une anamnèse méthodique permet souvent d’identifier la cause de l’inflammation. En outre, il est impératif de savoir ce qu’il faut rechercher pendant l’évaluation à la lampe à fente, de sorte qu’une prise en charge appropriée et des tests diagnostiques supplémentaires, si nécessaire, puissent être institués de manière accélérée.
L’iritis peut aller de légère à grave, avec une perte de vision et même une cécité survenant si elle n’est pas traitée. La plupart des cas d’iritis qui se présentent à l’ophtalmologiste primaire sont localisés antérieurement, de gravité légère à modérée et relativement simples à gérer. Le pronostic est généralement favorable avec un traitement et un suivi appropriés ; les piliers d’une bonne prise en charge restent les corticostéroïdes et les cycloplégiques. Les cas bilatéraux et récurrents peuvent nécessiter une recherche plus approfondie de l’étiologie. Dans l’ensemble, il est vital d’éduquer les patients sur les symptômes et l’importance des futurs examens oculaires périodiques pour surveiller les complications.
Le Dr Dohm est le chef du département d’optométrie et le directeur associé des services médicaux du Naval Hospital Oak Harbor sur la Naval Air Station Whidbey Island à Oak Harbor, Wash. Il n’a aucun intérêt financier direct dans les produits mentionnés.
1. Yanoff M, Duker JS (eds.). Ophtalmology, 2nd ed. St. Louis : Mosby ; 2004.
2. Medscape. Uveitis Classification. Disponible à l’adresse suivante : http://emedicine.medscape.com/article/1208936-overview. Consulté le 8 novembre 2012.
3. Smith RE, Nozik RM. Uveitis : Une approche clinique du diagnostic et de la prise en charge. Baltimore : Williams & Wilkins ; 1983.
4. Harkins TJ. Communication personnelle. Kansas City Veterans Administration Medical Center ; Kansas City, MO. Aug-Dec 2005.
5. Gold DH. Atlas clinique de l’œil. Chicago : AMA Press ; 2002.
6. Medscape. Iritis et Uveitis. Disponible à : http://emedicine.medscape.com/article/798323-overview. Consulté le 10 novembre 2012.
7. Medscape. Évaluation et traitement de l’uvéite. Disponible à : http://emedicine.medscape.com/article/1209123-overview. Consulté le 10 novembre 2012.
8. Kunimoto DY. The Wills Eye Manual : Office and Emergency Room Diagnosis and Treatment of Eye Disease, 4e éd. Philadelphie : Lippincott Williams & Wilkins ; 2004.
9. Kanski JJ. Ophtalmologie clinique : A Systematic Approach. 5th ed. Londres : Butterworth Heinemann ; 2003.
10. Shingleton BJ, Hersh PS, Kenyon KR (eds.). Eye Trauma. St. Louis : Mosby ; 1991.
11. Keil J, Chen S. Contusion injuries and their ocular effects. Clin Exp Optom 2001;84(1):19-25.
12. Kaiser PK, Friedman NJ, Pineda R. The Massachusetts Eye and Ear Infirmary Illustrated Manual of Ophthalmology, 2e éd. Philadelphie : Saunders ; 2004.
13. Pavan-Langston D. Manual of Ocular Diagnosis and Therapy, 4e éd. Boston : Little, Brown and Company ; 1996.
.