L’eau du robinet contient des gaz atmosphériques, comme l’azote et l’oxygène, qui y sont dissous. Lorsque le verre rempli d’eau reste à l’extérieur pendant quelques heures, sa température augmente légèrement (l’eau se réchauffe), ce qui fait que les gaz dissous qu’il contient sortent de l’eau et forment des bulles le long de l’intérieur du verre.
Remplir un verre d’eau (à température ambiante ou inférieure) et le laisser sans le déranger pendant quelques heures (vous pouvez le faire avec de l’eau du robinet). Vous finirez par remarquer que de très petites bulles commencent à apparaître le long du côté du verre (à l’intérieur). Pourquoi cela se produit-il ?

- Solubilité des gaz dans l’eau
- Les gaz sont plus solubles dans l’eau à des températures plus froides
- Danger pour la vie aquatique en raison du changement de température de l’eau
- La solubilité des gaz dans l’eau augmente avec l’augmentation de la pression
- La loi de Henry
- Pourquoi des bulles se forment dans un verre rempli d’eau pendant la nuit
Solubilité des gaz dans l’eau
L’eau qui sort des robinets et des vannes voyage dans des tuyaux avant d’atteindre de grands réservoirs de stockage. C’est pourquoi l’eau est à une pression plus élevée que la normale (pendant qu’elle est dans les tuyaux), et elle est aussi plus froide. Ces deux conditions sont idéales pour qu’elle dissolve certains gaz que l’on trouve en abondance dans notre atmosphère, notamment l’azote et l’oxygène.
Les gaz sont plus solubles dans l’eau à des températures plus froides
Les gaz, en général, sont plus solubles dans l’eau lorsque celle-ci est à une température plus basse. En d’autres termes, vous pouvez dire que la solubilité des gaz dans l’eau diminue lorsque la température de l’eau augmente. Le graphique ci-dessous devrait aider à visualiser comment la solubilité des gaz varie en fonction de la température.
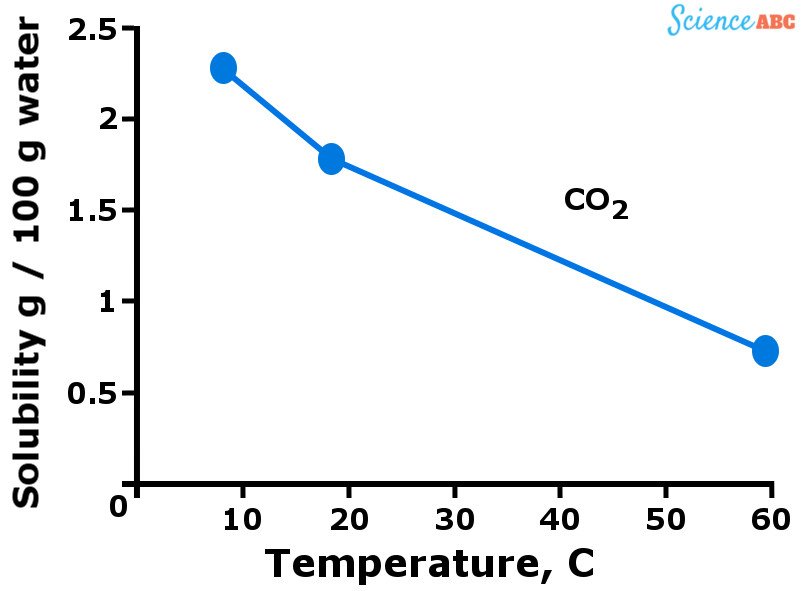
Variation de la solubilité du dioxyde de carbone dans l’eau avec l’augmentation de la température
La tendance à la baisse de la solubilité des gaz avec l’augmentation de la température est assez similaire à la façon dont la pression de vapeur augmente avec la température. Vous voyez, plus de molécules de gaz sont dissoutes dans l’eau lorsqu’elle est froide. Cependant, lorsque l’eau commence à se réchauffer (c’est-à-dire que la température augmente), l’énergie cinétique des molécules de gaz augmente également.
Ceci permet à ces molécules de se déplacer plus librement et de rompre les liaisons intermoléculaires qui les maintiennent ensemble, s’échappant ainsi de la solution. C’est pourquoi la solubilité des gaz diminue lorsque la température augmente.
Danger pour la vie aquatique en raison du changement de température de l’eau
La dépendance à la température de la solubilité des gaz dans l’eau a une implication directe sur la vie des créatures aquatiques. Vous voyez, les créatures aquatiques comme les poissons ont besoin d’oxygène pour survivre, et ils l’obtiennent de l’eau dans laquelle ils vivent en absorbant l’oxygène dissous (dans l’eau) par leurs branchies. Étant donné que l’oxygène est plus soluble dans les eaux froides, il est crucial que la température ne dépasse pas une certaine limite.

Les déchets rejetés par les centrales électriques augmentent la température de l’eau, mettant ainsi en danger la vie marine (Crédit photo : Flickr)
Cependant, c’est exactement ce qui se passe de nos jours, en grande partie à cause des activités humaines. Les centrales électriques, par exemple, rejettent d’énormes volumes d’eau chaude dans de grandes étendues d’eau, ce qui augmente ensuite la température de l’eau et a un impact drastique sur la vie aquatique. C’est l’un des résultats très indésirables d’une telle dépendance de la solubilité des gaz à la température.
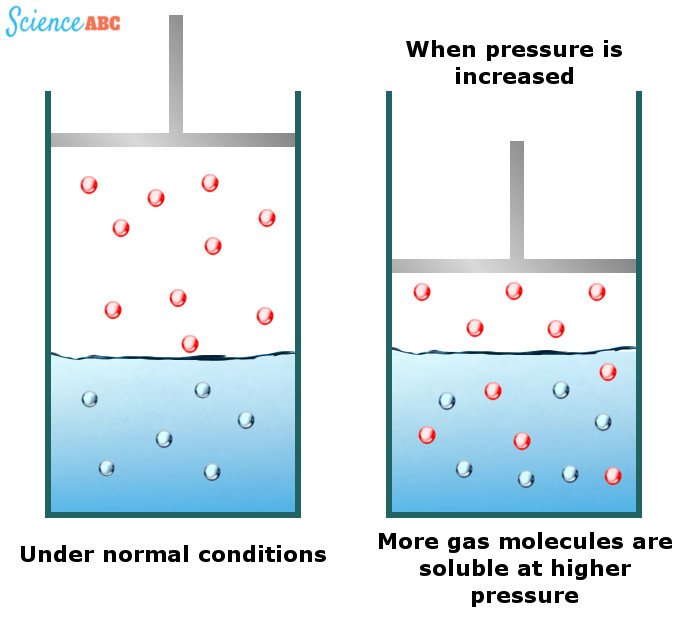
La solubilité des gaz dans l’eau augmente avec l’augmentation de la pression
Bien que les liquides et les solides ne présentent pratiquement aucun changement de solubilité avec un changement de pression de l’eau, les gaz, eux, en présentent. On a observé que les gaz sont plus solubles dans l’eau à des pressions plus élevées. Les boissons gazeuses sont d’excellents exemples de ce phénomène.
La loi de Henry
Les effets du changement de la pression de l’eau sur la solubilité des gaz peuvent être expliqués par l’une des lois des gaz connue sous le nom de loi de Henry. Elle stipule que « la quantité de gaz dissous est proportionnelle à sa pression partielle dans la phase gazeuse »
La façon la plus simple d’expliquer cette dépendance est que lorsque la pression augmente, les molécules de gaz sont forcées à entrer dans la solution afin que la pression appliquée puisse être soulagée. L’image suivante devrait aider à mieux visualiser ceci:
Pourquoi des bulles se forment dans un verre rempli d’eau pendant la nuit
En raison des deux phénomènes physiques que nous avons discutés ci-dessus, l’eau du robinet devient un bon candidat (si ce n’est idéal) pour contenir les gaz atmosphériques dissous. Cependant, lorsque cette eau est versée dans un verre et laissée pendant quelques heures à température ambiante, sa pression commence à diminuer, tandis que sa température commence à augmenter.

De minuscules bulles se forment dans un verre d’eau pendant la nuit (Crédit photo : )
Ce faisant, les gaz dissous dans l’eau sortent de la solution et forment des bulles sur les aspérités de l’intérieur du verre. Comme le changement de température n’est pas si rapide (c’est-à-dire que l’eau ne passe pas du froid au brûlant en quelques minutes), il faut quelques heures avant que les bulles ne commencent à apparaître sur le verre.