Contexte
Principe:
Le salicylate de méthyle (huile de gaulthérie) est un ester organique. Quand un acide (contenant le groupe -COOH) réagit avec un alcool (un composé contenant un groupe -OH) formé un ester. Ce type de réaction peut être appelé réaction de condensation car la petite molécule de H2O est éliminée des réactifs tandis que les morceaux restants des réactifs se condensent ensemble pour donner le produit principal. Cette réaction est également appelée estérification, car le produit de la réaction est un ester, un composé contenant le groupe COOR1.
But:
Préparer le salicylate de méthyle à partir de l’acide salicylique.
Réaction:
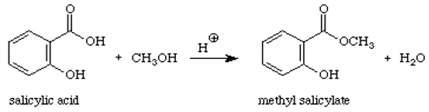
Mécanisme:
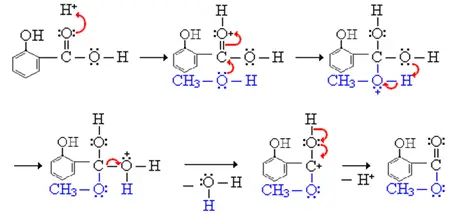
Utilisation:
Il est utilisé pour traiter les douleurs musculaires et articulaires.
REQUIS
Produits chimiques : Acide salicylique
Méthanol sec
Acide sulfurique concentré
Tétrachlorure de carbone
Sulfate de magnésium etc.
Appareil : Ballon à fond rond – 500 ml,
Condenseur à reflux
Thermomètre
Enfourneau séparateur
Bécher
Enfourneau Buchner
. entonnoir
Eprouvette à mesurer
Papier filtre
PROCÉDURE
Prendre un mélange de 28 g (0. 2 mol) d’acide salicylique.2 mol) d’acide salicylique, 64 g (81 ml, 2 mol) de méthanol sec et 8 ml d’acide sulfurique concentré dans un ballon à fond rond de 500 ml. Mettez quelques petits éclats de porcelaine poreuse, placez un réfrigérant à reflux sur le ballon et faites bouillir doucement le mélange pendant 5 h. Eliminez l’excès d’alcool par distillation au bain-marie et laissez refroidir. Verser le résidu dans environ 250 ml d’eau contenus dans une ampoule à décanter et rincer le ballon avec quelques ml d’eau qui sont également versés dans l’ampoule à décanter. Si, en raison de la différence relativement faible entre la densité de l’ester et celle de l’eau, il est difficile d’obtenir une séparation nette de la couche inférieure d’ester et de l’eau, ajouter 10 à 15 ml de tétrachlorure de carbone (2) et agiter vigoureusement le mélange réactionnel dans cette ampoule ; au repos, la solution lourde de salicylate de méthyle dans le tétrachlorure de carbone se sépare nettement et rapidement au fond de l’ampoule à décanter. Eliminer prudemment la couche inférieure, jeter la couche aqueuse supérieure, remettre le salicylate de méthyle dans l’ampoule et l’agiter avec une solution forte d’hydrogénocarbonate de sodium jusqu’à ce que tout l’acide libre soit éliminé et qu’il n’y ait plus de dégagement de dioxyde de carbone. Laver une fois avec de l’eau et sécher en versant dans une petite fiole conique sèche contenant environ 5 g de sulfate de magnésium. Boucher la fiole, agiter pendant environ 5 minutes et laisser reposer pendant au moins une demi-heure en agitant de temps en temps. Filtrer la solution de salicylate de méthyle à travers un petit papier filtre cannelé, directement dans un ballon à fond rond équipé d’une tête de distillation portant un thermomètre à 360 °C et un condenseur à air. Mettre des copeaux bouillants et distiller à partir d’un bain d’air ; augmenter la température lentement au début jusqu’à ce que tout le tétrachlorure de carbone soit passé, puis chauffer plus fortement. Récupérer le salicylate de méthyle (une huile incolore au parfum délicieux, « huile de gaulthérie ») à 221-224 °C ; le rendement est de 25 g (81%). L’ester peut également être distillé sous pression réduite ; le p.b. est de 115 °C/20 mmHg et une fraction de 2 °C doit être recueillie.
Calcul :
Ici le réactif limitant est l’acide salicylique ; le rendement doit donc être calculé à partir de sa quantité prélevée.
Formule moléculaire de l’acide salicylique = C7H6O3
Formule moléculaire du salicylate de méthyle = C8H8O3
Poids moléculaire de l’acide salicylique = 138 g/mole
Poids moléculaire du salicylate de méthyle = 152 g/mole
Rendement théorique :
138 g d’acide salicylique forment 152 g de salicylate de méthyle
Donc, 28 g d’acide salicylique formeront ……..? (X) g de salicylate de méthyle
X =( 152 ×28)/138 = 30,84 g
Rendement théorique = 30.84 g
Rendement pratique = —– g
Rendement en pourcentage = (Rendement pratique)/(Rendement théorique) × 100
CONCLUSION
Le salicylate de méthyle a été synthétisé et le rendement en pourcentage s’est révélé être………..%
.