US Pharm. 2008;33(3)(OTC suppl):4-7.
L’asthme est une maladie pulmonaire caractérisée par une obstruction réversible du flux d’air et une hyperréactivité bronchique. La caractéristique centrale de l’asthme est l’inflammation, qui entraîne des épisodes récurrents de respiration sifflante, de toux, d’essoufflement et d’oppression thoracique.1,2 L’objectif du traitement est de maîtriser la maladie afin de maintenir une qualité de vie normale.
Le fardeau de l’asthme n’a cessé d’augmenter au cours des trois dernières décennies. En 1970, environ 3 % de la population était asthmatique, contre 5,5 % et 7,7 % en 1995 et 2005, respectivement.3 Cette dernière estimation équivaut à environ 22,2 millions d’Américains.2,3 Avec l’augmentation de la prévalence de cette maladie aux États-Unis, la morbidité et la mortalité dues à l’asthme augmentent également. En 2004, 1,8 million de visites aux services d’urgence, 497 000 hospitalisations et 4 055 décès ont été attribués à l’asthme3.
Traitement basé sur le contrôle de l’asthme
Le National Asthma Education and Prevention Program (NAEPP), une division du National Heart, Lung, and Blood Institute, publie des lignes directrices pour le diagnostic et la prise en charge de l’asthme, dont la dernière mise à jour date de 2007.2 Les lignes directrices classent la gravité de l’asthme comme intermittente ou persistante en fonction des symptômes et de la fréquence d’utilisation des médicaments à action rapide. Les personnes souffrant d’asthme intermittent présentent des symptômes peu fréquents, n’utilisent donc que rarement des médicaments à action rapide et n’interfèrent pas avec leurs activités normales. Si l’asthme est moins contrôlé, alors la gravité de l’asthme est classée comme persistante (voir TABLEAU 1).
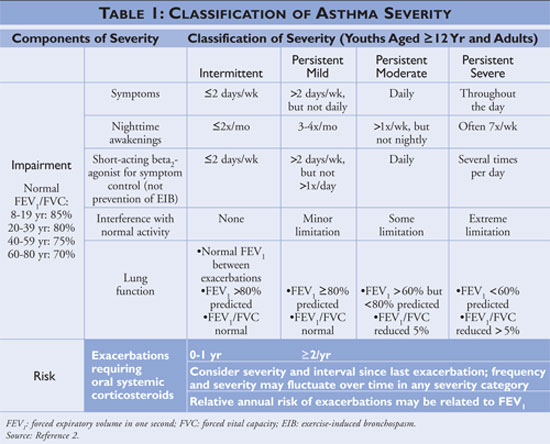
Les lignes directrices décrivent les pierres angulaires de la prise en charge de l’asthme comme l’éducation à l’autogestion, l’utilisation de médicaments à soulagement rapide et l’utilisation de médicaments de contrôle à long terme chez les personnes souffrant d’asthme persistant. Les prestataires de soins de santé qui offrent une éducation à l’autogestion doivent apprendre aux patients à identifier et à éviter les déclencheurs de l’asthme lorsque cela est possible, à utiliser correctement les traitements pharmacologiques et à élaborer un plan d’action contre l’asthme. Les médicaments à action rapide doivent être initiés chez tous les patients diagnostiqués comme asthmatiques et peuvent être utilisés en monothérapie chez les personnes souffrant d’asthme intermittent ; les personnes diagnostiquées comme asthmatiques persistants doivent cependant se voir ajouter un ou plusieurs médicaments de contrôle à long terme à leur régime. Les médicaments de contrôle à long terme comprennent les corticostéroïdes inhalés, les modificateurs de leucotriène, les bêta-agonistes à action prolongée et la théophylline (voir TABLEAU 2).

Les lignes directrices notent également qu’environ 30% de la population américaine utilise des médicaments et des interventions complémentaires et alternatifs. Cependant, à l’heure actuelle, les preuves sont insuffisantes pour recommander ces modalités de traitement de l’asthme. Les lignes directrices déconseillent l’utilisation de remèdes à base de plantes pour traiter l’asthme en raison du manque de données sur la sécurité et l’efficacité.
Les produits d’asthme en vente libre et leur réglementation
Les produits d’asthme en vente libre sont disponibles depuis les années 1950, bien que certains des ingrédients actifs aient considérablement changé au fil des ans. Les principes actifs en vente libre actuellement disponibles sont l’éphédrine – avec ou sans guaifénésine – et l’épinéphrine. La théophylline et le phénobarbital étaient auparavant des ingrédients actifs des produits en vente libre pour l’asthme ; cependant, ces deux produits sont maintenant classés comme des produits vendus sur ordonnance seulement.4
Au cours des trois dernières décennies, la FDA a pris des mesures concernant la réglementation des traitements en vente libre pour l’asthme. En 1976, la FDA a conclu que l’épinéphrine inhalée procurait un soulagement rapide et efficace de l’asthme léger à modéré. En 1982, elle a de nouveau conclu dans une monographie finale provisoire : « L’épinéphrine, le bitartrate d’épinéphrine et le chlorhydrate d’épinéphrine (racémique ; rebaptisé depuis chlorhydrate de racinephrine) sous forme d’aérosol doseur pressurisé pour inhalation peuvent être généralement reconnus comme sûrs et efficaces pour une utilisation en vente libre à des doses pour les adultes et les enfants de 4 ans et plus de 1 à 2 inhalations d’un doseur équivalent à 0.En 1986, la FDA a examiné les produits à base d’éphédrine pour la bronchodilatation et a approuvé cet ingrédient actif comme étant généralement reconnu comme sûr et efficace pour une utilisation en vente libre. Cette année-là, la FDA a décidé que les données étaient insuffisantes pour limiter l’utilisation de l’éphédrine en inhalation à un usage sur ordonnance seulement et que les avantages de la disponibilité en vente libre l’emportaient sur les risques. La FDA a conclu qu’un étiquetage élargi et révisé serait bénéfique pour les consommateurs.5,6
Après des rapports d’événements mettant en danger la vie et de décès attribuables à des produits combinés en vente libre contenant de la théophylline, la FDA a émis une décision finale en 1995 selon laquelle ces produits n’étaient ni sûrs ni efficaces.7 Ainsi, les produits contenant une combinaison d’éphédrine et de théophylline ont été abandonnés et certains ont été reformulés pour contenir de l’éphédrine et de la guaifénésine. Toujours en 1995, la FDA a proposé de retirer l’éphédrine du marché des médicaments en vente libre en raison de son rôle dans la fabrication de la méthamphétamine et de la méthcathinone et de son utilisation abusive pour le contrôle du poids et l’augmentation de la masse musculaire.7
En 1996, la FDA a modifié la monographie finale de 1986 afin de retirer le statut de monographie aux bronchodilatateurs en vente libre6. Au lieu de cela, les fabricants de tout nouvel aérosol-doseur en vente libre doivent soumettre une demande approuvée qui contient des informations ne figurant pas dans la monographie.6 Les bronchodilatateurs en vente libre actuellement commercialisés n’ont pas été affectés par cet amendement.
Malgré la proposition de la FDA de retirer l’éphédrine du marché en vente libre en raison de son utilisation comme élément de base dans la production de méthamphétamine, le produit reste disponible en vente libre. En effet, la loi de 2005 sur la lutte contre l’épidémie de méthamphétamine (Combat Methamphetamine Epidemic Act), intégrée au Patriot Act en 2006, a conféré un statut de produit en vente libre aux produits en vente libre contenant de l’éphédrine8. Les consommateurs qui souhaitent acheter des produits contenant de l’éphédrine doivent désormais présenter une pièce d’identité avec photo délivrée par le gouvernement dans une pharmacie, car ces produits ne sont plus vendus légalement dans les dépanneurs ou les magasins d’entrepôt sans pharmacie agréée.
Dans le cadre de la protection de la santé publique mondiale, un accord international a été formé pour réduire et, à terme, éliminer les produits contenant des substances appauvrissant la couche d’ozone (SACO), comme les chlorofluorocarbones (CFC) présents dans les inhalateurs-doseurs (ID). Cet accord a donné lieu au Protocole de Montréal de 1987 et, par la suite, aux amendements du Clean Air Act de 1990.9-11 L’accord prévoit une exemption pour l’utilisation des CFC dans les inhalateurs-doseurs utilisés pour le traitement de l’asthme si l’utilisation du produit est jugée essentielle par la FDA.12 Les médicaments en vente libre contre l’asthme sont restés sous la désignation d’utilisation essentielle. Cependant, en 2007, la FDA a annoncé une proposition visant à supprimer la désignation d’usage essentiel pour l’épinéphrine inhalée à compter du 31 décembre 2010.13 La FDA a utilisé les critères suivants, trouvés dans 21 CFR 2.125(g)(2), pour revoir la désignation d’usage essentiel pour l’épinéphrine inhalée : « (i) : Des obstacles techniques importants existent pour formuler le produit sans SAO ; (ii) : Le produit fournira un avantage important non disponible pour la santé publique ; et (iii) : L’utilisation du produit ne libère pas de quantités cumulatives importantes de SAO dans l’atmosphère ou la libération est justifiée compte tenu de l’avantage important non disponible pour la santé publique. « 13 La FDA reçoit actuellement des commentaires sur cette question avant leur décision finale.
Sécurité et efficacité des produits en vente libre
Comme en témoignent les diverses propositions faites et les mesures prises par la FDA concernant le statut de produits en vente libre pour l’asthme, les dernières décennies ont été marquées par de nombreux débats sur la sécurité et l’efficacité des ingrédients actifs de ces produits. Bien que ces produits ne fassent pas l’objet d’une promotion active, leur disponibilité signifie que leur sécurité et leur efficacité sont d’une importance capitale pour les consommateurs.
Éphédrine : Les produits à base d’éphédrine à ingrédient unique destinés à être utilisés comme bronchodilatateurs sont considérés comme généralement reconnus comme sûrs et efficaces par la FDA depuis 1986.14 L’éphédrine libère l’épinéphrine des tissus, ce qui déclenche l’activité des récepteurs alpha-adrénergiques et bêta-adrénergiques non sélectifs. L’efficacité de l’éphédrine pour la bronchodilatation a été démontrée dans des études datant des années 1950. Les propriétés qui rendent l’éphédrine moins souhaitable en tant que bronchodilatateur comprennent un début d’action plus lent que les produits inhalés (15 minutes à une heure) et la non-sélectivité de la stimulation bêta, qui pourrait contribuer aux effets indésirables cardiovasculaires (EI).15-17 Cependant, les études ont démontré des résultats contradictoires concernant les effets indésirables cardiovasculaires attribuables à l’utilisation de l’éphédrine aux doses étiquetées de 12,5 à 25 mg.16
Epinephrine : L’épinéphrine présente la même activité des récepteurs alpha et bêta-adrénergiques que l’éphédrine ; par conséquent, les mêmes préoccupations existent quant à la possibilité d’effets indésirables cardiovasculaires. Le début d’action de l’épinéphrine inhalée (15 secondes) est beaucoup plus rapide que celui de l’éphédrine orale, ce qui en fait un choix plus approprié pour le soulagement immédiat d’une exacerbation aiguë de l’asthme.6 Sa courte durée d’action (23 minutes), cependant, peut obliger le patient à utiliser le produit à plusieurs reprises pour obtenir un soulagement continu plutôt que de suivre les instructions de l’étiquette, à savoir pas plus de deux inhalations en trois heures.6 Les inhalateurs d’épinéphrine en vente libre semblent être sûrs et efficaces pour les patients souffrant d’asthme léger et intermittent lorsqu’ils sont utilisés conformément aux instructions de l’étiquette.5 Cela reste toutefois une source de controverse, car de nombreux prestataires de soins de santé craignent que les patients qui se fient aux inhalateurs en vente libre ne bénéficient pas d’une prise en charge appropriée de leur maladie par une équipe de soins de santé, ce qui pourrait entraîner de graves répercussions.
Guaifénésine : La guaifénésine est utilisée en association avec l’éphédrine pour le traitement de l’asthme et est reconnue comme sûre et efficace lorsque le produit est étiqueté pour la toux associée à l’asthme.14 Bien que la guaifénésine soit un mucolytique approuvé par la FDA, elle ne possède pas d’effets bronchodilatateurs. Ainsi, elle n’apporte aucun avantage supplémentaire au produit d’éphédrine pour une exacerbation aiguë.17
Utilisation des produits d’asthme en vente libre
Une enquête de Wyeth Consumer Healthcare (WCH) menée en 1999 a révélé qu’environ six millions (30 %) de personnes asthmatiques utilisent des inhalateurs d’épinéphrine.6 Les déclarations des répondants suggèrent qu’environ 20 % de ces six millions de personnes seraient classées comme ayant un asthme persistant léger à modéré, ce qui ne fait pas partie de l’utilisation indiquée sur l’étiquette de ce produit.5 Les lignes directrices de la NAEPP encouragent l’utilisation de bêta-agonistes à courte durée d’action, au moins selon les besoins, par toutes les personnes souffrant d’asthme ; les lignes directrices ne mentionnent toutefois pas spécifiquement l’épinéphrine inhalée comme choix de traitement.
En 2005, le WCH a mené une enquête sur Internet auprès de 330 personnes concernant l’utilisation de bronchodilatateurs en vente libre pour le traitement de leurs symptômes. Le WCH a déterminé que, parmi les utilisateurs de bronchodilatateurs en vente libre, 92 % avaient reçu un diagnostic d’asthme, 91 % utilisaient de l’épinéphrine inhalée uniquement en cas d’exacerbation aiguë de l’asthme, 31 % n’avaient pas d’assurance médicale et 38 % n’avaient pas d’assurance médicaments.6 Le WCH a extrapolé ces résultats pour estimer qu’environ 5 % à 10 % des personnes asthmatiques utilisent des bronchodilatateurs en vente libre en monothérapie.6 Les principales raisons invoquées pour justifier l’utilisation de produits en vente libre – facilité d’accès et coût moindre – sont en corrélation directe avec les préoccupations des prestataires de soins de santé qui craignent que les personnes utilisant des produits en vente libre pour l’asthme ne bénéficient pas d’une prise en charge appropriée de leur maladie.6
Discussion
Les propriétés souhaitables dans le traitement aigu de l’asthme comprennent l’efficacité en tant que bronchodilatateur, la sécurité lorsqu’il est pris tel qu’indiqué sur l’étiquette, un début d’action rapide et une longue durée d’action. L’épinéphrine en inhalation et l’éphédrine par voie orale ont toutes deux démontré leur efficacité dans des essais depuis des décennies. Cependant, étant donné les résultats mitigés des essais cliniques sur le plan cardiovasculaire, la sécurité de l’utilisation des bronchodilatateurs en vente libre par des personnes qui ne sont pas nécessairement suivies médicalement est une préoccupation majeure des prestataires de soins de santé. L’épinéphrine inhalée a un début d’action plus rapide que l’éphédrine orale, mais sa courte durée d’action peut limiter son efficacité.
La disponibilité de l’éphédrine orale est limitée depuis 2006 par son statut de produit en vente libre. La disponibilité de l’éphédrine en inhalation dépend de la décision de la FDA quant au maintien de la désignation d’usage essentiel de cette formulation. Il n’existe pas d’alternatives en vente libre pour les bronchodilatateurs en vente libre contenant des CFC actuellement commercialisés.12 Un fabricant a essayé de reformuler son produit d’épinéphrine en inhalation en vente libre avec un propulseur d’hydrofluoroalcane, avec des effets indésirables pour l’utilisateur ; il s’est associé à une autre société pharmaceutique pour la reformulation en prévision d’un dépôt auprès de la FDA d’ici 2011.6 Les principales préoccupations concernant les propulseurs alternatifs comprennent la nécessité d’une administration efficace de l’épinéphrine et des données sur la sécurité et l’efficacité du nouveau produit à la suite des changements.18
En déterminant s’il faut retirer la désignation d’usage essentiel pour l’adrénaline inhalée, la FDA n’examine pas la sécurité ou l’efficacité des produits contenant des CFC actuellement commercialisés ; elle examine plutôt l’impact sur la santé publique si la désignation est retirée. Dans des lettres adressées à la FDA par la National Association of Chain Drug Stores et l’American Pharmacists Association sur la proposition de suppression de la désignation d’usage essentiel, la principale préoccupation était l’impact négatif potentiel sur les utilisateurs actuels d’inhalateurs en vente libre si les produits devenaient indisponibles.19,20 La FDA a déclaré que si la règle proposée pour supprimer la désignation d’usage essentiel devient définitive et que les alternatives en vente libre n’existent pas, les consommateurs devront obtenir une ordonnance pour un produit alternatif.12 De nombreux consommateurs qui utilisent de l’épinéphrine inhalée peuvent choisir de renoncer au traitement de l’asthme ou de chercher un autre traitement en vente libre.
Il est impératif que la communauté médicale sensibilise le public à la gravité des conséquences d’un asthme non contrôlé et que toute personne qui éprouve des difficultés à respirer consulte un fournisseur de soins de santé pour un diagnostic et un traitement. Il faut conseiller à un patient qui choisit d’utiliser des bronchodilatateurs en vente libre d’en informer son fournisseur de soins de santé ; le patient doit également être informé de la différence entre les instructions figurant sur l’étiquette des inhalateurs en vente libre et celles des inhalateurs sur ordonnance. L’accessibilité continue actuelle des bronchodilatateurs en vente libre nécessite de conseiller les patients en connaissance de cause afin de prévenir une utilisation inappropriée de ces produits et les effets indésirables qui en découlent.
1. Moorman JE, Rudd RS, Johnson CA, et al. Surveillance nationale de l’asthme–États-Unis, 1980-2004. MMWR. 19 oct. 2007;56:1-14, 18-54.
2. Rapport du groupe d’experts 3 : Lignes directrices pour le diagnostic et la prise en charge de l’asthme. Programme national d’éducation et de prévention de l’asthme. Bethesda, MD : National Heart, Lung, and Blood Institute, National Institutes of Health ; 2007.
3. Akinbami L. Prévalence de l’asthme, utilisation des soins de santé et mortalité : États-Unis, 2003-05. Centre national des statistiques sanitaires. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Consulté le 10 décembre 2007.
4. W. Steven Pray. Produits en vente libre et traitement de l’asthme. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Sécurité des inhalateurs en vente libre pour l’asthme : rapport du Conseil des affaires scientifiques. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Utilisation d’une substance appauvrissant la couche d’ozone : détermination de l’utilisation essentielle des aérosols-doseurs d’épinéphrine en vente libre. Document d’information. 19 décembre 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Consulté le 30 décembre 2007.
7. Kupec IF. Les bronchodilatateurs contenant de la théophylline et les médicaments à base d’éphédrine. Réponses T95-40. 27 juillet 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Consulté le 10 décembre 2007.
8. Drug Enforcement Administration. Informations générales concernant la loi de 2005 sur la lutte contre l’épidémie de méthamphétamine . Mai 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Consulté le 4 février 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes : risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of « essential use exemptions » for metered-dose inhalers under the Montreal Protocol. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Food and Drug Administration. Nouvelles de la FDA. La FDA propose l’élimination progressive des CFC dans les inhalateurs doseurs d’épinéphrine. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Consulté le 10 décembre 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Consulté le 6 février 2008.
14. Whitehall-Robins. RE : docket no. 98N-0148 ; Fed. Reg. 13258, classement international des drogues ; Convention sur les substances psychotropes. 16 avril 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Consulté le 30 décembre 2007.
15. Lexi-Comp Online. www.crlonline.com. Consulté le 28 décembre 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Double-blind comparison of acute bronchial and cardiovascular effects of oral terbutaline and ephedrine. Chest. 1975;68:155-161.
17. Dulfano MJ. Les nouveaux bronchodilatateurs oraux . Chest.1975;68:133-134.
18. Produits pharmaceutiques contre le rhume, la toux, les allergies, les bronchodilatateurs et les antiasthmatiques à usage humain en vente libre ; modification de la monographie des produits pharmaceutiques bronchodilatateurs en vente libre. Fed Regist. 1996 ; 61:25142-25147.
19. Association nationale des chaînes de pharmacies. Objet : utilisation de gaz propulseurs appauvrissant la couche d’ozone ; suppression de la désignation d’usage essentiel pour les inhalateurs doseurs d’adrénaline (IDM) en vente libre. Le 6 janvier 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Consulté le 6 février 2008.
20. Déclaration de l’American Pharmacists Association (APhA) au comité consultatif sur les médicaments en vente libre et au comité consultatif sur les médicaments contre les allergies pulmonaires de la Food and Drug Administration. Utilisation d’une substance appauvrissant la couche d’ozone : détermination de l’usage essentiel des aérosols doseurs d’épinéphrine en vente libre. 24 janvier 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Consulté le 6 février 2008.
Pour commenter cet article, contactez [email protected].