- Des cavités axiales sans chromatine apparaissent dans les plantes dont le contenu moyen en ADN 2C a dépassé 0.8 pg par un chromosome
- La condensation/décondensation des chromosomes peut être visualisée dans des sections semi-minces de cellules de N. damascena après coloration au 4′,6-diamidino-2-phénylindole (DAPI)
- Condensation/décondensation des chromosomes pendant la mitose analysée après incorporation de 5-éthynyl-2′-deoxyuridine (EdU)
- Condensation/décondensation des chromosomes au cours de la mitose analysée par microscopie électronique
Des cavités axiales sans chromatine apparaissent dans les plantes dont le contenu moyen en ADN 2C a dépassé 0.8 pg par un chromosome
Les chromatides en anaphase et en télophase de certaines plantes contiennent des cavités sans chromatine dans les régions axiales, ce qui distingue ces plantes de la majorité des autres plantes et animaux étudiés à ce jour (Fig. 1a, b). À notre connaissance, les rapports décrivant une telle organisation chromosomique sont limités aux plantes à grand génome, et on peut supposer que cette organisation morphologique est une caractéristique spécifique de ces plantes. Pour vérifier cette suggestion, nous avons également analysé les chromatides en anaphase et en télophase de 12 espèces en utilisant la microscopie électronique (Tableau 1 ; Fig. 1a, b ; Fichier additionnel 1 : Figure S1). La figure 1c montre que des cavités axiales dépourvues de chromatine étaient clairement visibles uniquement à l’intérieur des chromosomes des plantes à grand génome et à grand chromosome, mais il semble que la taille moyenne des chromosomes soit mieux corrélée avec la présence ou l’absence de ces cavités. Parmi les plantes avec des cavités axiales, Hordeum vulgare avait le plus petit génome et le plus petit contenu moyen d’ADN 2C par chromosome (0,79 pg). Ainsi, cette organisation chromosomique est une caractéristique des chromosomes des plantes dont le contenu en ADN 2C peut être grossièrement estimé comme dépassant 0,8 pg par chromosome.
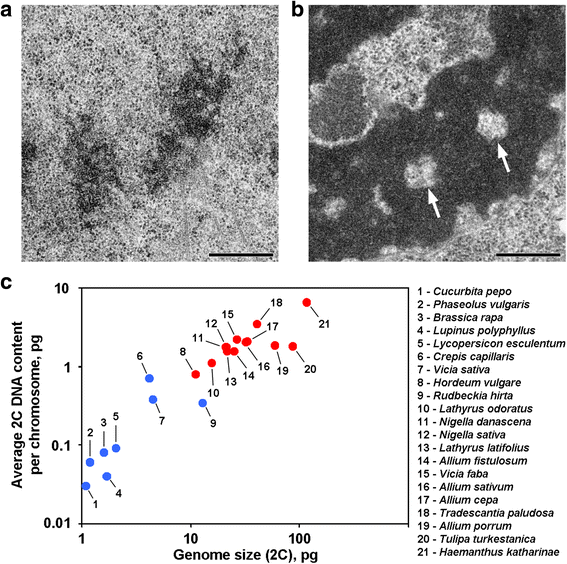
Deux variantes d’organisation chromosomique chez les plantes. a Chromosomes en télophase du haricot commun (Phaseolus vulgaris) comme exemple de chromosomes sans cavités axiales sans chromatine. b Chromosomes en télophase de N. damascena avec des cavités axiales sans chromatine clairement visibles (flèches). c La présence de cavités axiales sans chromatine dépend du génome et de la taille des chromosomes. Les points bleus représentent les plantes dans lesquelles les chromosomes ne contiennent pas de cavités axiales sans chromatine ; les points rouges représentent les plantes dans lesquelles les chromosomes contiennent des cavités axiales sans chromatine. Barre d’échelle : 0,5 μm
La condensation/décondensation des chromosomes peut être visualisée dans des sections semi-minces de cellules de N. damascena après coloration au 4′,6-diamidino-2-phénylindole (DAPI)
L’objet le plus pratique pour l’étude des chromosomes des plantes, le méristème apical des racines, ne permet pas l’acquisition d’images à haute résolution en raison de la fluorescence hors foyer. Ici, nous avons utilisé une méthode basée sur l’application de sections semi-fines (200-250 nm) de racines incluses dans le milieu LR White. L’épaisseur de ces sections était nettement inférieure à celle des sections optiques, même si un microscope confocal était utilisé. Pour trouver les caractéristiques morphologiques qui nous ont permis d’identifier les cellules à différents stades mitotiques, nous avons analysé la morphologie des cellules colorées au DAPI.
Il y avait plusieurs transformations de l’organisation chromosomique de N. damascena qui étaient facilement visibles même au microscope à fluorescence. À l’intérieur des noyaux en prophase précoce, des parties de chromosomes minces (environ 0,6 μm de diamètre) étaient visibles (figure 2a). En prophase moyenne, des chromosomes de prophase plus épais (environ 1,2 μm) se sont formés, à l’intérieur desquels il était possible de distinguer la présence de fibres plus fines, qui correspondaient probablement à des chromosomes de prophase précoce pliés (Fig. 2b). Les chromosomes en fin de prophase (Fig. 2c), en métaphase (Fig. 2d) et en anaphase (Fig. 2e) étaient densément condensés, et aucune organisation interne n’a été détectée. Lors de la décondensation en télophase, la séparation des fibres de chromatine d’un diamètre d’environ 0,4 μm a conduit à l’apparition de cavités sans chromatine dans les régions axiales des chromatides (Fig. 2f), dont la taille a progressivement augmenté au cours de la télophase (Fig. 2g et h). Le diamètre des fibres de chromatine dans les chromosomes en télophase était comparable à la taille des chromosomes en début de prophase. Ainsi, tous les stades mitotiques de N. damascena ont été facilement détectés dans les sections semi-minces colorées avec du DAPI.
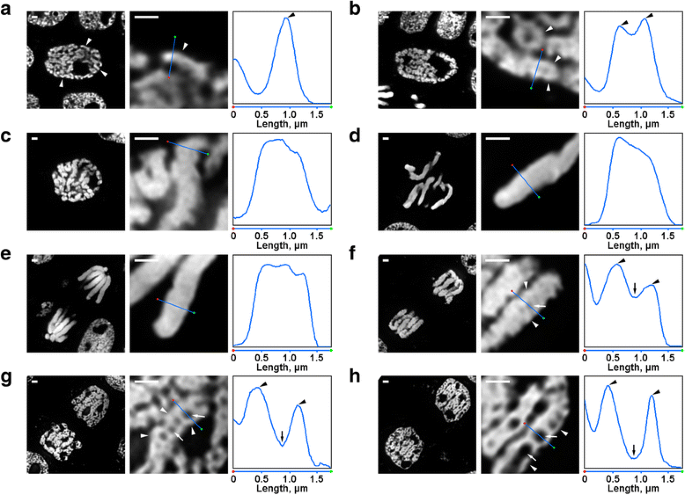
Morphologie des chromosomes mitotiques de N. damascena. Les panneaux gauche et central représentent des images de microscopie à fluorescence de sections semi-minces colorées au DAPI (vue générale et fragment) ; le panneau droit représente un tracé de densité passant par la ligne des panneaux centraux. a Prophase précoce (les chromosomes sont indiqués par des pointes de flèche). b Prophase moyenne (les fibres formant les chromosomes, qui semblent correspondre aux chromosomes de la prophase précoce, sont indiquées par des pointes de flèche). c Prophase tardive. d Métaphase. e Anaphase. f Télophase précoce (les cavités axiales sans chromatine sont indiquées par des flèches, les fibres formant les chromosomes de la télophase sont indiquées par des pointes de flèche). g Télophase tardive. h Phase G1. Barres d’échelle : 1 μm
Condensation/décondensation des chromosomes pendant la mitose analysée après incorporation de 5-éthynyl-2′-deoxyuridine (EdU)
Pendant la prophase, les chromosomes minces de la prophase précoce ont été transformés en chromosomes épais de la prophase tardive. L’épaississement des chromosomes de la prophase peut être le résultat soit d’un repliement des chromosomes de la prophase précoce, soit le résultat de son épaississement progressif. Pour étudier ces deux mécanismes possibles, il était nécessaire de marquer les foyers chromosomiques discrets qui étaient disposés linéairement à l’intérieur des chromosomes de la prophase précoce, puis d’analyser leurs réarrangements spatiaux pendant la condensation de la prophase. Comme le montre le diagramme de la figure 3a, pendant la transition entre la prophase précoce et la prophase tardive, ces foyers perdent leur disposition linéaire (pliage) ou la conservent et s’étirent en bandes fines (épaississement). Pour marquer les régions chromosomiques, nous avons incorporé le nucléotide synthétique, EdU, qui peut être détecté par la chimie du clic, dans la chromatine pendant la réplication.
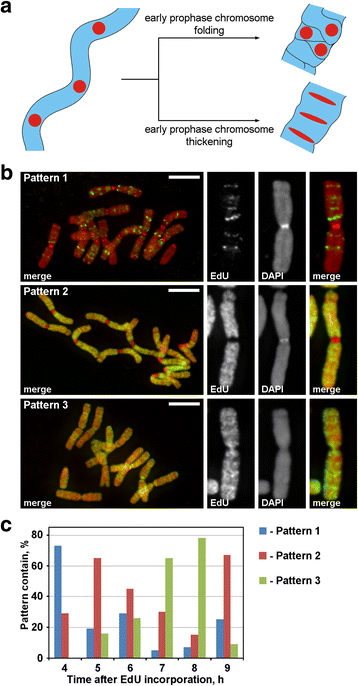
Marquage des chromosomes avec EdU. a La localisation et la morphologie des régions marquées ont révélé le principe de la condensation des chromosomes en prophase. Les régions chromosomiques étiquetées et disposées linéairement pendant la transition entre la prophase précoce et la prophase tardive perdent leur disposition linéaire (pliage) ou la conservent (épaississement). b Trois modèles d’incorporation d’EdU ont été détectés dans les chromosomes : étiquetage de régions discrètes (modèle 1), étiquetage des bras chromosomiques mais pas des centromères (modèle 2) et étiquetage des bras chromosomiques et des centromères (modèle 3). c Fréquences des différents modèles d’étiquetage à différents moments après l’incorporation d’EdU. Barres d’échelle : 5 μm
L’EdU a été incorporé pendant 30 min dans les racines de N. damascena, et après différentes périodes de poursuite (de 2 à 14 h), les étalements de chromosomes ont été réalisés. Trois modèles de marquage des chromosomes ont été détectés : marquage de régions discrètes (modèle 1), marquage des bras de chromosomes mais pas des centromères (modèle 2) et marquage des bras de chromosomes et des centromères (modèle 3) (Fig. 3b). Le motif 1 a été observé plus souvent 4 heures après l’incorporation de l’EdU, ce qui indique que ce marquage est typique de la fin de la phase S (Fig. 3c ; fichier supplémentaire 2 : Figure S2). Dans le cas du schéma 1, le marquage des chromosomes homologues était similaire (fichier supplémentaire 3 : figure S3), indiquant un schéma spécifique d’incorporation d’EdU. Les bras chromosomiques ont été marqués pendant le reste de la phase S (motifs 2 et 3), mais les régions centromériques ont également été marquées approximativement à la limite entre la phase S précoce et la phase S tardive (motif 3) (Fig. 3c).
Nous avons analysé les transitions de la prophase précoce à la prophase tardive en utilisant des chromosomes dans lesquels la chromatine à réplication tardive a été marquée (motif 3). Dans les chromosomes de prophase précoce, les régions marquées étaient distribuées linéairement le long de chromosomes minces (figure 4a). Dans les chromosomes de la prophase tardive, qui étaient environ deux fois plus épais que ceux de la prophase précoce, les régions marquées ont perdu la linéarité de leur distribution (Fig. 4b). Cette observation n’était pas complètement valide puisque les chromosomes en prophase et en métaphase sont constitués de deux chromatides qui se séparent progressivement, ce qui peut entraîner une perte de la linéarité de la distribution des régions marquées. Nous avons donc analysé les chromatides en anaphase (c’est-à-dire les chromosomes entièrement compactés après la ségrégation des chromatides). Dans les chromatides en anaphase dont le diamètre est approximativement égal au diamètre des chromosomes en fin de prophase, les régions chromatiniennes marquées n’étaient pas disposées de façon linéaire mais étaient distribuées dans tout le volume des chromatides (Fig. 4c). A la télophase, les cavités sans chromatine étaient clairement visibles dans les régions axiales des chromatides, permettant la détection des fibres de chromatine à l’intérieur desquelles les régions marquées étaient disposées linéairement (Fig. 4d). Par conséquent, pendant la transition de la prophase précoce à la prophase tardive, le repliement des chromosomes de la prophase précoce a eu lieu. Ce résultat est en accord avec les observations des chromosomes en prophase moyenne colorés au DAPI (Fig. 2b), à l’intérieur desquels des fibres fines pliées étaient clairement visibles.
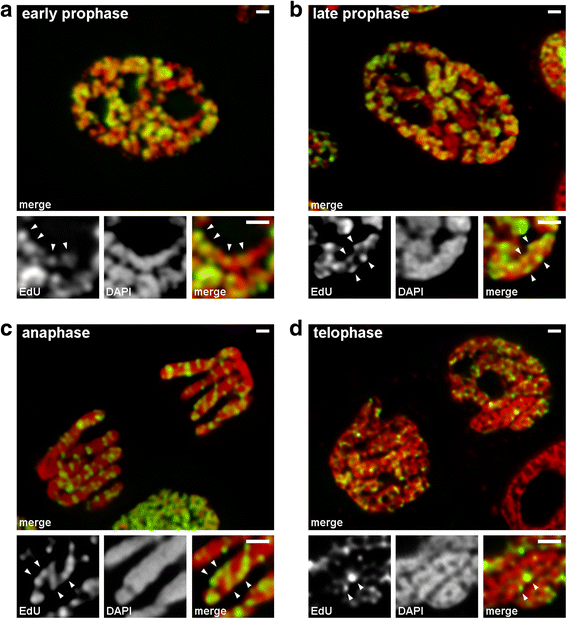
Condensation/décondensation des chromosomes pendant la mitose de N. damascena (cellules mitotiques dont les chromosomes comprenaient de l’EdU pendant la fin de la phase S). a Au début de la prophase, les régions marquées étaient distribuées linéairement dans les chromosomes minces, couvrant presque entièrement la largeur du chromosome. b À la fin de la prophase, les régions marquées étaient dispersées dans tout le volume du chromosome. c À l’anaphase, le modèle de marquage était similaire à celui des chromosomes de la fin de la prophase. d À la fin de la télophase, la décondensation a révélé des fibres minces formant des chromatides à l’intérieur desquelles les régions marquées étaient distribuées de manière similaire à celle à l’intérieur des chromosomes de la prophase précoce. Barres d’échelle : 1 μm
Condensation/décondensation des chromosomes au cours de la mitose analysée par microscopie électronique
Pour la détection de l’organisation interne des fibres de chromatine, dont le repliement a été décrit en utilisant la microscopie optique, nous avons utilisé la microscopie électronique. Pour détecter et mesurer les sous-structures fibrillaires de la chromatine, nous avons analysé les cavités sans chromatine, qui séparaient les fibres de chromatine comme nous le supposions (fichier additionnel 4 : figure S4 ; tableau 2).
Les noyaux en interphase étaient remplis d’un maillage de fibres épaisses de 234 ± 49 nm (moyenne ± S.D.) (figure 5a), qui peuvent être appelées » chromonèmes en interphase « , comme discuté ailleurs . La microscopie électronique a permis de détecter trois stades de condensation des chromosomes en prophase, dont le plus précoce n’était pas détectable en microscopie optique et sera appelé ici » préprophase « . Les deuxième et troisième stades correspondaient à la prophase précoce et tardive, comme décrit ci-dessus (Fig. 2a et c, respectivement).
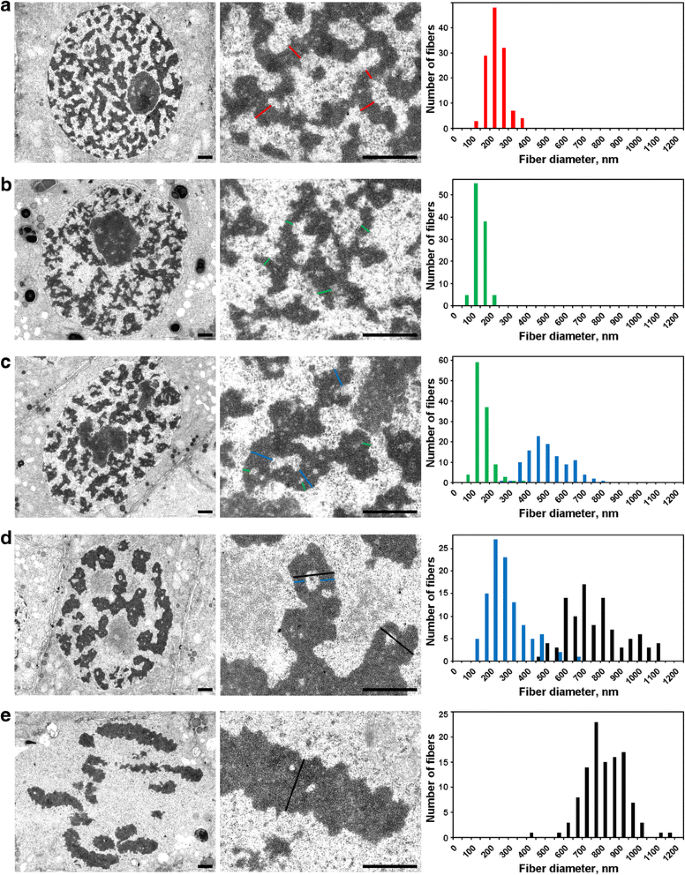
Morphométrie par microscopie électronique des chromosomes de N. damascena : condensation chromosomique de l’interphase à la métaphase. Les panneaux de gauche et central montrent l’organisation ultrastructurale (vue générale et fragment), les panneaux de droite montrent des histogrammes décrivant les distributions de largeur des chromosomes et des fibres chromatiniennes. a Interphase. b Préprophase. c Début de prophase. d Fin de prophase. e Métaphase. Les coupes transversales typiques des chromosomes et/ou des fibrilles de chromatine sont indiquées par des lignes de couleur : rouge – chromonèmes interphasiques (hétérochromatine), vert – chromonèmes ; bleu – ‘fibres de 300 nm’ ; noir – chromosomes. Barres d’échelle : 1 μm
(1) En préprophase, les chromosomes étaient mal séparés les uns des autres, et nous n’avons pas pu mesurer précisément leur diamètre (figure 5b). Les chromosomes en préprophase étaient formés de fibres d’un diamètre de 148 ± 30 nm (tableau 2), qui correspondaient très probablement aux fibres d’un diamètre de 100-130 nm (chromonème), qui constituent la principale sous-structure chromosomique des chromosomes en prophase et en télophase dans les cellules animales . Les données ne nous ont pas permis d’établir l’identité des chromonèmes interphasiques et mitotiques, mais des données rapportées précédemment indiquent que les chromonèmes interphasiques sont des complexes formés par des chromonèmes repliés .
(2) Au début de la prophase, la séparation des chromosomes s’est produite (figure 5c). Le diamètre des chromosomes était de 527 ± 107 nm, et ces chromosomes étaient également formés par des chromonèmes d’un diamètre de 158 ± 46 nm.
(3) Enfin, nous avons analysé les cellules en prophase tardive, qui contenaient des chromosomes épaissis d’un diamètre de 809 ± 185 nm (Fig. 5d). Certains chromosomes en prophase tardive contenaient des cavités dans les régions axiales qui nous ont permis de distinguer les fibres d’un diamètre de 285 ± 102 nm (‘300 nm fiber’). L’analyse utilisant les segments de chromosomes marqués a démontré que les chromosomes de la prophase précoce se sont repliés pour former des chromosomes de la prophase tardive plus épais (Fig. 4). Par conséquent, il est possible de supposer que les fibres de 285 ± 102 nm et les chromosomes de prophase précoce de 527 ± 107 nm étaient les mêmes fibres. La diminution du diamètre des fibres peut être associée à la compaction de la chromatine des chromosomes en prophase précoce, ce qui était également indiqué par la disparition des chromonèmes visibles.
La chromatine à l’intérieur des chromosomes en métaphase (Fig. 5e) et des chromatides en anaphase (Fig. 6a) était fortement compactée, et, bien que de rares cavités sans chromatine soient visibles à l’intérieur, une distinction précise de toute substructure fibrillaire était impossible. Dans les chromosomes en début de télophase, deux types de cavités ont été clairement détectés (Fig. 6b). Les grandes cavités étaient situées dans la région axiale des chromatides, ce qui nous a permis d’identifier et de mesurer des fibres d’un diamètre de 422 ± 78 nm. Dans les régions centrales de ces fibres, nous avons détecté de petites cavités qui ont permis l’identification d’un second type de fibres d’un diamètre de 182 ± 47 nm. Le premier type de fibres pourrait correspondre aux ‘fibres de 300 nm’ à l’intérieur des chromosomes en fin de prophase, le second type pourrait correspondre aux chromonèmes.

Morphométrie par microscopie électronique des chromosomes de N. damascena : décondensation chromosomique de l’anaphase à la phase G1. Les panneaux gauche et central montrent l’organisation ultrastructurale (vue générale et fragment), le panneau droit montre des histogrammes décrivant les distributions de largeur des chromatides et des fibres chromatiniennes. a Anaphase. b Télophase précoce. c Télophase tardive. d Phase G1. Les coupes transversales typiques des chromosomes et/ou des fibrilles de chromatine sont indiquées par des lignes de couleur : rouge – chromonèmes interphasiques, vert – chromonèmes ; bleu – ‘fibres de 300 nm’ ; noir – chromatides. Barres d’échelle : 1 μm
À la fin de la télophase (Fig. 6c) et à la phase G1 (Fig. 6d), les chromosomes ont été décondensés en domaines chromosomiques dans les noyaux des filles où ils ne peuvent pas être facilement observés. Néanmoins, il a été possible d’identifier des fragments de chromatides séparés. A ce stade, les chromatides étaient formées de fibres d’un diamètre d’environ 250 nm, ce qui correspond approximativement au diamètre des chromonèmes en interphase. Cette observation, en plus de la disparition des fibres de chromonèmes, indique que, à ce stade de la mitose, les fibres de chromatine ont été repliées pour former des complexes interphasiques de chromatine condensée.