- Introducción
- Materiales y métodos
- Sujetos y paradigma experimental
- Resonancia magnética funcional y señales dependientes del nivel de oxígeno en sangre
- Selección de las regiones de interés para las señales dependientes del nivel de oxígeno en sangre del cerebelo/tallo cerebral
- Cálculo de las ondas promediadas dependientes del nivel de oxígeno en sangre, del intervalo entre latidos y de la respiración
- Resultados
- Discusión
- Coincidencia de las ondas respiratorias y el artefacto dependiente del nivel de oxígeno en la sangre
- Activación neuronal rítmica asociada a la oscilación neuronal dependiente del nivel de oxígeno en sangre
- La actividad neural actúa como «fuerza motriz» para las oscilaciones lentas del ritmo cardíaco
- Limitaciones y perspectivas futuras
- Conclusión
- Disponibilidad de los datos
- Declaración ética
- Contribuciones de los autores
- Declaración de conflicto de intereses
- Agradecimientos
- Abreviaturas
Introducción
La arritmia sinusal respiratoria (RSA) refleja la aceleración de la frecuencia cardíaca (FC) durante la inspiración y la desaceleración de la FC durante la espiración. Es un principio fundamental (Yasuma y Hayano, 2004) y el fenómeno central de la respiración de resonancia al ritmo de 6/min asociado con una variabilidad de la frecuencia cardíaca (VFC) amplificada de baja frecuencia, un mayor bienestar emocional (Mather y Thayer, 2018) y un mejor procesamiento de las emociones negativas (Zaccaro et al., 2018). Curiosamente, hay excepciones de la RSA con aumentos del intervalo entre latidos de la FC (RRI) durante la inspiración y con la fase de RRI que lidera en relación con el ritmo respiratorio (Rassler et al., 2018). Esta inusual RSA paradójica se encontró en una minoría de participantes sanos durante la exploración de imágenes de resonancia magnética funcional (fMRI), una situación incómoda, a veces claustrofóbica, generalmente asociada con un aumento de la ansiedad estatal (Munn et al., 2015; Pfurtscheller et al., 2018).
Las ondas respiratorias espontáneas lentas con una frecuencia de entre 6 y 9 respiraciones/min también se acompañan de una VFC elevada y, por lo tanto, podrían facilitar el procesamiento de emociones desagradables como la ansiedad y el estrés (Thayer y Lane, 2009). Debido al protagonismo de la RRI sobre las oscilaciones respiratorias durante el cese inusual de la RSA (Rassler et al., 2018), parece probable la existencia de un oscilador neuronal autónomo (marcapasos central; Julien, 2006) en el cerebro, que actúa como fuente de las oscilaciones lentas de la RRI. Cabe destacar que Perlitz et al. (2004) informaron sobre un nuevo tipo de ritmo cardiovascular en la banda de 0,15 Hz en el hombre y el perro con un origen común en el tronco cerebral. La característica más interesante de este «ritmo de 0,15 Hz» de banda ancha (que incluye también componentes de frecuencia cercanos a 0,1 Hz) es que los períodos de las ondas fusiformes están acoplados en fase con la respiración en una proporción de 1:1. Nuestro principal interés en la investigación era identificar este marcapasos, que se sugiere que está localizado en el tronco cerebral (Lambertz y Langhorst, 1998; Perlitz et al., 2004), mediante el análisis de las señales BOLD.
La señal BOLD no cuantifica directamente la actividad neuronal en sí misma, sino que es sensible a los cambios en la tasa metabólica cerebral, el flujo sanguíneo cerebral y el volumen sanguíneo cerebral (Obrig y otros, 2000; Buxton y otros, 2004) y a varios tipos de movimiento (movimientos del tórax y los vasos sanguíneos; Birn y otros, 2006). Por lo tanto, las señales BOLD pueden estar compuestas por componentes neuronales y no neuronales (por ejemplo, el movimiento de los vasos). Se espera que puedan identificarse dos señales BOLD de distinto origen en el tronco cerebral con su gran vaso sanguíneo (arteria basilar) y la fuente neural postulada de 0,15 Hz (Perlitz et al., 2004). Suponemos que uno de ellos resulta del movimiento de los vasos sanguíneos (BOLDv) e indica el inicio de una acción respiratoria lenta, ya que se produce casi simultáneamente con la activación neural de las neuronas respiratorias. La otra se cree que está asociada a la activación neural (BOLDn) retrasada por el tiempo de acoplamiento neurovascular de 2-3 s (Mateo et al., 2017). Especulamos que ambas señales BOLD apuntan a un marcapasos central en el tronco cerebral.
Materiales y métodos
Sujetos y paradigma experimental
El grupo de sujetos estudiados fue el mismo (edad 23,8 ± 3,3 años) analizado recientemente por Rassler et al. (2018). El registro y el preprocesamiento del ECG y la respiración se describieron en ese trabajo. Todos los participantes dieron su consentimiento informado por escrito al protocolo del estudio, que había sido aprobado por el Comité de Ética local de la Universidad de Graz.
Resonancia magnética funcional y señales dependientes del nivel de oxígeno en sangre
Las imágenes funcionales se adquirieron con un escáner de 3 T (Magnetom Skyra) utilizando una secuencia GE-EPI multibanda (Moeller et al, 2010) con una adquisición simultánea de seis bandas con TE/TR = 34/871 ms, ángulo de flip de 52°, tamaño de voxel de 2 mm × 2 mm × 2 mm, 66 cortes axiales contiguos (11 × 6), matriz de adquisición de 90 × 104 y un FOV de 180 mm × 208 mm. Esta velocidad de barrido de 871 ms (frecuencia de muestreo de 1,15 Hz) permite estudiar las oscilaciones lentas en el rango de 0,1-0,15 Hz. Para más detalles sobre el preprocesamiento, véase Pfurtscheller et al. (2018). Se utilizó el atlas de etiquetado anatómico automatizado (AAL) (Tzourio-Mazoyer et al., 2002) para extraer los cursos temporales de las señales BOLD en 116 regiones de interés (ROI). Este atlas no muestra ROIs en el tronco cerebral, sino sólo en la proximidad del cerebelo y el vermis. Debido a la proximidad de estas regiones y a la contigüidad de una arteria principal, es razonable asumir que la señal recogida en las ROIs de AAL etiquetadas como «cerebelo» refleja parcialmente la actividad del tronco cerebral.
Selección de las regiones de interés para las señales dependientes del nivel de oxígeno en sangre del cerebelo/tallo cerebral
Entre las 116 ROI del atlas AAL, las ROI 91 a ROI 108 corresponden a cortes axiales del cerebelo que incluyen el tallo cerebral (Tzourio-Mazoyer et al., 2002). Las imágenes T1 del corte axial (espacio Talairach z = -34) documentan la proximidad del cerebelo y el tronco cerebral (Figura 1). Debido a su pequeño número de vóxeles (<200), los ROIs 107 y 108 fueron excluidos del análisis posterior. Los ROIs del cerebelo/tallo cerebral se inspeccionaron visualmente para buscar los ROIs apropiados, es decir, ROIs con una buena relación señal-ruido y ondas BOLD lentas dominantes. Se identificaron las siguientes ROI: 96, 98, 100, 103 y 105. Los números indican las etiquetas de las ROI según el atlas AAL. Los números pares e impares denotan los hemisferios izquierdo y derecho, respectivamente.
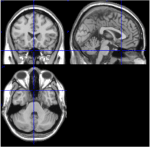
Figura 1. Imágenes T1 de cortes mediales, sagitales y axiales de un sujeto (espacio de Talairach 0, 20, -34). En el corte sagital (imagen superior derecha), el puente de Varolio es claramente visible, y en el corte axial (abajo) se documenta la proximidad del cerebelo y el tronco cerebral.
Cálculo de las ondas promediadas dependientes del nivel de oxígeno en sangre, del intervalo entre latidos y de la respiración
El promediado permite mejorar la relación señal/ruido pero requiere el uso de un disparador. Dado que no se dispone de tales desencadenantes en los datos del estado de reposo, se utilizaron los máximos que se producen rítmicamente (picos) de la señal RRI (Pfurtscheller et al., 2017): En primer lugar, se identificaron los picos más prominentes de las señales de RRI, espaciados al menos varios segundos. En el caso de las oscilaciones de 0,1 Hz, estos intervalos entre los picos eran de unos 10 s, y en el caso de las oscilaciones de 0,15 Hz, eran de unos 7 s (un ejemplo se representa en la Figura 2 mediante las líneas verticales discontinuas casi equidistantes). Los picos de RRI marcados se utilizaron como disparadores para promediar (épocas con 6 s antes y 6 s después del disparador) las señales de BOLD, RRI y respiración.
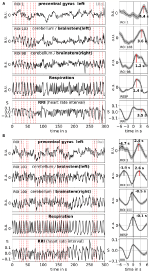
Figura 2. Ejemplos de señales BOLD, RRI y de respiración en curso y sus correspondientes ondas promediadas (±SE) para dos sujetos, uno con oscilaciones dominantes de 0,1 Hz y otro con oscilaciones dominantes de 0,15 Hz . Las líneas verticales discontinuas en los paneles de la izquierda indican los máximos (picos) de las oscilaciones de RRI utilizadas como desencadenantes del promedio. Los picos de las ondas promediadas se indican en los paneles del lado derecho.
Resultados
Las oscilaciones BOLD lentas en el cerebelo/tallo cerebral se caracterizan por su calidad de señal favorable pero, aún más importante, por su coincidencia con las oscilaciones en RRI y respiración. Como se informó en Rassler et al. (2018), las oscilaciones de 0,1-Hz prevalecieron durante ~37% del tiempo de grabación, mientras que las oscilaciones de 0,15-Hz prevalecieron en ~45%. En la Figura 2 se muestran dos ejemplos característicos para las oscilaciones de 0,1-Hz (sujeto 1Rb1) y 0,15-Hz (sujeto 11Ra1). En ambos casos, las oscilaciones de RRI de gran magnitud coinciden con la respiración en forma de aumento de RRI durante la inspiración y también se reflejan claramente en las señales BOLD en el tronco cerebral. Obsérvese que la dinámica variable de las oscilaciones espontáneas y de las ondas simples, respectivamente, en el estado de reposo, dan una fuerte evidencia de que existe no sólo uno sino una variedad de ritmos cardiovasculares con componentes de frecuencia cercanos a 0,1 y 0,15 Hz. Algunos de estos ritmos se amplifican durante el procesamiento de la ansiedad, otros no, y algunos se sincronizan en la corteza prefrontal y el tronco cerebral y otros no.
En la Figura 2 se muestran ejemplos de señales espontáneas y ondas promediadas de dos sujetos característicos. Las ondas promediadas con latencias máximas marcadas (distancia del pico de RRI) de todos los sujetos se muestran en la Figura 3. Cabe destacar que la varianza relativamente pequeña de las ondas BOLD promediadas en el tronco cerebral subraya la fiabilidad de las mediciones de los picos.
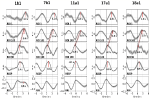
Figura 3. Ondas promediadas (±SE) de las señales BOLD de la circunvolución precentral izquierda (ROI 1), del tronco cerebral izquierdo (BOLDn, ROIs 103, 105), del tronco cerebral derecho (BOLDv, 96, 98, 100), de la respiración y de los intervalos RR (de arriba a abajo) de los cinco sujetos. Se marcan las latencias máximas (diferencia con el pico de RRI) de los picos importantes. El desplazamiento temporal de 2-3 s entre las dos señales BOLD del cerebelo/tronco cerebral se indica con una línea de puntos.
La onda BOLD del hemisferio derecho que precede a la onda respiratoria en 0,3 ± 0,2 s se interpretó como BOLDv, y la onda BOLD del hemisferio izquierdo que va por detrás de la onda respiratoria en 2,3 ± 0,5 s se tomó como BOLDn. La diferencia máxima entre las ondas BOLDv y BOLDn fue de 2,6 ± 0,4 s.
Las ondas promediadas en la Figura 3 destacan el claro cambio de fase entre las dos señales BOLD en el tronco cerebral (BOLDn, BOLDv) en los cinco sujetos. Las diferencias máximas se indican con líneas punteadas. Además de las dos señales BOLD del tronco cerebral, se analizó como control la señal BOLD del giro precentral izquierdo (ROI 1). Aunque las ondas BOLD promediadas en la corteza prefrontal (PFC) muestran una elevada varianza (SE), coinciden sorprendentemente con las ondas BOLDn del cerebelo/tallo cerebral. Esto confirma la fuerte interacción entre el CPF y el tronco cerebral en el rango de frecuencias lentas alrededor de 0,1 Hz.
Discusión
Coincidencia de las ondas respiratorias y el artefacto dependiente del nivel de oxígeno en la sangre
La respiración va acompañada no sólo del movimiento del tórax sino también del movimiento de los vasos sanguíneos cerebrales (Birn et al., 2006). Se observó un desplazamiento temporal estable de 0,3 ± 0,2 s entre el pico positivo de la señal BOLDv en el cerebelo/tronco cerebral derecho y el máximo de cada onda respiratoria (inicio de la espiración). La respiración fue espontánea y el pico de respiración se retrasó con respecto al pico de BOLDv, lo que posiblemente indica una rápida vasomoción de la arteria basilar, un gran vaso sanguíneo cercano al lado rostral del puente de Varolio. Esta vasomoción podría considerarse un artefacto respiratorio inducido por una modulación respiratoria de las neuronas simpaticoexcitatorias en el núcleo reticular rostroventrolateral. Se ha observado una marcada influencia del generador central de patrones respiratorios sobre la actividad nerviosa simpática en muchas especies, incluida la humana (Haselton y Guyenet, 1989; Häbler y Jänig, 1995; Eckberg, 2003; Mandel y Schreihofer, 2006). La disminución de la actividad de estas neuronas en la médula rostroventrolateral (es decir, la depresión simpática) durante la inspiración y un repunte abrupto de la actividad con el cese de las ráfagas frénicas es uno de los patrones predominantes del acoplamiento respiratorio-simpático (Haselton y Guyenet, 1989). Estas oscilaciones simpáticas moduladas por la respiración provocan una vasodilatación máxima al final de la inspiración (es decir máximo de la señal BOLD inmediatamente anterior al inicio de la espiración) y vasoconstricción durante la espiración (mínimo de la señal BOLD justo antes del inicio de la inspiración).
Activación neuronal rítmica asociada a la oscilación neuronal dependiente del nivel de oxígeno en sangre
Las oscilaciones BOLD (BOLDn) se retrasaron respecto al artefacto respiratorio periódico (BOLDv) en 2.6 ± 0,4 s. Ambas oscilaciones BOLD se registraron simultáneamente en cortes axiales, estando la BOLDn asociada a la actividad neural como fuerza impulsora de la respiración espontánea y la BOLDv reflejando un movimiento vascular asociado al inicio de la espiración. Este retardo de 2-3 s se corresponde con el tiempo de acoplamiento neurovascular (Mateo et al., 2017).
Las diversas influencias externas sobre la emoción provocadas por la incómoda posición supina con la cabeza del sujeto en un espacio ruidoso limitado pueden activar primero las áreas sensoriales primarias y ser seguidas por la proyección cortical a las neuronas respiratorias del tronco cerebral. Además, las influencias internas y conductuales procedentes de centros superiores modifican los patrones respiratorios metabólicos. La salida respiratoria final implica una compleja interacción entre las estructuras corticales, el tronco cerebral y el sistema límbico y es característica de la respiración emocional (Homma y Masaoka, 2008; Kato et al., 2018). Por lo tanto, es bastante plausible que las oscilaciones en la circunvolución precentral izquierda (ROI 1) estuvieran sincronizadas con las oscilaciones BOLD lentas e inducidas neuralmente en el cerebelo/tallo cerebral.
La actividad neural actúa como «fuerza motriz» para las oscilaciones lentas del ritmo cardíaco
La dinámica variable de los patrones de acoplamiento observados en el estado de reposo apunta hacia una variedad de ritmos cardiovasculares en la banda de frecuencia entre 0,1 y 0,15 Hz. Esto subraya la importancia, la flexibilidad y la complejidad de la interacción cerebro-corazón y merece una investigación más intensa.
En los cinco participantes, el patrón de acoplamiento entre la respiración y la FC fue bastante contrario a la RSA típica (Rassler et al., 2018), es decir, la RRI aumentó durante la inspiración y disminuyó durante la espiración. Durante las situaciones que provocan ansiedad, la respiración tiende a ser más rápida y la actividad vagal disminuye, lo que conduce a una FC más alta (RRI más corto). Sin embargo, cuando la respiración se ralentiza de forma inconsciente/autónoma en una situación que provoca ansiedad, la actividad vagal podría aumentar, dando lugar a una FC más baja (RRI mayor). Parece que no sólo la activación cortical induce un aumento casi simultáneo de la RRI (Barry, 1983; Damen y Brunia, 1987; Pfurtscheller y Lopes da Silva, 1999; Pfurtscheller et al., 2013), sino que nuestro estudio proporciona la primera evidencia de que también un marcapasos central en el cerebelo/tronco cerebral puede actuar como fuerza impulsora de las oscilaciones intrínsecas de la RRI y de las ondas respiratorias lentas espontáneas. Este hallazgo apoya firmemente el trabajo de Perlitz et al. (2004) sobre el «ritmo de 0,15 Hz».
Limitaciones y perspectivas futuras
La selección de ROIs con señales BOLD de buena calidad en el cerebelo/tallo cerebral se realizó mediante inspección visual. Esto incluyó la diferenciación entre las oscilaciones BOLD de origen neural y los artefactos de movimiento. Estos últimos denotaban señales BOLD sincronizadas con la respiración. Para estudios posteriores, se recomienda calcular los valores de bloqueo de fase (PLV; Pfurtscheller et al., 2017) entre la RRI y las señales BOLD individuales en el cerebelo/tronco cerebral. Además, la evaluación sincrónica de las métricas de ventilación, como el volumen tidal/volumen respiratorio por tiempo, la pCO2 al final de la marea y el tipo de respiración (nariz frente a boca), así como el uso de varios métodos de eliminación de ruido en entornos clínicos y experimentales con animales, podrían ofrecer una visión más profunda de las complejas interacciones de los sistemas reguladores implicados.
La «desconexión» de la arritmia sinusal respiratoria es una excepción de un fenómeno fisiológico fundamental que puede ocurrir, por ejemplo, en situaciones que provocan ansiedad. Entre los 23 participantes sanos de un estudio de fMRI, sólo cinco sujetos presentaron este patrón de acoplamiento paradójico.
Un requisito previo para el análisis de BOLD (Bn y Bv) en el tronco cerebral es la coincidencia de la respiración lenta y las oscilaciones de RRI; sin embargo, tal acoplamiento 1:1 sólo puede encontrarse en una minoría de participantes. Por lo tanto, este tipo de análisis se limita a estos raros casos. No obstante, podríamos suponer que un marcapasos central en el tronco cerebral también es frecuente en individuos con una RSA normal y un acoplamiento 1:2 o 1:3 (dos o tres respiraciones durante un ciclo de RRI). Los primeros resultados del cálculo del acoplamiento de fase (PLV) entre las oscilaciones BOLD del tronco cerebral y las oscilaciones de RRI en la banda de 0,1- a 0,15-Hz apoyan esta suposición. Con este método, es posible medir la actividad del marcapasos en el tronco cerebral independientemente de la frecuencia respiratoria. Este trabajo está en curso.
Hay que tener en cuenta que el nivel de ansiedad estatal en los individuos con respiración espontánea lenta variaba entre AS = 14 y AS = 28 (rango posible de puntuaciones AS: 10-40) y no todos los individuos con puntuaciones de ansiedad elevadas mostraban este tipo de respiración lenta. Por lo tanto, concluimos que no existe una relación clara entre la respiración espontánea lenta y el procesamiento de la ansiedad.
Conclusión
1. Las oscilaciones BOLD en estado de reposo del cerebelo/tallo cerebral pueden tener frecuencias alternas entre 0,1 y 0,15 Hz, similares a las reportadas en las señales de RRI y respiración (Rassler et al., 2018).
2. Algunas señales BOLD del cerebelo/tallo cerebral pueden estar influenciadas por la vasomoción (arteria basilar), mientras que otras pueden estar asociadas a una actividad de marcapasos central en el tallo cerebral. En consecuencia, el momento real del inicio de la respiración, así como su fuente neural, podrían detectarse en las señales BOLD.
3. Ambas señales BOLD con diferentes orígenes registradas simultáneamente caracterizan una fuente común, lo que apoya el trabajo de Perlitz et al. (2004).
4. Los resultados sugieren que hay evidencia de una respiración emocional inconsciente a 6-9/min (0,1-0,15 Hz), que – de manera similar a la respiración de resonancia consciente a 6/min (0.1 Hz) que promueve el bienestar psicológico (Mather y Thayer, 2018) – también eleva la VFC y puede facilitar el procesamiento de las emociones negativas.
Disponibilidad de los datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración ética
Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Declaración de Helsinki de 1964 con el consentimiento informado por escrito de todos los sujetos. Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki. El protocolo fue aprobado por el Comité de Ética de la Universidad de Graz.
Contribuciones de los autores
GP contribuyó a la conceptualización y al borrador original. BR y AA ayudaron en la metodología, el procesamiento de datos, la estadística, la redacción y la visualización. AS, BR, GS, WK y JT revisaron y editaron el manuscrito.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Los autores desean agradecer a Thomas Zussner, David Fink y Karl Koschutnig, de la Universidad de Graz, su apoyo en la adquisición de datos.
Abreviaturas
BOLD, dependiente del nivel de oxigenación de la sangre; ECG, electrocardiograma; (f)MRI, resonancia magnética (funcional); FC, frecuencia cardíaca; VFC, variabilidad de la frecuencia cardíaca; PFC, córtex prefrontal; ROI, región de interés; RRI, intervalo entre latidos; RSA, arritmia sinusal respiratoria.
Barry, R. J. (1983). La bradicardia primaria y la respuesta cardíaca evocada en el contexto del quirófano. Physiol. Psychol. 11, 135-140. doi: 10.3758/BF03326784
CrossRef Full Text | Google Scholar
Birn, R. M., Diamond, J. B., Smith, M. A., and Bandettini, P. A. (2006). Separación de las fluctuaciones relacionadas con la variación respiratoria de las fluctuaciones relacionadas con la actividad neuronal en fMRI. NeuroImage 31, 1536-1548. doi: 10.1016/j.neuroimage.2006.02.048
PubMed Abstract | CrossRef Full Text | Google Scholar
Buxton, R. B., Uludag, K., Dubowitz, D. J., y Liu, T. T. (2004). Modelización de la respuesta hemodinámica a la activación cerebral. NeuroImage 23, 220-233. doi: 10.1016/j.neuroimage.2004.07.013
CrossRef Full Text | Google Scholar
Damen, E. J. P., y Brunia, C. H. M. (1987). Cambios en la frecuencia cardíaca y en los potenciales cerebrales lentos relacionados con la preparación motora y la anticipación del estímulo en una tarea de estimación del tiempo. Psychophysiology 24, 700-713. doi: 10.1111/j.1469-8986.1987.tb00353.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Eckberg, D. L. (2003). La puerta respiratoria humana. J. Physiol. 548, 339-352. doi: 10.1113/jphysiol.2002.037192
PubMed Abstract | CrossRef Full Text | Google Scholar
Häbler, H.-J., and Jänig, W. (1995). Coordinación de los sistemas simpático y respiratorio: experimentos neurofisiológicos. Clin. Exp. Hypertens. 17, 223-235. doi: 10.3109/10641969509087067
CrossRef Full Text | Google Scholar
Haselton, J. R., y Guyenet, P. G. (1989). Modulación respiratoria central de las neuronas simpaticoexcitatorias medulares en la rata. Am. J. Phys. 256, R739-R750. doi: 10.1152/ajpregu.1989.256.3.R739
PubMed Abstract | CrossRef Full Text | Google Scholar
Homma, I., and Masaoka, Y. (2008). Ritmos respiratorios y emociones. Exp. Physiol. 93, 1011-1021. doi: 10.1113/expphysiol.2008.042424
PubMed Abstract | CrossRef Full Text | Google Scholar
Julien, C. (2006). El enigma de las ondas Mayer: hechos y modelos. Cardiovasc. Res. 70, 12-21. doi: 10.1016/j.cardiores.2005.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, A., Takahashi, K., y Homma, I. (2018). Relaciones entre el rasgo y los parámetros respiratorios durante la respiración tranquila en sujetos normales. J. Physiol. Sci. 68, 369-376. doi: 10.1007/s12576-017-0539-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Lambertz, M., y Langhorst, P. (1998). Cambios simultáneos de la organización rítmica en las neuronas del tronco cerebral, la respiración, el sistema cardiovascular y el EEG entre 0,05 Hz y 0,5 Hz. J. Auton. Nerv. Syst. 68, 58-77.
Google Scholar
Mandel, D. A., y Schreihofer, A. M. (2006). Central respiratory modulation of barosensitive neurones in rat caudal ventrolateral medulla. J. Physiol. 572, 881-896. doi: 10.1113/jphysiol.2005.103622
PubMed Abstract | CrossRef Full Text | Google Scholar
Mateo, C., Knutsen, P. M., Tsai, P. S., Shih, A. Y., y Kleinfeld, D. (2017). El arrastre de las fluctuaciones vasomotoras de las arteriolas por la actividad neural es una base de la conectividad de «estado de reposo» dependiente del nivel de oxigenación de la sangre. Neuron 96, 1-13. doi: 10.1016/j.neuron.2017.10.012
CrossRef Full Text | Google Scholar
Mather, M., y Thayer, J. (2018). Cómo la variabilidad de la frecuencia cardíaca afecta a las redes cerebrales de regulación de la emoción. Curr. Opin. Behav. Sci. 19, 98-104. doi: 10.1016/j.cobeha.2017.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Moeller, S., Yacoub, E., Olman, C. A., Auerbach, E., Strupp, J., Harel, N., et al. (2010). Multiband multislice GE-EPI at 7 Tesla, with 16-fold acceleration using partial parallel imaging with application to high spatial and temporal whole-brain fMRI. Magn. Reson. Med. 63, 1144-1153. doi: 10.1002/mrm.22361
PubMed Abstract | CrossRef Full Text | Google Scholar
Munn, Z., Moola, S., Lisy, K., Riitano, D., y Murphy, F. (2015). Claustrofobia en la resonancia magnética: una revisión sistemática. Radiography 21, e59-e63. doi: 10.1016/j.radi.2014.12.004
CrossRef Full Text | Google Scholar
Obrig, H., Neufang, M., Wenzel, R., Kohl, M., Steinbrink, J., Einhäupl, K., et al. (2000). Spontaneous low frequency oscillations of ccerebral hemodynamics and metabolism in human adults. NeuroImage 12, 623-639. doi: 10.1006/nimg.2000.0657
PubMed Abstract | CrossRef Full Text | Google Scholar
Perlitz, V., Lambertz, M., Cotuk, B., Grebe, R., Vandenhouten, R., Flatten, G., et al. (2004). Ritmos cardiovasculares en la banda de 0,15 Hz: ¿origen común de fenómenos idénticos en el hombre y el perro en la formación reticular del tronco cerebral? Eur. J. Phys. 448, 579-591. doi: 10.1007/s00424-004-1291-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., y Lopes da Silva, F. (1999). Sincronización y desincronización EEG/MEG relacionada con eventos: principios básicos. Clin. Neurophysiol. 110, 1842-1857. doi: 10.1016/S1388-2457(99)00141-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Brito, J., et al. (2017). Comunicación cerebro-corazón: evidencia de oscilaciones de «marcapasos central» con una frecuencia dominante a 0,1 Hz en el cíngulo. Clin. Neurophysiol. 128, 183-193. doi: 10.1016/j.clinph.2016.10.097
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Schwerdtfeger, A., Seither-Preisler, A., Brunner, C., Aigner, C. S., Calisto, J., et al. (2018). Sincronización de las oscilaciones intrínsecas de 0,1 Hz dependientes del nivel de oxígeno en la amígdala y la corteza prefrontal en sujetos con aumento de la ansiedad estatal. Eur. J. Neurosci. 47, 417-426. doi: 10.1111/ejn.13845
PubMed Abstract | CrossRef Full Text | Google Scholar
Pfurtscheller, G., Solis-Escalante, T., Barry, R. J., Klobassa, D. S., Neuper, C., and Müller-Putz, G. R. (2013). Cambios en la frecuencia cardíaca y en el EEG durante la ejecución y la retención de imágenes motoras de pie a ritmo de pista. Front. Hum. Neurosci. 7:379. doi: 10.3389/fnhum.2013.00379
PubMed Abstract | CrossRef Full Text | Google Scholar
Rassler, B., Schwerdtfeger, A., Aigner, C. S., and Pfurtscheller, G. (2018). «La desconexión» de la arritmia sinusal respiratoria puede ocurrir en una minoría de sujetos durante la resonancia magnética funcional (fMRI). Front. Physiol. 9:1688. doi: 10.3389/fphys.2018.01688
PubMed Abstract | CrossRef Full Text | Google Scholar
Thayer, J. F., y Lane, R. D. (2009). Claude Bernard y la conexión corazón-cerebro: elaboración adicional de un modelo de integración neurovisceral. Neurosci. Biobehav. Rev. 33, 81-88. doi: 10.1016/j.neubiorev.2008.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Etiquetado anatómico automatizado de las activaciones en SPM utilizando una parcelación anatómica macroscópica del cerebro de un solo sujeto de MNI MRI. NeuroImage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
Yasuma, F., y Hayano, J. (2004). Arritmia sinusal respiratoria: ¿por qué se sincronizan los latidos del corazón con el ritmo respiratorio? Chest 125, 683-690. doi: 10.1378/chest.125.2.683
PubMed Abstract | CrossRef Full Text | Google Scholar
Zaccaro, A., Piarulli, A., Laurino, M., Garbella, E., Menicucci, D., Neri, B., et al. (2018). Cómo el control de la respiración puede cambiar tu vida: una revisión sistemática sobre los correlatos psicofisiológicos de la respiración lenta. Front. Hum. Neurosci. 12:353. doi: 10.3389/fnhum.2018.00353. eCollection 2018.
CrossRef Full Text | Google Scholar