La colonoscopia para el cribado del cáncer de colon es eficaz tanto para la reducción de la mortalidad mediante la detección precoz como para la prevención mediante la extirpación de los pólipos precancerosos (1-8). Estos beneficios, sin embargo, podrían verse contrarrestados por la inadecuación de la calidad de la colonoscopia y las complicaciones (9-17). Los pólipos omitidos y la polipectomía incompleta pueden contribuir al desarrollo del cáncer de intervalo (cánceres detectados después de la colonoscopia) (10-14, 18, 19). Aunque la hemorragia poscolonoscopia es relativamente infrecuente, ya que se produce entre 1 y 6/1000 (15-17), es la principal complicación que provoca visitas hospitalarias no planificadas en los 7 días siguientes a la colonoscopia (20). La polipectomía es el factor más importante (21-26). Los factores de riesgo que aumentan la hemorragia tras la polipectomía son el tamaño del pólipo, el número de pólipos, el tratamiento anticoagulante y la histología del pólipo (17, 21, 27, 28). Las técnicas avanzadas de polipectomía, como la resección endoscópica de la mucosa (REM) y la disección endoscópica de la submucosa (DES), parecen eliminar los pólipos de forma más completa, pero también aumentan el tiempo del procedimiento, el coste y los riesgos de hemorragia (17, 29-31).
Aparte de la REM y la DES, se ha prestado poca atención a la técnica de polipectomía como factor de riesgo de hemorragia postpolipectomía. De hecho, la técnica tradicional de polipectomía con asa, generalmente aceptada y ampliamente utilizada, que consiste en guillotinar el pólipo atrapado con o sin coagulación por calor, no ha cambiado mucho durante casi 5 décadas (32-37). Para evitar la hemorragia posterior a la polipectomía, uno de los autores (ZJC) desarrolló la extirpación endoscópica de la mucosa (EMS) como una modificación de la polipectomía tradicional con asa fría (TCSP) para evitar el corte en la submucosa rica en vasos sanguíneos, ya que todos los pólipos no cancerosos, que son el tipo más frecuente de pólipos observados durante la colonoscopia de cribado, están por definición limitados a la mucosa y no se extienden a la submucosa. El 31 de diciembre de 2012 se tomó la decisión de adoptar sistemáticamente la innovación técnica porque la EMS mostró un éxito temprano en la eliminación completa de los pólipos no pediculados sin una lesión sustancial de la submucosa. Este informe analizó la eficacia de la EMS en la prevención de la hemorragia postpolipectomía y en la facilitación de la extirpación completa de los pólipos, especialmente en el caso de los pólipos avanzados de alto riesgo.
- Métodos
- Pacientes y diseño del estudio
- Extracción endoscópica de la mucosa (EMS)
- Evaluación de resultados
- Examen de colonoscopia
- Análisis estadístico
- Resultados
- El EMS evitó el sangrado postpolipectomía que requería hospitalización
- Polipectomía completa facilitada por EMS
- Discusión
- Declaración ética
- Contribuciones de los autores
- Declaración de conflicto de intereses
- Agradecimientos
- Material complementario
- Abreviaturas
Métodos
Pacientes y diseño del estudio
Se trató de una investigación retrospectiva de los datos que incorporaban la historia clínica electrónica y las láminas de patología en Minnesota Gastroenterology, PA (MNGI). Se concedió una exención de la Junta de Revisión Interna para la investigación. Los pacientes fueron aquellos que se sometieron a una colonoscopia con polipectomía con asa bajo el código 45385 de la Current Procedural Terminology (CPT) por ZJC en los centros de endoscopia ambulatoria de MNGI durante un período de 12 años dividido en la era pre-EMS (2005-2012) y la era EMS (2013-2016). Se realizó una búsqueda en la base de datos de los casos de hemorragia postpolipectomía que requirieron hospitalización y pólipos avanzados definidos como pólipos con características vellosas, displasia de alto grado, adenoma serrado sésil con displasia citológica (SSACD), así como cualquier pólipo adenomatoso de 10 mm o más. Dado que el MNGI contaba con una amplia cobertura de la práctica local y con una línea telefónica de atención a las complicaciones las 24 horas del día, tenía una tasa de captura casi completa de las complicaciones que se revisaban por pares y se devolvían a los endoscopistas implicados para mejorar la calidad.
Extracción endoscópica de la mucosa (EMS)
La extracción endoscópica de la mucosa (EMS) es la eliminación endoscópica de la mucosa que contiene pólipos mediante la extracción mecánica utilizando un asa fría. Se trata de una modificación del TCSP en el sentido de que el EMS desprende la mucosa de la submucosa enredada en el espacio potencial entre ellas (figura 1, vídeo suplementario) en lugar de guillotinar todo el tejido enredado como se describió originalmente para el TCSP (36, 37). Por lo tanto, se espera que la EMS minimice la lesión submucosa y la hemorragia inmediata y tardía asociada. En el caso de los raros pólipos pedunculados, seguimos utilizando la polipectomía con asa caliente porque el daño tisular inducido por la cauterización puede limitarse en gran medida al tallo intraluminal y no se extiende en profundidad a la pared colónica. Por lo tanto, aplicamos la EMS exclusivamente a los pólipos no pediculados sin características sugestivas de malignidad. A continuación, detallamos las particularidades de las técnicas de EMS en función del tamaño del pólipo.
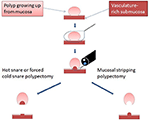
Figura 1. Diagrama que ilustra la diferencia crítica entre la EMS y la polipectomía tradicional con asa. Reimpreso de Chen y Batts (38), Copyright (2017) con permiso de Elsevier para su uso como contenido de acceso abierto bajo licencia de usuario CC-BY.
Para pólipos pequeños (≤ 5 mm), la TCSP suele funcionar bien. Para garantizar una resección completa, preferimos el asa en lugar de las pinzas de biopsia, excepto para los pólipos diminutos de 2 mm o menos (25), y eliminamos rutinariamente 2-3 mm de mucosa adyacente durante la polipectomía. Sin embargo, la submucosa puede quedar atrapada dentro del asa, impidiendo el cierre completo del asa sin una guillotina de fuerza bruta o una coagulación por calor (asa caliente). Cuando esto ocurre, al tirar suavemente del asa hacia el interior del endoscopio mientras se mantiene el asa cerrada con firmeza, pero no con fuerza, se suele desprender la mucosa que contiene pólipos, dejando atrás la submucosa atrapada, formando un pseudotallo transitoriamente elevado (figura 2A). Endoscópicamente, la mucosa desprendida suele ser de una sola pieza, mientras que la submucosa permanece en gran medida intacta, sin daños en los vasos sanguíneos (Figura 2B). El desgarro de la mucosa causado por la EMS generalmente crea un sitio de polipectomía ligeramente más grande pero mucho menos sangriento que el causado por la TCSP. Para que la EMS sea eficaz, es fundamental mantener el asa cerrada con firmeza pero no con demasiada fuerza durante la extracción. Si no se cierra el asa con la suficiente firmeza, se producirá un deslizamiento del asa, mientras que si se cierra con demasiada fuerza, se producirá un daño submucoso, como la formación de un hematoma y el fracaso de la extracción. Un endoscopista experimentado puede percibir fácilmente la sutileza e instruir a la enfermera de endoscopia asistente para que ajuste la firmeza adecuada del agarre al tirar del asa.
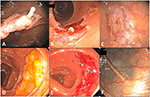
Figura 2. Polipectomías del SME. (A) Pseudotallo submucoso tras polipectomía de un adenoma tubular cecal sésil de 10 mm. (B) Un trozo intacto de mucosa con pólipo después de la extirpación (arriba a la derecha) y el lugar de la polipectomía libre de pólipos con pseudotallo visible (abajo a la izquierda). (C) Un lugar de polipectomía limpio y sin deformidades, a pesar de una pequeña exudación capilar transitoria inmediatamente después de la polipectomía. El levantamiento de la mucosa atrapada impidió el desarrollo del seudotallo. (D) Un adenoma serrado sésil de 30 mm en el colon transverso. (E) Lugar de la polipectomía de (D) después de la polipectomía fragmentada. (F) El mismo lugar de polipectomía tatuado que (E) 1 año después.
Aunque el atrapamiento submucoso puede evitarse en el caso de pólipos pequeños colocando el asa de forma óptima y levantando el pólipo con suavidad, esto puede resultar inevitable con la extirpación de pólipos más grandes. Aunque la técnica descrita anteriormente sigue siendo válida, la submucosa atrapada a menudo impide la separación del asa del lugar de la polipectomía, incluso después de que la mucosa que contiene el pólipo haya sido despojada. En tales circunstancias, no es necesario seguir tirando del asa por la fuerza bruta. En cambio, si se abre ligeramente el asa y se desliza sobre la submucosa atrapada, se liberará el asa y cualquier mucosa que contenga pólipos y que haya sido despojada, pero que aún parezca estar adherida al lugar de la polipectomía. La submucosa atrapada de estos pólipos más grandes con frecuencia forma un seudotallo más grueso, pero la lesión de la submucosa sigue siendo mínima.
Para los pólipos aún más grandes que no se pueden eliminar en una sola pieza, se puede realizar la polipectomía por partes de EMS. Dado que la ausencia de lesiones submucosas de la EMS crea un lugar de polipectomía menos sangrante o deformado en comparación con la polipectomía tradicional con asa fría o caliente, cualquier tejido de pólipo residual se visualiza mejor, facilitando la extirpación completa de los pólipos (figura 2).
Evaluación de resultados
1. Tasas de hemorragia postpolipectomía que requiere hospitalización de todos los pólipos de colon no pediculados antes y después de la adopción de la EMS.
2. Exhaustividad de la extirpación de pólipos con EMS determinada por la biopsia del lugar de la polipectomía y el examen durante la colonoscopia de seguimiento a intervalos recomendados por las directrices de la sociedad nacional (13, 14).
Examen de colonoscopia
Las colonoscopias se realizaron utilizando colonoscopios de rigidez variable (PCF 160, CF 160, PCF 180 y CF 180; Olympus Corp. Tokio, Japón) para la mayoría de los casos y colonoscopios de espectro completo FUSE (EndoChoice, Alpharetta, Georgia) para unos pocos casos como parte de un ensayo. Las polipectomías se realizaron utilizando principalmente asas ovaladas (100600 a 100602, ConMed, Utica, NY) y, en unos pocos casos, asas en espiral (SD-230U-20, Olympus Corp, Tokio, Japón) y asas Exacto (BX00711115, US Endoscopy, Mentor, OH).
Como parte de la medición de la calidad del MNGI, se informaron las siguientes estadísticas anuales de colonoscopia para ZJC para 2014 y 2016: tasa de alcance del ciego del 99,5-100%, tasas de detección de pólipos adenomatosos por colonoscopia de cribado del 50,3-60,1% para los hombres y del 42.1-54,0% para las mujeres.
Análisis estadístico
El análisis estadístico se realizó mediante la prueba exacta de Fisher.
Resultados
El EMS evitó el sangrado postpolipectomía que requería hospitalización
Un total de 5.142 colonoscopias con polipectomía con asa realizadas por ZJC en los centros de endoscopia ambulatoria del MNGI durante 12 años se dividieron en la era pre-EMS (2005-2012, n = 2973) y la era EMS (2013-2016, n = 2169) (Tabla 1). La última hemorragia postpolipectomía que requirió hospitalización ocurrió en septiembre de 2012. No se encontró ninguna durante la era EMS (tasa 0%) mientras que se encontraron diez (incluyendo 2 pólipos pedunculados) durante la era pre-EMS (tasa 0,336%). La hospitalización se produjo entre 1 y 16 días después de las colonoscopias. Esta diferencia fue estadísticamente significativa (P = 0,0055) y siguió siéndolo tras excluir los 2 casos de pólipos pediculados (P = 0,012).
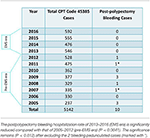
Tabla 1. Casos de hemorragia postpolipectomía y casos de polipectomía total con asa (código CPT #45385) en 12 años.
De los 12 casos de hemorragia, se extrajeron un total de 18 pólipos. A excepción de dos adenomas tubulares (AT) de 2-3 mm que se extirparon con un asa fría, todos se extirparon con un asa caliente. Entre ellos había diez AT de 8-40 mm (incluidos dos pólipos pedunculados de 11-15 mm y 36-40 mm, respectivamente), un adenoma tubulovelloso (TVA) de 25 mm, cuatro adenomas dentados sésiles (SSA) de 6-10 mm y un lipoma de 5 mm. A excepción de un caso en el que sólo se recuperó parcialmente el pólipo resecado y que no presentaba submucosa al microscopio, los nueve casos restantes mostraban evidencia de submucosa cauterizada, a menudo con vasos sanguíneos visibles cerca del borde cauterizado, como se ilustra en la figura 3C. Estos hallazgos indican que el daño de la submucosa durante la polipectomía con asa caliente contribuyó a la hemorragia postpolipectomía.
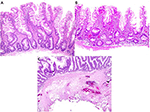
Figura 3. Comparación histopatológica de pólipos avanzados extirpados con EMS y polipectomía con asa caliente. (A,B) Los pólipos extirpados con EMS suelen mostrar un aspecto profundo de la muscularis mucosa con escasez de submucosa y ausencia de vasos sanguíneos. (C) Un pólipo extirpado con asa caliente muestra la cantidad típica de submucosa con daño tisular causado por el cauterio.
Para comparar, también examinamos microscópicamente 20 casos consecutivos de pólipos de colon avanzados extirpados con EMS. Estos pólipos sólo contenían una cantidad variable de mucosa muscular y una submucosa escasa o nula, sin vasos sanguíneos (Tabla 2, Figuras 3A,B). Estos resultados indican que la EMS previno la hemorragia postpolipectomía al evitar el daño de la submucosa.
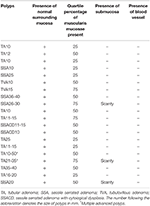
Tabla 2. Características de 20 casos consecutivos de pólipos de colon avanzados extirpados mediante EMS.
Polipectomía completa facilitada por EMS
Se realizaron biopsias extensas en el borde (x4) y en el pseudotallo (x1) de 10 sitios de pólipos avanzados seleccionados al azar después de la extirpación completa endoscópica por EMS. No se encontró ningún residuo de pólipo en ninguna muestra. Se realizó un seguimiento de 97 sitios de polipectomía neoplásica por EMS desde los 6 meses hasta los 4 años, incluyendo 38 sitios de polipectomía en 23 pacientes tras la extirpación de pólipos avanzados. Ninguna de las 59 localizaciones de pólipos neoplásicos no avanzados (< 10 mm y sin características avanzadas) tuvo pólipos residuales o recurrentes en la colonoscopia de seguimiento. La gran mayoría (33 de 38; 87%) de las localizaciones de pólipos avanzados tampoco presentaron pólipos en la colonoscopia de seguimiento (Tabla 3). Se encontraron dos pólipos pequeños cerca del pólipo nº 12 un año después, pero eran de un tipo diferente al original (SSA frente a TA). En el caso de los pólipos nº 13, nº 22 y nº 25, aunque en las colonoscopias de seguimiento realizadas entre 1 y 3,5 años después se encontró un pólipo pequeño (2-5 mm) del mismo tipo (TA) cerca del lugar de la polipectomía original en cada caso, fue difícil determinar si los pólipos eran de nueva formación o residuos, ya que todos ellos se produjeron en casos de poliposis con 24, 10 y 14 pólipos adenomatosos extirpados en las colonoscopias iniciales y de seguimiento combinadas, respectivamente. También se descubrió un tipo diferente de pólipos pequeños (SSA en lugar de TA) cerca de los lugares de polipectomía originales del pólipo nº 13 y nº 25 en la colonoscopia de seguimiento, lo que sugiere un nuevo crecimiento del pólipo en lugar de una polipectomía incompleta. Se encontró un SSA de 10 mm 14 meses después detrás de un pliegue cerca del lugar de polipectomía tatuado del SSA plano de 50 mm (nº 26). Esto podría representar una polipectomía incompleta, posiblemente debido al tamaño extragrande del pólipo original, pero también podría representar un pólipo separado en aumento que se pasó por alto en la colonoscopia original debido a su ubicación muy oculta detrás de un pliegue que se ve mejor en la retroflexión (Figura 4). Así pues, ni un solo caso convincente y como máximo 4/97 (4,1%) de todos los pólipos neoplásicos seguidos o 4/38 (10,5%) de los pólipos avanzados extirpados mediante EMS tenían una polipectomía incompleta. Estas tasas se comparan muy favorablemente con las comunicadas para las técnicas tradicionales de polipectomía con asa (18).
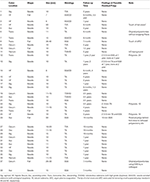
Tabla 3. Seguimiento de 38 pólipos de colon avanzados extirpados mediante EMS en 23 pacientes.
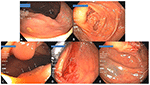
Figura 4. (A) Un gran adenoma serrado sésil de 50 mm (Pólipo#26 en la Tabla 3) en colon ascendente proximal con VCI visible en el fondo (flecha). (B) Vista general del lugar de la polipectomía 14 meses después con uno de los tatuajes visible a la derecha (flechas). (C) Un SSA de 10 mm oculto tras un pliegue (flechas) cerca del lugar de la polipectomía. (D) Sitio de polipectomía del pólipo en (C) en vista de retroflexión. (E) Espacio relativo de uno de los tatuajes (abajo a la izquierda) y el pliegue tras el que se escondía el pólipo de (C) (flecha).
Discusión
Nuestros análisis de datos confirman que la EMS evitó la hemorragia postpolipectomía y facilitó la eliminación completa del pólipo en comparación con las técnicas tradicionales de polipectomía con asa. Por tanto, la EMS podría hacer que la colonoscopia fuera más segura y eficaz como herramienta de prevención del cáncer de colon.
Las complicaciones de la colonoscopia, como la hemorragia postpolipectomía y la perforación, se producen debido a la lesión de la submucosa y los tejidos más profundos. Estas lesiones no son necesarias para extirpar pólipos de colon precancerosos y deben evitarse.
La submucosa es rica en tejido conectivo y vasos sanguíneos. Su atrapamiento se produce a menudo durante la polipectomía con asa que impide el cierre completo del asa sin guillotina de fuerza bruta o coagulación por calor. La técnica TCSP para guillotinar todo el tejido atrapado daña la submucosa atrapada, aunque en menor medida en comparación con la técnica de asa caliente (39). El aumento de la tasa de hemorragia inmediata con la TCSP, que requiere una intervención hemostática como el recorte, no sólo podría perjudicar la detección de los residuos de pólipos, sino que también restringe su aplicación a los pólipos de mayor tamaño (39-42). Al evitar el corte de la submucosa por completo, la EMS previene la hemorragia inmediata y retardada y parece ser segura para los pólipos de mayor tamaño, incluso sin interrumpir los tratamientos anticoagulantes y antiplaquetarios (figura 5).

Figura 5. (A) Adenoma serrado sésil de colon transversal de 15 mm con displasia citológica (Pólipo#7 en la Tabla 3). (B) Zona de polipectomía inmediatamente después de la extirpación del pólipo en (A). (C) El mismo sitio de polipectomía que (B) 6 meses después. Este paciente no suspendió el Clopidogrel en el momento de la polipectomía. Con el perfil de seguridad de la EMS, se tomó la decisión de proceder a la polipectomía teniendo en cuenta que podría ser difícil repetir la colonoscopia debido a su avanzada edad (le faltan 4 meses para cumplir los 80 años) y a un colon largo y tortuoso con estreñimiento. Finalmente se le realizó una colonoscopia 6 meses después para la histopatología de alto riesgo del pólipo.
Una preocupación potencial es la completitud de la polipectomía de EMS, especialmente en el pseudotallo. Los datos de nuestra biopsia en el lugar de la polipectomía y el análisis de otros sobre el pseudotallo después de la polipectomía con asa fría (43) mostraron una eliminación completa del pólipo. Esto se ve respaldado por la frecuencia con la que detectamos posibles pólipos residuales en los lugares de polipectomía de la EMS durante la colonoscopia de seguimiento (probablemente el 0% y como máximo el 4,1% de todos los pólipos neoplásicos o el 10,5% de los pólipos avanzados), que es mucho más baja que la comunicada anteriormente (18). Basándose en muestreos de los bordes de las polipectomías endoscópicamente «completas», Pohl et al observaron neoplasias inesperadamente persistentes en el 10,1% de todas las polipectomías, el 17,3% de los pólipos neoplásicos de 10-20 mm, tasas mayores para los SSA que para los AT (31 frente a 7,2%), y el 47,6% de todos los SSA grandes (10-20 mm) fueron extirpados de forma incompleta (18). Zhang et al. informaron de forma similar de una extirpación incompleta de pólipos (6-9 mm) (8,5% de media y 13% en el caso de la resección fragmentaria), con una hemorragia inmediata que requería un recorte con una tasa de 1,8 y 2,7% por pólipo y por paciente, respectivamente (40). Una explicación probable de la diferencia es que los lugares de polipectomía EMS fueron menos traumáticos, con una hemorragia o una deformación mínimas, en comparación con los de la polipectomía tradicional con asa fría o caliente. Esto no sólo facilitó la detección y la eliminación de los residuos de pólipos, sino que también permitió una resección más generosa de la mucosa sin preocuparse por la hemorragia y otras complicaciones. La polipectomía completa es importante para prevenir los cánceres de colon de intervalo, que representan entre el 2,6 y el 9,0% del total de los cánceres de colon (19).
Los pólipos pediculados pueden tener un alto riesgo de hemorragia postpolipectomía porque la lesión de la submucosa es inevitable. El aumento de la experiencia puede haber conducido a una reducción de la hemorragia de estos pólipos poco frecuentes, ya que la ZJC desplazó el corte lejos de la pared del colon y cerca del pólipo en el tallo. Pero la reducción de la hemorragia postpolipectomía de los pólipos pediculados antes y después de la EMS no fue estadísticamente significativa. Creemos que la EMS, más que la ganancia de experiencia, condujo a la eliminación de la hemorragia postpolectomía de los pólipos no pedunculados.
Raramente podría desarrollarse un hematoma a partir de un vaso submucoso desgarrado durante la EMS de pólipos grandes. Sin embargo, la submucosa intacta evita que cualquier hematoma se agrande y se desangre. En nuestra experiencia, la barrera natural proporcionada por la submucosa intacta parece ser superior a la coagulación proporcionada por el asa caliente en la prevención de la hemorragia tardía postpolipectomía.
En comparación con la REM, la EMS es mucho más fácil de realizar y puede lograr el mismo resultado de polipectomía incluso para algunas lesiones grandes de extensión lateral (Tabla 3) sin recursos adicionales y con un riesgo de hemorragia mucho menor. Se necesitan más estudios para comparar directamente la EMS y la REM, especialmente para la extirpación de pólipos grandes.
Debido a que la EMS sólo extirpa la mucosa, cualquier cáncer temprano con invasión submucosa está fuera de su alcance. Cabe destacar que nos encontramos con un caso de un pólipo sésil de colon canceroso de 10 mm no sospechado durante el período de estudio. Curiosamente, el lugar de la polipectomía siguió supurando y requirió un hemoclip. El diagnóstico sólo se obtuvo tras la extirpación del pólipo y el paciente fue remitido posteriormente a cirugía sin incidencia. El diagnóstico del patrón de fosetas ampliado puede haber sido útil en un prediagnóstico en este caso y siempre se recomienda un examen cuidadoso del pólipo antes de la EMS para evitar cortar el pólipo canceroso. Sin embargo, en este caso no se produjo ningún resultado adverso.
La EMS puede realizarse con asas en espiral o Exacto y en combinación con la inyección submucosa para la elevación de la mucosa, la coagulación con plasma de argón o la ablación con punta de asa caliente. Queda por ver si mejoran aún más la eficacia de la EMS.
La EMS ha sido adoptada con éxito por bastantes colegas de la MNGI (Tabla 3, #37-38), pero la generalización de sus beneficios necesita más estudios de confirmación. No obstante, esta innovación relativamente sencilla pero eficaz en la técnica de polipectomía podría representar una nueva frontera para una prevención más segura y eficaz del cáncer de colon por colonoscopia.
Declaración ética
Este estudio retrospectivo recibió la exención de la determinación de revisión del CEI el 12 de mayo de 2016 (ID del CEI: 5502) por parte del CEI Sterling (www.sterlingirb.com) y se llevó a cabo de acuerdo con el protocolo aprobado de Revisión clínica e histopatológica de la extirpación de la mucosa como innovación técnica de la polipectomía por colonoscopia y las recomendaciones del Comité de Calidad de Gastroenterología de Minnesota. Todos los sujetos dieron su consentimiento informado por escrito para los procedimientos de colonoscopia y el tratamiento de acuerdo con la Declaración de Helsinki.
Contribuciones de los autores
ZC inició el concepto y el diseño de la investigación, la adquisición, el análisis y la interpretación de los datos, la redacción y la revisión del manuscrito. KB participó en la adquisición, el análisis y la interpretación de los datos, así como en la revisión crítica del manuscrito.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Agradecimientos
Damos las gracias al doctor Douglas Nelson, al doctor Robert Ganz, al doctor John Allen, al doctor David Lieberman, al doctor Douglas Rex, a la doctora Linda Rabeneck, al doctor Aasma Shaukat, al doctor Zong-ming Eric Chen, al doctor Jeffrey Rank, al doctor Joshua Colton y al doctor Cecil Chally por su revisión crítica y sus útiles sugerencias, Zengri Wang y Yongquan Xue PhD por su asistencia en el análisis estadístico, Brian Hardwig por su ayuda en la preparación de la grabación de vídeo, Carlie Leyde, Amy Lounsbury, Martha Carland, JaNelle Gorg, Siri McCord, Karen Lang y Marit Brock por su asistencia administrativa. También agradecemos a las enfermeras de endoscopia de Minnesota Gastroenterology por la asistencia en la polipectomía EMS.
Un póster de los resultados preliminares de esta investigación se presentó en la DDW 2017 en Chicago, Estados Unidos. Un resumen del póster se publicó en Gastrointestinal Endoscopy 2017; 85:AB520.
Material complementario
El material complementario de este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fmed.2018.00312/full#supplementary-material
Abreviaturas
EMS, extracción endoscópica de la mucosa; EMR, resección endoscópica de la mucosa; ESD, disección endoscópica de la submucosa; TCSP, polipectomía tradicional con asa fría; AT: adenoma tubular; TVA(HD): adenoma tubulovelloso (con displasia de alto grado); SSA(CD): adenoma serrado sésil (con displasia citológica); CU: colitis ulcerosa.
1. Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevención del cáncer colorrectal mediante polipectomía colonoscópica. The national polyp study workgroup. N Engl J Med. (1993) 329:1977-81. doi: 10.1056/NEJM199312303292701
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Zauber AG, Winawer SJ, O’Brien MJ, Lansdorp-Vogelaar I, van Ballegooijen M, Hankey BF, et al. Polipectomía colonoscópica y prevención a largo plazo de las muertes por cáncer colorrectal. N Engl J Med. (2012) 366:687-96. doi: 10.1056/NEJMoa1100370
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Nishihara R, Wu K, Lochhead P, Morikawa T, Liao X, Qian ZR, et al. Incidencia y mortalidad a largo plazo por cáncer colorrectal tras endoscopia inferior. N Engl J Med. (2013) 369:1095-105. doi: 10.1056/NEJMoa1301969
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Amri R, Bordeianou LG, Sylla P, Berger DL. Impacto de la colonoscopia de cribado en los resultados de la cirugía del cáncer de colon. JAMA Surg. (2013) 148:747-54. doi: 10.1001/jamasurg.2013.8
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Brenner H, Stock C, Hoffmeister M. Efecto de la sigmoidoscopia de cribado y la colonoscopia de cribado en la incidencia y la mortalidad por cáncer colorrectal: revisión sistemática y metanálisis de ensayos controlados aleatorios y estudios observacionales. BMJ (2014) 348:g2467-78. doi: 10.1136/bmj.g2467
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Sonnenberg A, Delcò F, Inadomi JM. Coste-efectividad de la colonoscopia en el cribado del cáncer colorrectal. Ann Intern Med. (2000) 133:573-84. doi: 10.7326/0003-4819-133-8-200010170-00007
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Cost-effectiveness of colorectal cancer screening. Epidemiol Rev. (2011) 33:88-100. doi: 10.1093/epirev/mxr004
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Lieberman DA Screening for colorectal cancer in individuals at average risk: current methods and emerging issues. JAMA Intern Med. (2014) 174:10-11. doi: 10.1001/jamainternmed.2013.11499
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Barclay RL, Vicari JJ, Doughty AS, Johanson JF, Greenlaw RL. Tiempos de retirada colonoscópica y detección de adenomas durante la colonoscopia de cribado. N Engl J Med. (2006) 355:2533-41. doi: 10.1056/NEJMoa055498
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Kaminski MF, Regula J, Kraszewska E, Polkowski M, Wojciechowska U, Didkowska J, et al. Indicadores de calidad para la colonoscopia y el riesgo de cáncer de intervalo. N Engl J Med. (2010) 362:1795-803. doi: 10.1056/NEJMoa0907667
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Corley DA, Jensen CD, Marks AR, Zhao WK, Lee JK, Doubeni CA, et al. Tasa de detección de adenomas y riesgo de cáncer colorrectal y muerte. N Engl J Med. (2014) 370:1298-306. doi: 10.1056/NEJMoa1309086
CrossRef Full Text | Google Scholar
12. van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Tasa de pérdida de pólipos determinada por colonoscopia en tándem: una revisión sistemática. Am J Gastroenterol. (2006) 101:343-50. doi: 10.1111/j.1572-0241.2006.00390.x
CrossRef Full Text | Google Scholar
13. Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Directrices para la vigilancia de la colonoscopia después del cribado y la polipectomía: una actualización de consenso por el grupo de trabajo multisociedad de Estados Unidos sobre el cáncer colorrectal. Gastroenterology (2012) 143:844-57. doi: 10.1053/j.gastro.2012.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB, et al. Quality indicators for colonoscopy. Gastrointest Endosc. (2015) 81:31-53. doi: 10.1016/j.gie.2014.07.058
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Waye JD, Lewis BS, Yessayan S. Colonoscopy: a prospective report of complications. J Clin Gastroenterol. (1992) 15:347-51. doi: 10.1097/00004836-199212000-00018
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ko CW, Dominitz JA. Ko CW, Dominitz JA. Complicaciones de la colonoscopia: magnitud y manejo. Gastrointest Endosc Clin N Am. (2010) 20:659-71. doi: 10.1016/j.giec.2010.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
17. ASGE Standards of Practice Committee, Fisher, DA, Maple, JT, Ben-Menachem, T, Cash, BD, Decker, GA, et al. Complications of colonoscopy. Gastrointest Endosc. (2011) 74:745-52. doi: 10.1016/j.gie.2011.07.025
CrossRef Full Text | Google Scholar
18. Pohl H, Srivastava A, Bensen SP, Anderson P, Rothstein RI, Gordon SR, et al. Resección incompleta de pólipos durante la colonoscopia: resultados del estudio de resección completa de adenomas (CARE). Gastroenterology (2013) 144:74-80. doi: 10.1053/j.gastro.2012.09.043
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Adler J, Robertson DJ. Cáncer colorrectal de intervalo después de la colonoscopia: explorando explicaciones y soluciones. Am J Gastroenterol. (2015) 110:1657-64. doi: 10.1038/ajg.2015.365
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Ranasinghe I, Parzynski CS, Searfoss R, Montague J, Lin Z, Allen J, et al. Diferencias en la calidad de la colonoscopia entre los centros: desarrollo de una tasa estandarizada de riesgo postcolonoscopia de visitas hospitalarias no planificadas. Gastroenterology (2016) 150:103-13. doi: 10.1053/j.gastro.2015.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Rosen L, Bub DS, Reed JF, Nastasee SA. Hemorragia tras polipectomía colonoscópica. Dis Colon Rectum. (1993) 36:1126-31. doi: 10.1007/BF02052261
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Gibbs DH, Opelka FG, Beck DE, Hicks TC, Timmcke AE, Gathright JB. Postpolypectomy colonic hemorrhage. Dis Colon Rectum. (1996) 39:806-10. doi: 10.1007/BF02054448
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sorbi D, Norton I, Conio M, Balm R, Zinsmeister A, Gostout CJ. Postpolypectomy lower GI bleeding: descriptive analysis. Gastrointest Endosc. (2000) 51:690-6. doi: 10.1067/mge.2000.105773
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, et al. Complicaciones de la colonoscopia en un sistema integrado de prestación de servicios de salud. Ann Intern Med. (2006) 145:880-6. doi: 10.7326/0003-4819-145-12-200612190-00004
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Tolliver KA, Rex DK. Polipectomía colonoscópica. Gastroenterol Clin North Am. (2008) 37:229-51, ix. doi: 10.1016/j.gtc.2007.12.009
PubMed Abstract |CrossRef Full Text | Google Scholar
26. Rabeneck L., Paszat, M. Rabeneck L, Paszat LF, Hilsden RJ, Saskin R, Leddin D, Grunfeld E, et al. Sangrado y perforación después de una colonoscopia ambulatoria y sus factores de riesgo en la práctica clínica habitual. Gastroenterology (2008) 135:1899-906. doi: 10.1053/j.gastro.2008.08.058
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, et al. Eventos adversos después de la colonoscopia ambulatoria en la población de Medicare. Ann Intern Med. (2009) 150:849-57. doi: 10.7326/0003-4819-150-12-200906160-00008
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. Factores de riesgo de hemorragia severa postpolipectomía retardada. Endoscopy (2008) 40:115-9. doi: 10.1055/s-2007-966959
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. Factores que predicen la hemorragia tras la resección endoscópica de la mucosa de grandes lesiones colónicas. Endoscopy (2011) 43:506-11. doi: 10.1055/s-0030-1256346
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Bahin FF, Rasouli KN, Byth K, Hourigan LF, Singh R, Brown GJ, et al. Predicción de la hemorragia clínica significativa tras la resección endoscópica de campo amplio de grandes lesiones colorrectales sésiles y de extensión lateral: una puntuación de riesgo clínico. Am J Gastroenterol. (2016) 111:1115-22. doi: 10.1038/ajg.2016.235
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Albéniz E, Fraile M, Ibáñez B, Alonso-Aguirre P, Martínez-Ares D, Soto S, et al. Un sistema de puntuación para determinar el riesgo de hemorragia tardía tras la resección endoscópica de la mucosa de grandes lesiones colorrectales. Clin Gastroenterol Hepatol. (2016) 14:1140-7. doi: 10.1016/j.cgh.2016.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Wolff WI, Shinya H. Early diagnosis of cancer of the colon through colonic endoscopy (colonoscopy). Cancer (1974) 34:912-34.
Google Scholar
33. Tedesco FJ. Colonoscopic polypectomy. En: Silvia SE, editor. Therapeutic Gastrointestinal Endoscopy (1984) New York, NY: Igaku-Shoin. p. 269-88.
Google Scholar
34. Waye JD. Polipectomía-principios básicos. En: Waye JD, Rex DK, Williams CB, editores. Colonoscopy Principles and Practice. Malden, MA; Oxford: Carlton (2003) p. 410-9. doi: 10.1002/9780470986943.ch35
CrossRef Full Text | Google Scholar
35. Waye JD. Polipectomía: principios básicos. En: Waye JD, Rex DK, Williams CB, editores. Colonoscopy Principles and Practice. Oxford; Hoboken, NJ: Wiley-Blackwell (2009) p. 572-81.
Google Scholar
36. Meeroff JC. Extirpación de pólipos sésiles colónicos de tamaño medio sin diatermia. Gastrointest Endosc. (1989) 35:136. doi: 10.1016/S0016-5107(89)72740-1
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Tappero G, Gaia E, De Giuli P, Martini S, Gubetta L, Emanuelli G. Cold snare excision of small colorectal polyps. Gastrointest Endosc. (1992) 38:310-3. doi: 10.1016/S0016-5107(92)70422-2
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Chen ZJ., Batts K. P. (2017). Mo2011 eliminación de la hemorragia post-polipectomía y una eliminación más completa de los pólipos con la extirpación endoscópica de la mucosa (EMS). Gastroenterol. Endos. 85(Suppl. 5):AB520. Abstract Mo2011. doi: 10.1016/j.gie.2017.03.1198
CrossRef Full Text | Google Scholar
39. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. Remoción de pólipos colorrectales pequeños en pacientes anticoagulados: una comparación prospectiva aleatoria de la polipectomía con trampa fría y la polipectomía convencional. Gastrointest Endosc. (2014) 79:417-23. doi: 10.1016/j.gie.2013.08.040
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Zhang Q, Gao P, Han B, Xu J, Shen Y. Polipectomía para la resección endoscópica completa de pequeños pólipos colorrectales. Gastrointest Endosc. (2017). 87(3):733-740. doi: 10.1016/j.gie.2017.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Paspatis GA, Tribonias G, Konstantinidis K, Theodoropoulou A, Vardas E, Voudoukis E, et al. A prospective randomized comparison of cold vs hot snare polypectomy in the occurrence of postpolectomy bleeding in small colonic polyps. Colorectal Dis. (2011) 13:e345-8. doi: 10.1111/j.1463-1318.2011.02696.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Repici A, Hassan C, Vitetta E, Ferrara E, Manes G, Gullotti G, et al. Seguridad de la polipectomía en frío para < pólipos de 10 mm en la colonoscopia: un estudio prospectivo multicéntrico. Endoscopy. (2012) 44:27-31. doi: 10.1055/s-0031-1291387
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Tutticci N, Burgess NG, Pellise M, Mcleod D, Bourke MJ. Characterization and significance of protrusions in the mucosal defect after cold snare polypectomy. Gastrointest Endosc. (2015) 82:523-8. doi: 10.1016/j.gie.2015.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar