- Introducción
- La naturaleza de los riesgos de IED en la neurofisiología IEEG humana
- Estrategias para el manejo de DEI
- Prácticas actuales entre los investigadores de IEEG
- Consideraciones adicionales
- Conclusiones
- Declaración de disponibilidad de datos
- Declaración de ética
- Contribuciones de los autores
- Financiación
- Conflicto de intereses
- Agradecimientos
Introducción
La electroencefalografía intracraneal (EIE) supera muchos límites físicos de la electroencefalografía (EEG) del cuero cabelludo y la magnetoencefalografía (MEG) al registrar las señales directamente del tejido cerebral. Los rápidos avances en el procesamiento informático de las últimas décadas han ampliado las capacidades del software y el hardware, lo que ha permitido realizar registros simultáneos de cientos de sitios intracraneales con una precisión de microsegundos. Estos aumentos en la resolución temporal y espacial han mejorado la precisión diagnóstica para la localización de las convulsiones (Andrews et al., 2019; Cuello Oderiz et al., 2019) y han llevado a una aceleración de la investigación en neurofisiología intracraneal humana (Chang, 2015; Parvizi y Kastner, 2018).
Junto con las herramientas computacionales emergentes y las capacidades para el análisis masivo de conjuntos de datos, la riqueza de las oportunidades neurocientíficas y los descubrimientos potenciales son prometedores. Sin embargo, el análisis de la señal en las grabaciones intracraneales humanas conlleva escollos inherentes que presumiblemente se abordan pero que se reconocen mínimamente en muchos estudios neurofisiológicos de pacientes humanos, a saber, las descargas epileptiformes interictales (DEI). Las DEI son ráfagas transitorias de actividad producidas por grupos de neuronas que están patológicamente conectadas debido a la epilepsia, lo que da lugar a formas de onda distintas y prominentes durante los registros de EEG (Figura 1A). Esta Perspectiva llamará la atención sobre los peligros de los IED, los efectos potenciales en las estrategias de análisis comunes y describirá las estrategias comunes para evitarlos, de modo que la creciente ola de descubrimientos en neurofisiología humana siga avanzando, esperemos que sin pasos en falso.
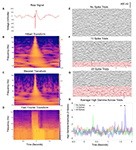
Figura 1. Contaminación de datos relacionados con las descargas epileptiformes interictales (DEI). (A) Ejemplo de una DEI de un solo canal durante un registro de electroencefalografía intracraneal (EEG) de 2 segundos. Las características clásicas son evidentes, incluyendo un desplazamiento de voltaje agudo y de gran amplitud y una onda lenta posterior, por lo demás con una mezcla relativamente normal de frecuencias de base antes y después. (B) Espectrograma por transformada de Hilbert de los datos de (A). Obsérvese el aumento transitorio pero sustancial de la potencia en casi todas las frecuencias, debido al componente agudo de la forma de onda, y un sutil aumento sostenido de la potencia en las frecuencias bajas relacionado con la onda lenta posterior. (C) Espectrograma por transformada de ondas de los datos de (A), con resultados similares a los de (B). (D) Transformada de Fourier de A (Mitra y Bokil, 2007; Chronux Home, 2019) con ventanas superpuestas de 0,25 s, deslizándose punto por punto para proporcionar una resolución temporal similar a la de (B,C). Resultados similares a los de (B,C), con una duración adicional del aumento de potencia en las frecuencias más rápidas debido a la naturaleza de la ventana de tiempo consistente a través de las frecuencias para el cálculo de la FFT. Los paneles (E-G) muestran cada uno los datos de IEEG de 50 ensayos, registrados desde un solo canal durante una tarea de escucha del habla (una frase pregrabada reproducida en voz alta para cada ensayo comenzando en el tiempo cero). En el panel (F), se intercambiaron 10 ensayos con ensayos que contenían IEDs, mostrados en rojo. Se utilizó un híbrido de enfoques manuales y automatizados (Baud et al., 2018). El panel (G) aumenta esto a 20 ensayos con IEDs. El panel (H) muestra el promedio de gamma alto a través de ensayos en cada grupo (transformada de Hilbert, 50-200 Hz) de un electrodo que contacta con la circunvolución temporal inferior que no fue realmente modulado por la tarea de escucha de frases. Los asteriscos denotan puntos de tiempo durante los cuales uno de los últimos grupos se desvía significativamente de la línea de base (ANOVA de dos medidas repetidas, p < 0,05). A medida que aumenta la proporción de ensayos con IED, surgen puntos temporales adicionales falsamente positivos.
La naturaleza de los riesgos de IED en la neurofisiología IEEG humana
El quid de nuestra opinión es que el paradigma de la neurofisiología intracraneal humana expone a los científicos bien intencionados a riesgos de resultados erróneos debido a dos factores principales:
(1) Los electrodos se implantan en regiones del cerebro humano que se consideran susceptibles de revelar las firmas neurofisiológicas de la epilepsia tanto en contextos ictales como interictales-que suelen ser formas de onda agudas de gran amplitud.
(2) Los análisis de procesamiento de señales que se utilizan comúnmente para la neurofisiología humana son exquisitamente sensibles a las formas de onda agudas de gran amplitud descritas en el punto 1, que causan resultados espurios.
Por lo tanto, los conjuntos de datos de IEEG contienen comúnmente firmas eléctricas de epilepsia que transmiten el riesgo de resultados distorsionados cuando se incluyen en los análisis de señales comunes, tales como las medidas de potencia y coherencia, y los métodos relacionados, tales como la co-modulación de potencia-fase (Kramer et al., 2008). Una forma de tener en cuenta este problema es que muchos métodos de procesamiento de señales neuronales, como los análisis basados en Fourier, Wavelet y Hilbert, asumen un sustrato de datos sinusoidal (van Drongelen, 2018). Por lo tanto, la convolución de ondas de gran amplitud o desviaciones bruscas (de gran o incluso pequeña amplitud) predispone a representaciones de muchas frecuencias que pueden ser en gran medida espurias, ya que muchas funciones sinusoidales consecutivas pueden ajustarse a estos elementos de la forma de onda. En las Figuras 1B-D, mostramos ejemplos de cómo las DEIs pueden fácilmente representar erróneamente las señales neurofisiológicas de esta manera a través de los métodos espectrales comúnmente utilizados de las transformadas de Hilbert, Wavelet y Fourier. En las bandas de frecuencia más bajas, tanto los componentes de ondas agudas como de ondas lentas de los DEI pueden inducir un aumento de potencia en cualquier frecuencia que se ajuste a estas características. En las bandas de frecuencias más altas, este llamativo estallido de potencia a través de vastos tramos de niveles de frecuencia continuos se hace aún más evidente y puede denominarse timbre o fuga espectral (Scheffer-Teixeira et al., 2013). Esto puede ser evidente en toda la banda gamma alta (50-200 Hz u otro rango similar), una cuestión preocupante dado que muchos laboratorios de neurofisiología utilizan la actividad gamma alta dado su valor potencial como sustituto de la actividad neural local (Ray et al., 2008). El ejemplo de la Figura 1H demuestra cómo la inclusión acumulativa (Figuras 1E-G) de ensayos con picos añade una variabilidad espuria (arriesgándose a un falso negativo) o influye de otro modo en la significación estadística (arriesgándose a un falso positivo).
Este problema podría ser más generalizado que en las grabaciones de EEG o MEG debido al contacto directo con el tejido neural, que puede transmitir amplitudes de picos más grandes y desviaciones más agudas, particularmente en el caso de los IED, contaminando los análisis neurofisiológicos. Además, los electrodos intracraneales se colocan específicamente en regiones que probablemente estén clínicamente asociadas con el foco de la crisis epiléptica, lo que conduce a IEDs fuertes y/o frecuentes en algunos conjuntos de datos de IEEG.
Anecdóticamente, la mayoría de los investigadores en neurofisiología humana estarían de acuerdo en que la contaminación de datos por IEDs es de conocimiento común, aunque el impacto de esto puede variar para ciertos tipos de análisis (Meisler et al., 2019). De hecho, uno podría anticipar que muchos laboratorios de investigación tienen estrategias para eludir, o al menos minimizar este problema. Sin embargo, cuando se evalúa en la práctica, este problema y sus posibles ramificaciones pueden ser mucho más generalizados de lo previsto. Un tercer factor de complicación puede ilustrar cómo puede ser esto:
(3) Los investigadores de neurofisiología (especialmente los que están en fase de formación, como los estudiantes y los investigadores postdoctorales) pueden no recibir una formación directa en la identificación de DEI o artefactos eléctricos. Además, es posible que el espectro de posibles morfologías de DEI y la forma en que sus características distintivas pueden contaminar los análisis de señales no estén arraigadas en la formación estándar.
Como complicación adicional, la concordancia entre evaluadores para la detección de DEI es sorprendentemente pobre, incluso entre epileptólogos plenamente capacitados (Barkmeier et al., 2012; Janca et al., 2015).
Estrategias para el manejo de DEI
Hay una variedad de enfoques cuando se encuentran DEI en los datos, que pueden o no depender de su tasa y extensión espacial (por ejemplo, un investigador puede no estar inclinado a curar y «limpiar» un conjunto de datos para un pico por minuto pero sí para 10 picos por minuto). Destilamos los posibles enfoques de los investigadores en cuatro estrategias principales. La primera consiste en identificar y eliminar manualmente cualquier ensayo o período durante el cual se produzcan IED, lo que se denomina aquí estrategia 1. Los datos se revisan examinando los gráficos de los datos registrados con o sin algún tipo de preprocesamiento (filtro de muesca y/o de paso de banda) y se marcan los segmentos de datos que contienen DEI para que cualquier ensayo que se superponga con estos segmentos pueda quedar fuera de los análisis o convertirse en valores perdidos.
Ciertos investigadores han recibido formación clínica formal en la lectura de EEG/iEEG, aunque esto es menos común para muchos investigadores no clínicos que se forman a través de vías académicas de postgrado. Aunque muchos han recibido formación didáctica y/o individualizada sobre cómo identificar y eliminar los ensayos de DEI de los conjuntos de datos, algunos pueden no haberlo hecho. Para complicar el asunto, los conjuntos de datos de EEG están lejos de ser estandarizados debido a las diferencias de registro: la disposición de las redes generadoras de convulsiones difiere en cada paciente, lo que da lugar a un número variable de electrodos, por no mencionar las diferencias individuales en la neuroanatomía y la lateralidad de la implantación. Existen modos de contacto mixtos (rejillas, tiras, profundidades) de densidades variables, junto con una ordenación personalizada de los canales (montajes). Todos estos factores conducen a una mayor dificultad en la interpretación de los análisis de EEGI, especialmente para aquellos que no han recibido una formación adecuada (formal o informal) para la identificación de DEI en estos montajes de registro. Por último, a medida que aumenta la duración de las grabaciones, la Estrategia 1 disminuye su viabilidad debido a las limitaciones de tiempo y esfuerzo.
En las últimas décadas se han desarrollado algoritmos informatizados de detección de picos para dotar a la próxima generación de científicos de capacidades efectivas y estandarizadas de detección de picos, ahorrar tiempo y evitar el error humano. El uso de detectores de IED y la eliminación de los ensayos/datos afectados de forma automatizada constituye otro enfoque, que llamaremos Estrategia 2. Afortunadamente, los IED tienden a tener las características que suelen ser destacadas por muchos algoritmos: componentes de gran amplitud y agudos, y a veces con oscilaciones fisiopatológicas de alta frecuencia que se encuentran con menos frecuencia en el cerebro normal (aunque véase Frauscher et al., 2018b). Idealmente, un algoritmo maximizará tanto la sensibilidad como la especificidad, a la vez que disminuirá o eliminará la contribución (supervisión, como la fijación del umbral) requerida del usuario. Sin embargo, es difícil satisfacer esta lista de deseos por completo, por lo que se han desarrollado muchos algoritmos utilizando una variedad de enfoques automatizados y no supervisados. Estos incluyen derivaciones de EEG (White et al., 2006), transformaciones de longitud de línea y de potencia (Esteller et al., 2001; Bergstrom et al., 2013), funciones de transferencia dirigidas adaptativas (Wilke et al., 2009), filtros espaciales (Liu et al., 2015) y algoritmos de coincidencia de placas de picos como la regresión espaciotemporal (Tousseyn et al., 2014) y la factorización de matrices no negativas (Baud et al., 2018), entre muchos otros enfoques. Todas las herramientas tienen compensaciones de sensibilidad y especificidad; ningún enfoque proporciona un 100% de certeza, y esto se complica aún más por la falta de un estándar de oro humano confiable. En concreto, la escasa concordancia entre los evaluadores de la detección manual entre personas altamente capacitadas que se mencionó anteriormente, y la «zona gris cuantitativa» de pequeños artefactos explosivos improvisados que pueden ignorar, son advertencias fundamentales para las pruebas de algoritmos. Por último, aunque casi todos los nuevos métodos se comparan con la detección manual o con otro método automatizado, es difícil realizar una comparación amplia de la mayoría o de todos los métodos automatizados debido a las dificultades técnicas para aplicar cada uno de ellos en un conjunto de datos suficientemente grande (Westover et al., 2017). Sin embargo, la eliminación automatizada de los picos interictales utilizando enfoques no supervisados y/o supervisados puede ahorrar tiempo, abordar la estandarización y mejorar la calidad de los datos de neurofisiología.
Como resultado de las advertencias (y falacias potenciales) de los algoritmos de detección automatizada, algunos investigadores que los emplean pueden dudar en permitir la plena discreción a este mecanismo. Dado que los enfoques de detección automatizada pueden aumentar drásticamente la eficiencia para el grueso de las detecciones evidentes, una tercera estrategia (Estrategia 3) es un enfoque híbrido de las Estrategias 1 y 2, en el que las detecciones automatizadas también se examinan manualmente (a menudo en este orden, aunque también se puede aplicar el orden inverso o múltiples iteraciones). Un ejemplo de este híbrido es el uso de distribuciones de características morfológicas (por ejemplo, la pendiente, las medidas de potencia, etc.) a las que se puede aplicar un umbral, seguido de una inspección manual para detectar posibles falsos positivos y/o negativos.
Dada la complejidad de la recopilación de estos valiosos datos y su escasez asociada, un inconveniente común a las Estrategias 1, 2 o 3 es que la eliminación de ensayos reduce la potencia estadística. En consecuencia, otro sesgo -mantener más ensayos- permite que se introduzcan más resultados potenciales de señales espurias, añadiendo el riesgo de falsos negativos y positivos, tal y como se ha descrito anteriormente.
La preferencia por mantener el mayor número posible de ensayos introduce una estrategia diferente para tratar los DEI: el agnosticismo, en el que los DEI se ignoran (no se evalúan) y no se elimina ningún ensayo (Estrategia 4). Naturalmente, se podría suponer que los datos afectados por las DEI serán lo suficientemente infrecuentes y aleatorios como para que los puntos de tiempo afectados se mezclen en el fondo de una señal promediada, añadiendo variabilidad pero sin sesgar significativamente los resultados. Mientras tanto, es de esperar que las firmas neurofisiológicas relacionadas con la tarea surjan del análisis y prevalezcan, si están presentes, en virtud de su consistencia a través de los ensayos. Como un problema de señal-ruido, esta suposición puede ser válida para IEDs infrecuentes, especialmente con un tamaño de efecto experimental fuerte (aunque una capa de seguridad adicional de usar estadísticas no paramétricas puede ser aconsejada). Sin embargo, los DEI más frecuentes (Figuras 1E-H) y/o más grandes o agudos pueden socavar este enfoque. No obstante, siempre se prefiere una potencia estadística robusta, y a menudo se requiere un gran número de ensayos que es más probable que se alcancen en el enfoque agnóstico de la estrategia 4, especialmente para el tamaño del efecto sutil. De hecho, un estudio reciente (Meisler et al., 2019) evaluó formalmente si la eliminación manual, automatizada o no de los IED afectaba a sus hallazgos neurofisiológicos en una tarea de memoria episódica; no encontraron un efecto claro de ningún enfoque, aunque destacaron la importancia de un número suficiente de ensayos. En una nota relacionada, los nuevos análisis de aprendizaje automático requieren grandes volúmenes de datos de entrenamiento para construir modelos precisos; estos, junto con los enfoques de aprendizaje profundo, pueden aprender a diferenciar entre las señales neurofisiológicas normales y las formas de onda patológicas de los DEI, siempre que los datos de entrenamiento anteriores estén etiquetados con precisión (a menudo manualmente). Por lo tanto, la estrategia agnóstica tiene cierto atractivo (incluido el bajo esfuerzo) y podría ser una buena opción por defecto para algunos estudios, suponiendo que haya suficientes datos para emplearla.
Prácticas actuales entre los investigadores de IEEG
Con estas diversas estrategias generales en mente, ¿cómo se manejan actualmente los DEI por parte de los investigadores de neurofisiología humana? Evaluamos esta cuestión de «Prácticas actuales» resumiendo primero cómo los investigadores describen sus métodos en la literatura publicada. Buscamos en PubMed utilizando dos amplias consultas: (intracraneal Y eeg; electrocorticografía) y filtramos los resultados para incluir solo estudios publicados en 2018. Limitamos los resultados de la búsqueda examinando cada artículo (613 artículos únicos) e incluimos solo aquellos que medían las señales neurofisiológicas intracraneales en humanos y parecían sacar conclusiones sobre la neurofisiología normal (91 en total). Aunque estas condiciones de búsqueda no son exhaustivas, proporcionan una instantánea contemporánea de diversos grupos de todo el mundo que estudian la neurofisiología humana normal in vivo. Encontramos que la mayoría de estas publicaciones aludían al uso de métodos manuales (Figura 2A), incluyendo la identificación directa de los DEI, o un enfoque similar (aunque más conservador) de identificar y excluir los electrodos que cubrían los focos de convulsiones. Menos del 5% de los manuscritos utilizaron métodos totalmente automatizados, y ninguno de los artículos incluidos utilizó el enfoque agnóstico (Estrategia 4). De nuevo, nuestra muestra de artículos incluidos fue limitada y estos resultados pueden no representar completamente el campo.
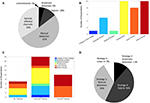
Figura 2. Prácticas actuales de manejo de IED entre los investigadores de IEEG. (A) Métodos de manejo de IEDs según lo informado por los manuscritos de 2018 que coincidieron con nuestra búsqueda en PubMed y los criterios de selección. (B) Niveles de carrera entre los encuestados. (C) Formación relativa a la identificación y/o eliminación de DEI entre los encuestados. (D) Estrategia utilizada para el manejo de DEI entre los encuestados.
Dado que los métodos de manejo de DEI no parecían estar descritos en detalle en muchos de los artículos, evaluamos aún más nuestra pregunta de «Prácticas actuales» diseñando una encuesta anónima. Esta encuesta (aproximadamente ~2 minutos) consistió en preguntas sobre el nivel de la carrera, si estaban familiarizados con los DEI en la GIEI, y si tenían formación formal o informal o no sobre la identificación y eliminación de los DEI, junto con una selección de cuál de las estrategias (1-4) anteriores tendían a utilizar (u otra). Se envió un correo electrónico a los autores correspondientes de los artículos descritos anteriormente (79 en total, ya que algunos artículos se solapaban o tenían varios autores correspondientes) solicitando su participación voluntaria, que sería anónima (exenta de los requisitos del IRB por la Oficina del IRB de la UCSF). Pedimos a estas personas que reenviaran la encuesta a otros colegas y compañeros de trabajo también.
Recibimos una tasa de respuesta del 44%, con un peso de los encuestados hacia los miembros posdoctorales y de la facultad, probablemente debido a un sesgo de muestreo a través del envío de correos electrónicos a una población de autores correspondientes (Figura 2B). Cabe destacar que las respuestas de estos miembros veteranos del laboratorio pueden representar la práctica de su laboratorio en su conjunto sobre su Estrategia IED, aunque esto es menos aplicable a las preguntas de familiaridad y formación sobre IED. Todos los encuestados indicaron que estaban familiarizados con los AEI, un resultado tranquilizador, aunque posiblemente influido por la naturaleza de la encuesta. En cuanto a la formación para reconocer los artefactos explosivos improvisados y los métodos de manipulación, la mayoría recibió una formación informal (Figura 2C), y algunos no recibieron ninguna formación. No es de extrañar que los que se identificaron como formados formalmente fueran profesores junior y senior, en consonancia con los requisitos clínicos de nivel de becario para la formación formal en EEG en la mayoría de los contextos. La mayoría de los encuestados utilizó un enfoque manual, ya sea de forma aislada o como un híbrido manual-automatizado (Estrategias 1 y 3; Figura 2D), generalmente comparable a la revisión de la literatura (Figura 2A), como se esperaba. Curiosamente, no encontramos ningún artículo que indicara explícitamente el uso de la Estrategia 4 («agnóstica») a pesar de que el 9% de los encuestados se identificó como tal, y la incorporación de métodos automatizados (Estrategias 2 y 3) tuvo una mayor representación en las respuestas a la encuesta (55%) que en la revisión de la literatura (14%). Sin embargo, estas discrepancias podrían explicarse por el sesgo de información, dados los diferentes contextos de los métodos de manuscrito frente a una encuesta directa, y el sesgo de muestreo (tasa de respuesta a la encuesta).
Consideraciones adicionales
Aunque este artículo se centra principalmente en los DEI, los peligros y las estrategias descritas aquí pueden y deben extenderse a otros artefactos eléctricos o no fisiológicos (movimientos de cables, saltos de electrodos, saturación del amplificador, etc.), ya que pueden implicar desviaciones agudas de gran amplitud similares. En cuanto a la exclusión de canales, los canales con abundantes DEI son especialmente problemáticos para los métodos automatizados que se basan en estimaciones de fondo. Además, si se va a estudiar la neurofisiología normal, estos canales y cualquiera que se sepa que está en el tejido lesional deben excluirse por completo (Frauscher et al, 2018a); esta práctica se reflejó en alrededor de un tercio de los manuscritos en nuestra revisión de la literatura (Figura 2A).
Con respecto al control experimental adecuado, a menudo es primordial que el marcado de IED se realice mientras se ciega a los eventos de la tarea y las condiciones experimentales (más relevante para las Estrategias manuales 1 y 3), para evitar sesgos que podrían influir en los resultados del estudio (por ejemplo, eliminando ensayos con IED más a menudo de una condición que de otra). En cuanto a los posibles factores de confusión en los estudios basados en ensayos, a menudo se asume que los DEIs ocurren de forma impredecible, incluso hasta el punto de ser aleatorios: esta suposición es favorable si se dejan los DEIs en los datos (Estrategia 4), ya que los falsos positivos y negativos se reducirían mediante el promedio de los ensayos, lo que mejora la relación señal-ruido neurofisiológica. Sin embargo, hay que tener en cuenta que el tiempo de los IEDs puede no ser necesariamente aleatorio en una tarea conductual. Se ha descrito una modulación dependiente de la tarea del momento o la cantidad de IED (Matsumoto et al., 2013), que podría confundir los resultados al ponderar preferentemente los resultados espurios en ciertos segmentos de ensayo más que en otros. Esto argumentaría en contra del uso de la estrategia 4, aunque, de nuevo, el enigma del número de ensayos y la potencia estadística puede ser problemático, como se ha señalado anteriormente.
Por último, aparte de las implicaciones del procesamiento de señales, cabe mencionar que los IED también pueden alterar transitoriamente la disfunción neural local de la región en la que se producen (Krauss et al., 1997; Kleen et al., 2013; Horak et al., 2017; Ung et al., 2017). Esto podría dar lugar a errores cognitivos que podrían influir en los análisis basados en los ensayos y en otros, lo que plantea un argumento independiente para la exclusión de los ensayos con DEI a la hora de sacar conclusiones sobre el procesamiento cognitivo «normal».
Conclusiones
La aceleración de la neurofisiología intracraneal humana transmite una gran emoción por los inminentes descubrimientos y capacidades, incluida la ampliación de las neurociencias básicas, la mejora de la terapéutica clínica y el desarrollo de interfaces cerebro-máquina. Sin embargo, la IED plantea escollos de resultados espurios, difíciles de evitar por la naturaleza del tejido epiléptico in vivo del que se registran los datos. Es necesario aumentar la vigilancia para evitar los IEDs en los datos si/cuando sea apropiado, lo que puede permitirse mediante la consideración y el uso de las estrategias enumeradas anteriormente. También sugerimos que los investigadores de nivel medio y superior intenten mejorar y ofrecer presentaciones o simulaciones de formación estandarizadas en sus laboratorios para los métodos de identificación, detección y eliminación de artefactos explosivos improvisados. Esto dotará a los investigadores más jóvenes de un importante conjunto de habilidades para comprender y examinar constructivamente sus propios datos y los de otros. Además, es necesario mejorar la comunicación científica (Suthana et al., 2018), de modo que los manuscritos sobre neurofisiología humana normal deberían transmitir claramente el enfoque utilizado para el manejo de los AEI y su justificación en el contexto de su estudio. Es de esperar que tales prácticas de mayor vigilancia y comunicación clara mejoren la reproducibilidad para que el campo pueda continuar su aceleración sin contratiempos previsibles.
Declaración de disponibilidad de datos
Los datos del estudio en este artículo pueden descargarse de doi: 10.5281/zenodo.3626105.
Declaración de ética
Los estudios con participantes humanos fueron revisados y aprobados por la Junta de Revisión Institucional de la Universidad de California en San Francisco. No se requirió el consentimiento informado por escrito para la participación en este estudio de acuerdo con la legislación nacional y los requisitos institucionales.
Contribuciones de los autores
SA y JK desarrollaron el concepto del manuscrito, crearon y distribuyeron la encuesta, realizaron la búsqueda bibliográfica y redactaron el manuscrito. ML y EC proporcionó importantes comentarios y ediciones del manuscrito. Todos los autores leyeron y aprobaron el manuscrito presentado.
Financiación
SA fue financiado por un suplemento de diversidad de los NIH bajo R01-DC012379. JK fue financiado por los Institutos Nacionales de Salud/Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (NIH/NINDS) con las subvenciones R25NS070680 y K23NS110920. ML fue financiado por las subvenciones de los NIH R01-DC015504, F32-DC013486 y el Instituto Kavli para el Cerebro y la Mente y el contrato de DARPA N66001-17-2-4008. EC fue financiado por subvenciones de los NIH (R01-DC012379, R00-NS065120 y DP2-OD00862) y el Fondo Esther A. y Joseph Klingenstein.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Damos las gracias a Maxime Baud y Han Yi por sus útiles discusiones y comentarios durante el desarrollo de este manuscrito.
Andrews, J. P., Gummadavelli, A., Farooque, P., Bonito, J., Arencibia, C., Blumenfeld, H., et al. (2019). Asociación de la propagación de las convulsiones con el fracaso quirúrgico en la epilepsia. JAMA Neurol. 76, 462-469. doi: 10.1001/jamaneurol.2018.4316
PubMed Abstract | CrossRef Full Text | Google Scholar
Barkmeier, D. T., Shah, A. K., Flanagan, D., Atkinson, M. D., Agarwal, R., Fuerst, D. R., et al. (2012). High inter-reviewer variability of spike detection on intracranial EEG addressed by an automated multi-channel algorithm. Clin. Neurophysiol. 123, 1088-1095. doi: 10.1016/j.clinph.2011.09.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Baud, M. O., Kleen, J. K., Anumanchipalli, G. K., Hamilton, L. S., Tan, Y.-L., Knowlton, R., et al. (2018). Aprendizaje no supervisado de las descargas interictales espaciotemporales en la epilepsia focal. Neurosurgery 83, 683-691. doi: 10.1093/neuros/nyx480
PubMed Abstract | CrossRef Full Text | Google Scholar
Bergstrom, R. A., Choi, J. H., Manduca, A., Shin, H.-S., Worrell, G. A., y Howe, C. L. (2013). Identificación automatizada de múltiples tipos de eventos epileptiformes relacionados con las convulsiones e interictales en el EEG de ratones. Sci. Rep. 3:1483. doi: 10.1038/srep01483
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, E. F. (2015). Hacia neurotecnologías mesoscópicas a gran escala y basadas en el ser humano. Neuron 86, 68-78. doi: 10.1016/j.neuron.2015.03.037
PubMed Abstract | CrossRef Full Text | Google Scholar
Chronux Home. (2019). Software de análisis Chronux. Disponible en línea en: http://chronux.org/. Consultado el 25 de septiembre de 2019.
Cuello Oderiz, C., von Ellenrieder, N., Dubeau, F., Eisenberg, A., Gotman, J., Hall, J., et al. (2019). Asociación de la convulsión inducida por la estimulación cortical con el resultado quirúrgico en pacientes con epilepsia focal resistente a los medicamentos. JAMA Neurol. 76, 1070-1078. doi: 10.1001/jamaneurol.2019.1464
PubMed Abstract | CrossRef Full Text | Google Scholar
Esteller, R., Echauz, J., Tcheng, T., Litt, B., y Pless, B. (2001). «Line length: an efficient feature for seizure onset detection», en Proceedings of the 2001 Conference 23rd Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Istanbul, Turkey: IEEE, 1707-1710.
Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Doležalová, I., Minotti, L., Olivier, A., et al. (2018a). Atlas del electroencefalograma intracraneal normal: actividad neurofisiológica despierta en diferentes áreas corticales. Brain 141, 1130-1144. doi: 10.1093/brain/awy035
PubMed Abstract | CrossRef Full Text | Google Scholar
Frauscher, B., von Ellenrieder, N., Zelmann, R., Rogers, C., Khoa Nguyen, D., Kahane, P., et al. (2018b). Oscilaciones de alta frecuencia en el cerebro humano normal. Ann. Neurol. 84, 374-385. doi: 10.1002/ana.25304
PubMed Abstract | CrossRef Full Text | Google Scholar
Horak, P. C., Meisenhelter, S., Song, Y., Testorf, M. E., Kahana, M. J., Viles, W. D., et al. (2017). Las descargas epileptiformes interictales perjudican el recuerdo de palabras en múltiples áreas cerebrales. Epilepsia 58, 373-380. doi: 10.1111/epi.13633
PubMed Abstract | CrossRef Full Text | Google Scholar
Janca, R., Jezdik, P., Cmejla, R., Tomasek, M., Worrell, G. A., Stead, M., et al. (2015). Detección de descargas epileptiformes interictales mediante el modelado de la distribución de la envolvente de la señal: aplicación a registros intracraneales epilépticos y no epilépticos. Brain Topogr. 28, 172-183. doi: 10.1007/s10548-014-0379-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kleen, J. K., Scott, R. C., Holmes, G. L., Roberts, D. W., Rundle, M., Testorf, M., et al. (2013). Hippocampal interictal epileptiforme activity disrupts cognition in humans. Neurology 81, 18-24. doi: 10.1212/wnl.0b013e318297ee50
PubMed Abstract | CrossRef Full Text | Google Scholar
Kramer, M. A., Tort, A. B. L., and Kopell, N. J. (2008). Artefactos de borde agudo y acoplamiento espurio en las medidas de comodulación de frecuencia del EEG. J. Neurosci. Methods 170, 352-357. doi: 10.1016/j.jneumeth.2008.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Krauss, G. L., Summerfield, M., Brandt, J., Breiter, S., y Ruchkin, D. (1997). Los picos temporales mesiales interfieren con la memoria de trabajo. Neurology 49, 975-980. doi: 10.1212/wnl.49.4.975
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y., Coon, W. G., de Pesters, A., Brunner, P., y Schalk, G. (2015). Los efectos del filtrado espacial y los artefactos en las señales electrocorticográficas. J. Neural Eng. 12:056008. doi: 10.1088/1741-2560/12/5/056008
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsumoto, J. Y., Stead, M., Kucewicz, M. T., Matsumoto, A. J., Peters, P. A., Brinkmann, B. H., et al. (2013). Network oscillations modulate interictal epileptiform spike rate during human memory. Brain 136, 2444-2456. doi: 10.1093/brain/awt159
PubMed Abstract | CrossRef Full Text | Google Scholar
Meisler, S. L., Kahana, M. J., y Ezzyat, Y. (2019). La limpieza de datos mejora la clasificación del estado cerebral? J. Neurosci. Methods 328:108421. doi: 10.1016/j.jneumeth.2019.108421
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitra, P., y Bokil, H. (2007). Dinámicas cerebrales observadas. Nueva York, NY: Oxford University Press.
Google Scholar
Parvizi, J., y Kastner, S. (2018). Promesas y limitaciones de la electroencefalografía intracraneal humana. Nat. Neurosci. 21, 474-483. doi: 10.1038/s41593-018-0108-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, S., Crone, N. E., Niebur, E., Franaszczuk, P. J., y Hsiao, S. S. (2008). Correlatos neuronales de las oscilaciones de alta gamma (60-200 Hz) en los potenciales de campo locales de los macacos y sus posibles implicaciones en la electrocorticografía. J. Neurosci. 28, 11526-11536. doi: 10.1523/JNEUROSCI.2848-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Scheffer-Teixeira, R., Belchior, H., Leão, R. N., Ribeiro, S., and Tort, A. B. L. (2013). On high-frequency field oscillations (>100 Hz) and the spectral leakage of spiking activity. J. Neurosci. 33, 1535-1539. doi: 10.1523/JNEUROSCI.4217-12.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Suthana, N., Aghajan, Z. M., Mankin, E. A., y Lin, A. (2018). Directrices de información y cuestiones a tener en cuenta para el uso de la estimulación cerebral intracraneal en estudios de memoria declarativa humana. Front. Neurosci. 12:905. doi: 10.3389/fnins.2018.00905
PubMed Abstract | CrossRef Full Text | Google Scholar
Tousseyn, S., Dupont, P., Robben, D., Goffin, K., Sunaert, S., y Van Paesschen, W. (2014). A reliable and time-saving semiautomatic spike-template-based analysis of interictal EEG-FMRI. Epilepsia 55, 2048-2058. doi: 10.1111/epi.12841
PubMed Abstract | CrossRef Full Text | Google Scholar
Ung, H., Cazares, C., Nanivadekar, A., Kini, L., Wagenaar, J., Becker, D., et al. (2017). La actividad epileptiforme interictal fuera de la zona de inicio de la convulsión impacta en la cognición. Brain 140, 2157-2168. doi: 10.1093/brain/awx143
PubMed Abstract | CrossRef Full Text | Google Scholar
van Drongelen, W. (2018). Procesamiento de señales para neurocientíficos. Londres: Elsevier Academic press.
Google Scholar
Westover, M. B., Halford, J. J., y Bianchi, M. T. (2017). Qué debe significar que un algoritmo pase una prueba de turing estadística para la detección de descargas epileptiformes. Clin. Neurophysiol. 128, 1406-1407. doi: 10.1016/j.clinph.2017.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
White, A. M., Williams, P. A., Ferraro, D. J., Clark, S., Kadam, S. D., Dudek, F. E., et al. (2006). Efficient unsupervised algorithms for the detection of seizures in continuous eeg recordings from rats after brain injury. J. Neurosci. Methods 152, 255-266. doi: 10.1016/j.jneumeth.2005.09.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilke, C., van Drongelen, W., Kohrman, M., and He, B. (2009). Identification of epileptogenic foci from causal analysis of ECoG interictal spike activity. Clin. Neurophysiol. 120, 1449-1456. doi: 10.1016/j.clinph.2009.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar
.