Introducción
Los neutrófilos son la población más abundante de glóbulos blancos circulantes y la primera línea de defensa del huésped contra los patógenos invasores . En condiciones normales, los neutrófilos circulantes tienen una vida media de 6 a 12 horas y son funcionalmente quiescentes. Durante la inflamación, los neutrófilos llegan rápidamente a los focos de infección y lesión, potencian la actividad antimicrobiana y mueren dentro del tejido infiltrado. Desempeñan funciones importantes en el sistema inmunitario innato, y se observan respuestas significativas de los neutrófilos en la inflamación sistémica, como en los traumatismos, las lesiones por quemaduras, la sepsis y la cirugía mayor.
Sin embargo, la desregulación de las respuestas de los neutrófilos, como la liberación excesiva o incontrolada de citoquinas proinflamatorias, puede causar daños en los tejidos u órganos del huésped durante la sepsis grave, y las enfermedades autoinmunes.
La terapia de eliminación de leucocitos (LRT), la leucocitaféresis (LCAP) o la aféresis de granulocitos/monocitos (GMA) es un método de aféresis terapéutica que elimina los leucocitos periféricos mediante circulación extracorpórea. Se ha utilizado como tratamiento no farmacológico en la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), y ha demostrado una excelente eficacia a corto plazo.
La aféresis de granulocitos y monocitos (LRT) utilizando Cellsorba, una columna de fibras de teleftalato de polietileno (Asahi-Kasei Medical, Tokio, Japón), se ha informado que elimina ~100% de los granulocitos/monocitos, ~60% de los linfocitos y ~50% de las plaquetas tanto a la entrada como a la salida del aparato Cellsorba . Aunque los mecanismos exactos de la TRL no se han explorado por completo, se ha informado de sus posibles mecanismos, que incluyen una reducción del número de leucocitos activados o de citoquinas proinflamatorias como el factor de necrosis tumoral (TNF)-α, la interleucina (IL)-1β, la IL-6 y la IL-8 .
La infección del sitio quirúrgico (ISQ) sigue siendo una de las causas más comunes de morbilidad en la cirugía mayor, que prolonga la hospitalización y aumenta los costes médicos . La vigilancia multicéntrica prospectiva japonesa mostró que el 19,5% de los pacientes con CU desarrollaron ISQ después de la cirugía.
En un estudio de casos y controles, se comparó retrospectivamente la incidencia de ISQ entre los pacientes sometidos a proctocolectomía con bolsa ileal-anastomosis (IPAA) (n=29) y los sometidos a IPAA con LCAP postoperatoria (n=43). La LCAP postoperatoria redujo significativamente las ISQ en los pacientes con CU sometidos a proctocolectomía con IPAA (p<0,01). En un estudio prospectivo multicéntrico que realizamos, se comparó la incidencia de ISQ entre los pacientes con CU sometidos a cirugía (grupo de control; n=103) y los sometidos a cirugía con LCAP postoperatoria (n=40). Las ISQ se produjeron en 4 de 37 pacientes (10,8%) en el grupo de LCAP, mientras que se produjeron en 29 de 103 pacientes (28,2%) en el grupo de control, aunque la diferencia no alcanzó significación estadística (p=0,069).
Estas observaciones clínicas sugieren que la LCAP elimina los leucocitos activados productores de citoquinas proinflamatorias en la inflamación sistémica postoperatoria debida a la cirugía colorrectal mayor, y podría suprimir la aparición de ISQ. Hemos informado de una asociación entre la disfunción de los neutrófilos y las complicaciones infecciosas postoperatorias.
Los neutrófilos son las células más abundantes entre los leucocitos circulantes y pueden ser los más frecuentemente eliminados por la LCAP . Por lo tanto, nos centramos en las funciones de los neutrófilos circulantes aislados antes y después de la LCAP, para aclarar los mecanismos terapéuticos de la LCAP postoperatoria en la aparición de ISQ en pacientes con CU después de la cirugía.
Materiales y método
Pacientes
Cuatro tres pacientes con CU sometidos a IPAA recibieron LCAP postoperatoria en el Departamento de Cirugía Gastrointestinal y Pediátrica de la Facultad de Medicina de la Universidad de Mie entre 2004 y 2008. El diagnóstico de CU se basó en los datos clínicos, radiográficos, endoscópicos, quirúrgicos e histopatológicos. Antes de la cirugía, los pacientes recibieron diversos tratamientos médicos que incluían fármacos antiinflamatorios (aminosalicilatos, corticosteroides) o inmunosupresores (azatioprina, mercaptopurina, ciclosporina), o ambos. El LCAP postoperatorio se realizó una vez en las 2 horas siguientes a la cirugía. Los pacientes con síntomas clínicos de sepsis fueron excluidos del estudio. Los pacientes con hemodinámica inestable tras la cirugía también fueron excluidos según el protocolo. Se obtuvo el consentimiento informado por escrito de todos los pacientes antes del inicio de este estudio, que se llevó a cabo de acuerdo con la Declaración de Helsinki y fue aprobado por la Junta de Revisión Institucional (nº 474).
Aislamiento de neutrófilos
Se aislaron neutrófilos antes y después de la LCP de los mismos pacientes antes y después de la cirugía. El aislamiento de neutrófilos se basó en un procedimiento previamente descrito. Las muestras de sangre (10 ml) se diluyeron con un volumen igual de solución salina tamponada con fosfato (PBS), se colocaron sobre un volumen de Ficoll-Paque PLUS (Stemcell Technologies Inc., Vancouver, BC, Canadá) y se centrifugaron a 600 × g durante 30 minutos a temperatura ambiente. Tras eliminar las células mononucleares, el plasma y el Ficoll-Paque PLUS, el pellet se resuspendió en 12 mL de solución de cloruro de amonio para lisar los glóbulos rojos, se lavó dos veces en PBS y se resuspendió en PBS. Los neutrófilos se lavaron dos veces con PBS y se resuspendieron en TCM-10 . Se comprobó la viabilidad de las preparaciones celulares (>99%) mediante exclusión con azul tripán y la pureza (>95% de granulocitos CD13+, CD33+) mediante citometría de flujo.
Actividad fagocítica
Se comparó la actividad fagocítica ex vivo de los neutrófilos circulantes frente a Escherichia coli entre los neutrófilos anteriores y posteriores a LCAP aislados de pacientes idénticos.
La fagocitosis de los neutrófilos se midió utilizando biopartículas fluorescentes. Para opsonizar las biopartículas bacterianas, el reactivo opsonizante reconstituido y las biopartículas bacterianas (5 × 105) se mezclaron, se agitaron en vórtex y se incubaron durante 1 h a 37 °C en un incubador humidificado al 5% de CO2. Después de dos lavados con PBS, separados por centrifugación a baja velocidad (1500 × g, 15 min, 4°C), los pellets se incubaron con neutrófilos (5 × 105) en 1 mL de medio sin antibióticos durante 3 h a 37°C en una incubadora humidificada al 5% de CO2. Después de 3 h de incubación, se analizó la actividad fagocítica de los neutrófilos contra E. coli utilizando un FACScan (Becton-Dickinson, San José, CA, EE.UU.) y se contaron 10.000 eventos por muestra.
Preparación de E. coli
Escherichia coli (ATCC25922) se adquirió en American Type Culture Collection (Manassas, VA, EE.UU.), y se cultivó en medio de Eagle modificado de Dulbecco (Invitrogen, Tokio, Japón) durante 10 horas a 37 °C. El medio de cultivo se centrifugó a 1.700 × g durante 10 minutos a temperatura ambiente para obtener un pellet, que se lavó dos veces y se resuspendió en solución salina normal estéril. Una alícuota (100 μL) de la suspensión se diluyó en serie con solución salina estéril, se sembró en Agar-B (Qbiogene, Carlsbad, CA, USA) y se incubó durante 18 h para determinar la concentración bacteriana. El resto se almacenó a -80 °C hasta su uso.
Cocultivo de neutrófilos con E. coli
Justo antes de su uso, la suspensión de E. coli se diluyó en medio para alcanzar una concentración final de 2,5 × 106 ufc/mL. Tras la opsonización de E. coli utilizando suero autólogo durante 30 min a 37°C, se cocultivaron neutrófilos (2,5 × 105 /mL) en 1 mL de medio sin antibióticos durante 3 h a 37°C en una incubadora humidificada al 5% de CO2. Después de centrifugar las células a 600 × g durante 10 minutos a 4°C, se recogieron los sobrenadantes para analizar la producción de citoquinas, la elastasa de neutrófilos (NE) y la viabilidad de los neutrófilos.
La viabilidad de los neutrófilos
Se comparó la viabilidad ex vivo de los neutrófilos circulantes frente a E. coli entre los neutrófilos aislados antes y después de LCAP de pacientes idénticos. Para evaluar la viabilidad de los neutrófilos tras el cocultivo con E. coli, se realizó un ensayo de apoptosis.
La apoptosis de los neutrófilos tras el cocultivo con E. coli se cuantificó mediante citometría de flujo utilizando un kit de detección de apoptosis Annexin V (BioVision Research Products, Palo Alto, CA, USA). Los neutrófilos se incubaron en un tampón de unión 1X al que se añadieron 5 μL de isotiocianato de fluoresceína (FITC) de Annexin V y 5 μL de yoduro de propidio (PI). Tras la incubación a temperatura ambiente durante 5 minutos en la oscuridad, las células se analizaron utilizando un FACScan y se contaron 10.000 eventos por muestra.
La combinación de Annexin V-FITC y PI fue capaz de distinguir entre células apoptóticas tempranas (Annexin V+, PI-), células necróticas (Annexin V-, PI+), células apoptóticas tardías o necróticas secundarias (Annexin V+, PI+) y células viables (Annexin V-, PI-).
Ansayo inmunoenzimático (ELISA)
Las citocinas en el suero de los pacientes antes y después de la LCAP y los sobrenadantes después del cocultivo de neutrófilos antes y después de la LCAP con E. coli se midieron mediante ELISA de acuerdo con las instrucciones del fabricante. Las citocinas incluían el TNF-α, el antagonista del receptor de la IL-1 (IL-1Ra), la IL-6, la IL-8 y la NE. Los kits ELISA de TNF-α, IL-1Ra, IL-6 e IL-8 se compraron a R&D Systems (Minneapolis, MN, EE.UU.). El kit ELISA de NE se compró a Immundiagnostik (Bensheim, Alemania). Los límites de detección de TNF-α, IL-1Ra, IL-6, IL-8 y NE fueron 1, 2, 0,01 y 2 pg/mL y 0,12 ng/mL, respectivamente, y los niveles por debajo de estos límites se consideraron indetectables. El nivel de cada citocina se evaluó por duplicado y se calculó el valor medio de la citocina.
Análisis estadístico
Todos los análisis estadísticos se realizaron utilizando JMP versión 5 (SAS Institute, Cary, NC, USA). Las asociaciones entre las variables continuas y categóricas se evaluaron mediante la prueba U de Mann-Whitney o la prueba t emparejada cuando procedía. P<0,05 se consideró estadísticamente significativo.
Resultados
Características de los pacientes
Veintinueve pacientes con CU sometidos a IPAA recibieron LCAP postoperatorio. Las características de los pacientes se muestran en la Tabla 1. La edad media en el momento del diagnóstico fue de 27 años (rango 15-54 años) y la edad media en el momento de la cirugía fue de 33 años (rango 16-61 años). La duración de la enfermedad fue de 6,9 años (rango 0,1-28 años). La colitis del lado izquierdo estaba en 6/29 (21%) pacientes y la pancolitis en 23/29 (79%) pacientes.La gravedad de la enfermedad de la colitis se clasificó como leve (7; 24%), moderada (11; 38%) y grave (4; 38%).
| Características de los pacientes | |
|---|---|
| Variables | Pacientes (n=29) Número |
| Género | |
| Hombre | 19 |
| Mujer | 10 |
| Edad en el momento del diagnóstico | 27( 15-54) |
| Edad en el momento de la cirugía | 33(16-61) |
| Duración de la enfermedad | 6.9 (0.1-28) |
| Gravedad de la enfermedad | |
| Leve | 7 |
| Moderada | 11 |
| grave | 4 |
| Extensión de la enfermedad | |
| Colitis del lado izquierdoizquierda | 6 |
| Colitis del lado colitis | 23 |
| Sistema de clasificación de maltas | |
| 1 | 7 |
| 2 | 11 |
| 3 | 8 |
| 4 | 4 |
| Dosis total de esteroides (mg) | 17285 (800-70000) |
| Uso de inmunosupresores | |
| Sí | 5 |
| No | 24 |
| Tiempo de operación (min) | 262.4 (118-496) |
| Pérdida de sangre (ml) | 307,9 (17-826) |
Tabla 1: Características de los pacientes.
Cambio en el curso temporal del recuento de glóbulos blancos, neutrófilos y plaquetas
Se contaron los glóbulos blancos, los neutrófilos y las plaquetas antes de la cirugía, antes de la LCAP (después de la cirugía) y después de la LCAP (en las 12 horas siguientes a la LCAP), respectivamente. Como se muestra en la figura 1, el recuento de glóbulos blancos, neutrófilos y plaquetas fue significativamente menor después de la LCAP que antes de la misma. Todos los pacientes que recibieron LCAP postoperatorio no tuvieron ningún efecto adverso hematológico.
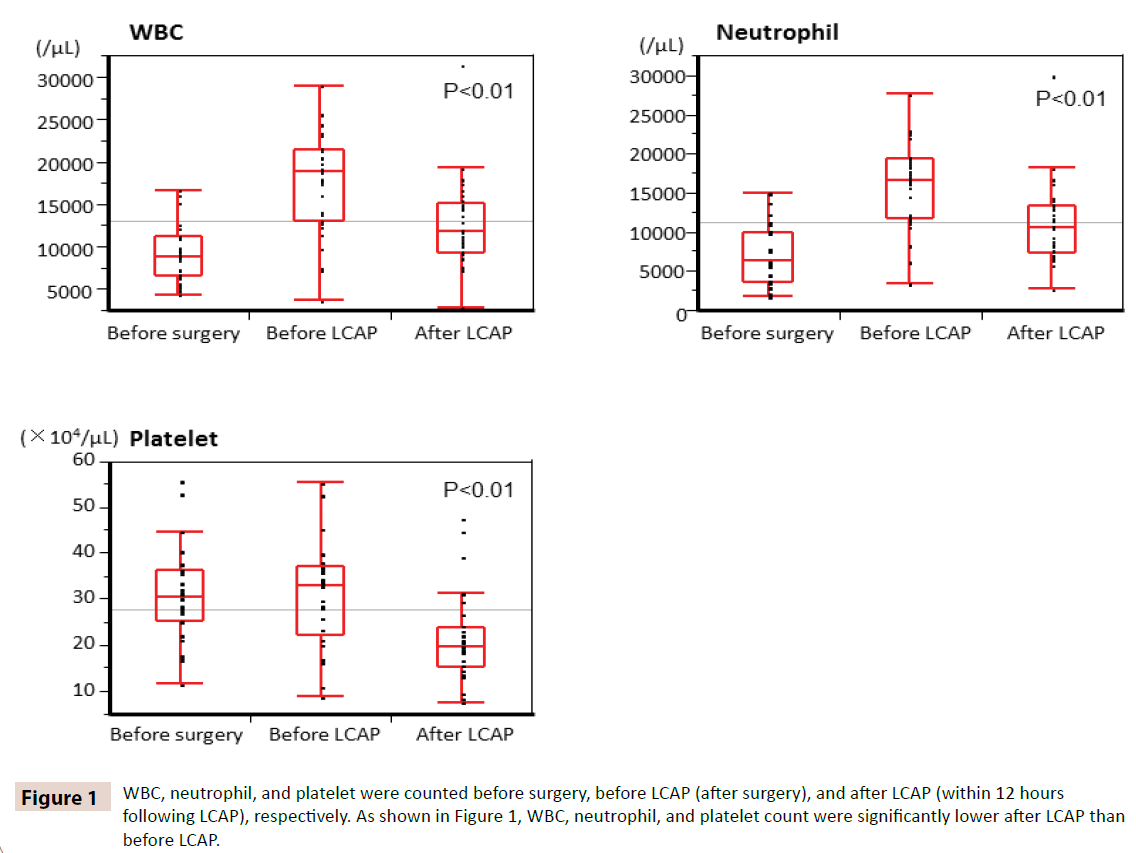
Figura 1: Se contaron los glóbulos blancos, los neutrófilos y las plaquetas antes de la cirugía, antes de la LCAP (después de la cirugía) y después de la LCAP (en las 12 horas siguientes a la LCAP), respectivamente. Como se muestra en la figura 1, el recuento de glóbulos blancos, neutrófilos y plaquetas fue significativamente menor después de la LCAP que antes de la misma.
Actividad fagocítica de los neutrófilos frente a E. coli
Para aclarar si la LCAP influye en la actividad fagocítica de los neutrófilos circulantes, se comparó la actividad fagocítica frente a E. coli entre los neutrófilos anteriores y posteriores a la LCAP. Como se muestra en la Figura 2, no se observó ninguna diferencia significativa en la actividad fagocítica de los neutrófilos (intensidad fluorescente media) contra E. coli entre los neutrófilos pre-LCAP (mediana 1259,4, rango 50,8-3505,6) y post-LCAP (mediana 1077,6, rango 24,4-4152,1) (P=0,72). Estos resultados sugieren que la LCAP no afecta a la actividad fagocítica de los neutrófilos circulantes contra E. coli.
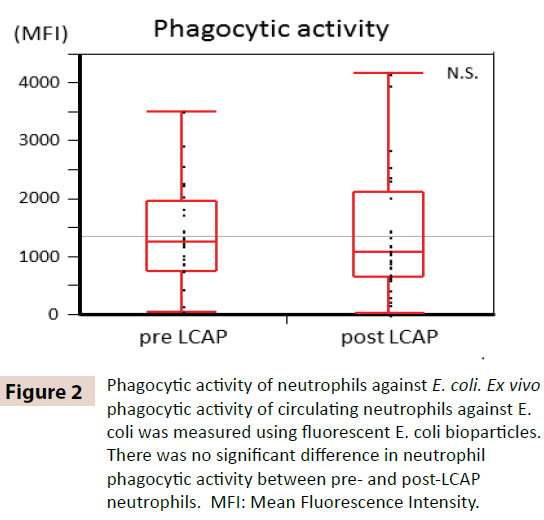
Figura 2: Actividad fagocítica de los neutrófilos contra E. coli. La actividad fagocítica ex vivo de los neutrófilos circulantes contra E. coli se midió utilizando biopartículas fluorescentes de E. coli. No hubo diferencias significativas en la actividad fagocítica de los neutrófilos entre los neutrófilos pre y post-LCAP. IMF: Intensidad media de fluorescencia.
Viabilidad de los neutrófilos tras el cocultivo con E. coli
Para aclarar si la LCAP influye en la respuesta de los neutrófilos frente a la infección bacteriana, se comparó la viabilidad de los neutrófilos frente a E. coli entre los neutrófilos pre y post-LCAP. Se compararon los porcentajes de células viables (Annexin V-, PI-), células apoptóticas tempranas (Annexin V+, PI-), células necróticas (Annexin V-, PI+) y células apoptóticas tardías o necróticas secundarias (Annexin V+, PI+) entre neutrófilos pre y post-LCAP. Como se muestra en la figura 3, la mediana del porcentaje de neutrófilos viables cocultivados con E. coli fue mayor en los neutrófilos post-LCAP (mediana 34,2%, rango 1,16- 77,7%) que en los neutrófilos pre-LCAP (mediana 27,9%, rango 0,53-89,7%), aunque la diferencia no alcanzó significación estadística (P=0,82). El porcentaje de neutrófilos necróticos cocultivados con E. coli disminuyó significativamente en los neutrófilos post-LCAP (mediana 0,73%, rango 0,0-26,0%) que en los neutrófilos pre-LCAP (mediana 1,14%, rango 0,0-26,0%) (P=0,0232).
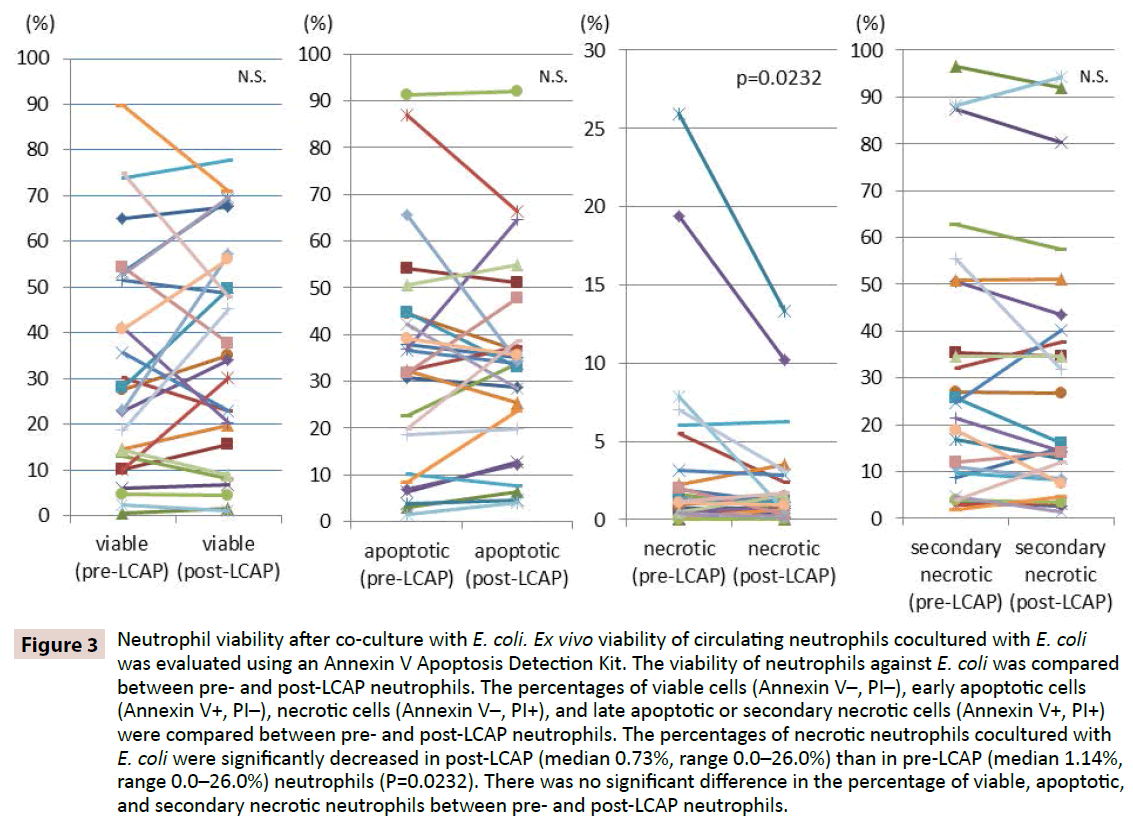
Figura 3: Viabilidad de los neutrófilos tras el cocultivo con E. coli. Se evaluó la viabilidad ex vivo de los neutrófilos circulantes cocultivados con E. coli utilizando un kit de detección de apoptosis Annexin V. Se comparó la viabilidad de los neutrófilos frente a E. coli entre los neutrófilos pre y post-LCAP. Se compararon los porcentajes de células viables (Annexin V-, PI-), células apoptóticas tempranas (Annexin V+, PI-), células necróticas (Annexin V-, PI+) y células apoptóticas tardías o necróticas secundarias (Annexin V+, PI+) entre los neutrófilos pre y post-LCAP. Los porcentajes de neutrófilos necróticos en cocultivo con E. coli disminuyeron significativamente en los neutrófilos post-LCAP (mediana 0,73%, rango 0,0-26,0%) que en los neutrófilos pre-LCAP (mediana 1,14%, rango 0,0-26,0%) (P=0,0232). No hubo diferencias significativas en el porcentaje de neutrófilos viables, apoptóticos y necróticos secundarios entre los neutrófilos pre y post-LCAP.
No se observaron diferencias significativas en el porcentaje de neutrófilos apoptóticos cocultivados con E. coli entre los neutrófilos pre-LCAP (mediana 32,3%, rango 1,51-91,2%) y post-LCAP (mediana 33,8%, rango 4,0-92,1%) (P=0,57). Tampoco se observaron diferencias significativas en el porcentaje de neutrófilos apoptóticos tardíos o necróticos secundarios cocultivados con E. coli entre los neutrófilos pre-LCAP (mediana 23,1%, rango 1,81-96,5%) y post-LCAP (mediana 16,1%, rango 1,44-94,3%) (P=0.13).
Estos resultados sugieren que la LCAP puede disminuir el subconjunto distintivo de neutrófilos circulantes que inducen la necrosis contra la infección bacteriana, y aumentar el número de neutrófilos viables (probablemente no cebados) en la circulación sistémica.
Producción de citoquinas por parte de los neutrófilos tras el cocultivo con E. coli
Para aclarar si la LCAP influye en la producción de citoquinas por parte de los neutrófilos circulantes, se compararon los niveles de citoquinas en los sobrenadantes de cultivo tras el cocultivo con E. coli entre los neutrófilos anteriores y posteriores a la LCAP. Como se muestra en la figura 4, no hubo diferencias significativas en los niveles de NE, TNF-α, IL-6, IL-8 e IL-1Ra en los sobrenadantes de cultivo entre los neutrófilos pre y post LCAP. Estos resultados sugieren que la LCAP no afecta a la producción de citoquinas de los neutrófilos circulantes frente a E. coli.
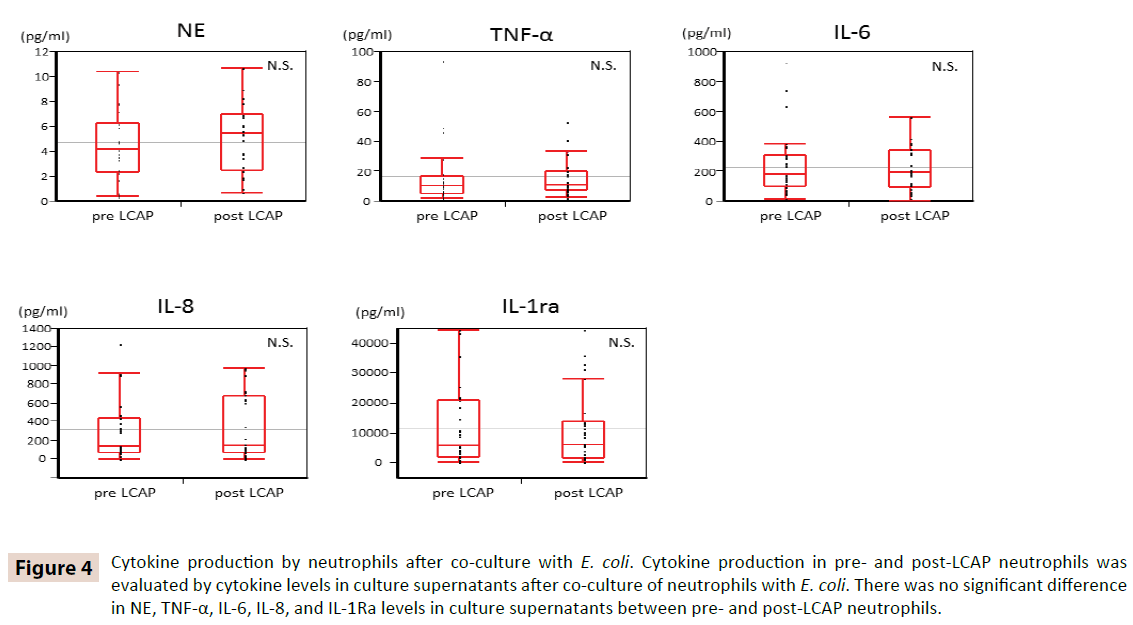
Figura 4: Producción de citoquinas por parte de los neutrófilos tras el cocultivo con E. coli. La producción de citoquinas en los neutrófilos antes y después de la PCL se evaluó mediante los niveles de citoquinas en los sobrenadantes de cultivo tras el cocultivo de neutrófilos con E. coli. No hubo diferencias significativas en los niveles de NE, TNF-α, IL-6, IL-8 e IL-1Ra en los sobrenadantes de cultivo entre los neutrófilos anteriores y posteriores a la LCAP.
Citoquinas séricas antes y después de la LCAP
Para aclarar si la LCAP influye en la respuesta inflamatoria sistémica del huésped, se midieron las citoquinas séricas utilizando muestras de sangre tomadas antes y después de la LCAP. Como se muestra en la figura 5, la NE en suero después de la LCAP (mediana de 5,62 pg/mL, rango de 0,16-10,4 pg/mL) fue significativamente mayor que antes de la LCAP (mediana de 2,87 pg/mL, rango de 0,15-7,61 pg/mL) (P=0,0251). No se encontraron diferencias significativas en los niveles séricos de TNF-α, IL-6, IL-8 e IL-1Ra antes y después de la LCAP.
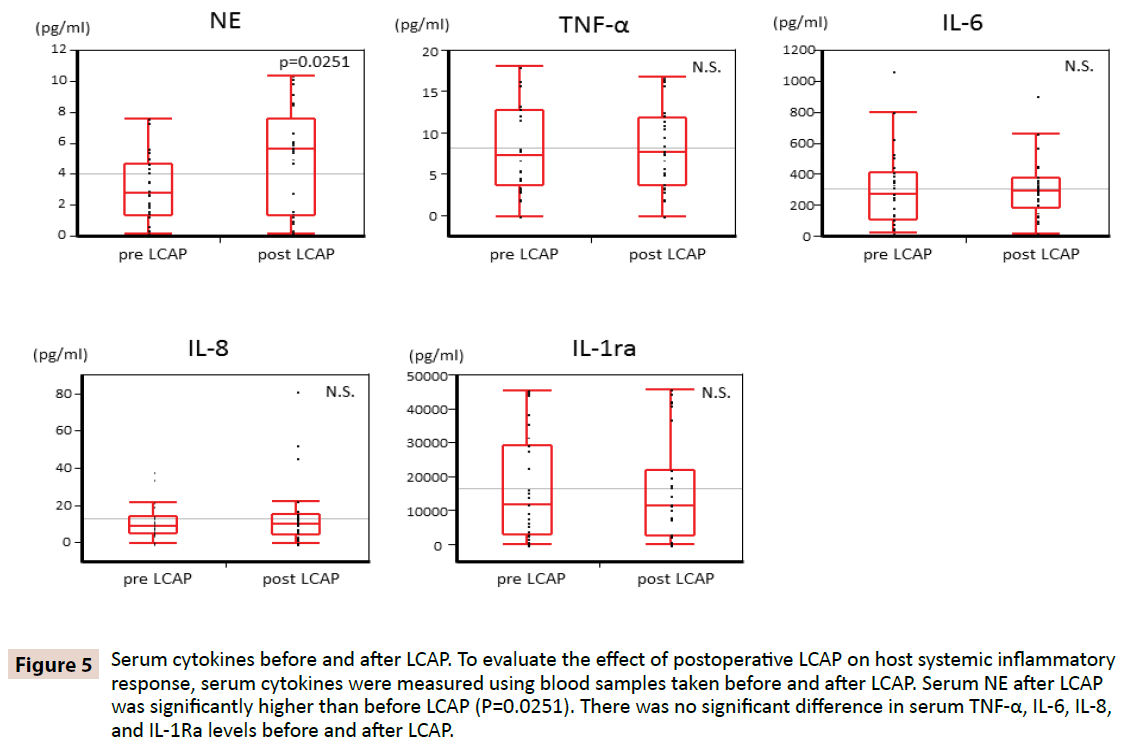
Figura 5: Citoquinas séricas antes y después de la LCAP. Para evaluar el efecto de la LCAP postoperatoria en la respuesta inflamatoria sistémica del huésped, se midieron las citocinas séricas con muestras de sangre tomadas antes y después de la LCAP. La NE sérica después de la LCAP fue significativamente mayor que antes de la LCAP (P=0,0251). No hubo diferencias significativas en los niveles séricos de TNF-α, IL-6, IL-8 e IL-1Ra antes y después de la LCAP.
Asociaciones de las funciones de los neutrófilos después de la LCAP con el tiempo de operación o el recuento de neutrófilos postoperatorio
Para aclarar si las funciones de los neutrófilos circulantes después de la LCAP influyen en la aparición de ISQ, se examinó la asociación entre la actividad fagocítica o la producción de citoquinas de los neutrófilos después de la LCAP y los factores de riesgo de ISQ relacionados con el estrés quirúrgico, como el tiempo de operación, la pérdida de sangre y el recuento de neutrófilos postoperatorio.
Como se muestra en la figura 6, la NE en los sobrenadantes tras el cocultivo de neutrófilos post-LCAP con E. coli fue significativamente mayor en los pacientes con tiempo de operación >3 h (mediana de 5,65 pg/mL, rango 0,97-10.7 pg/mL) que en aquellos con un tiempo de operación <3 h (mediana 1,05 pg/mL, rango 0,72-2,44 pg/mL) (P=0,0158).
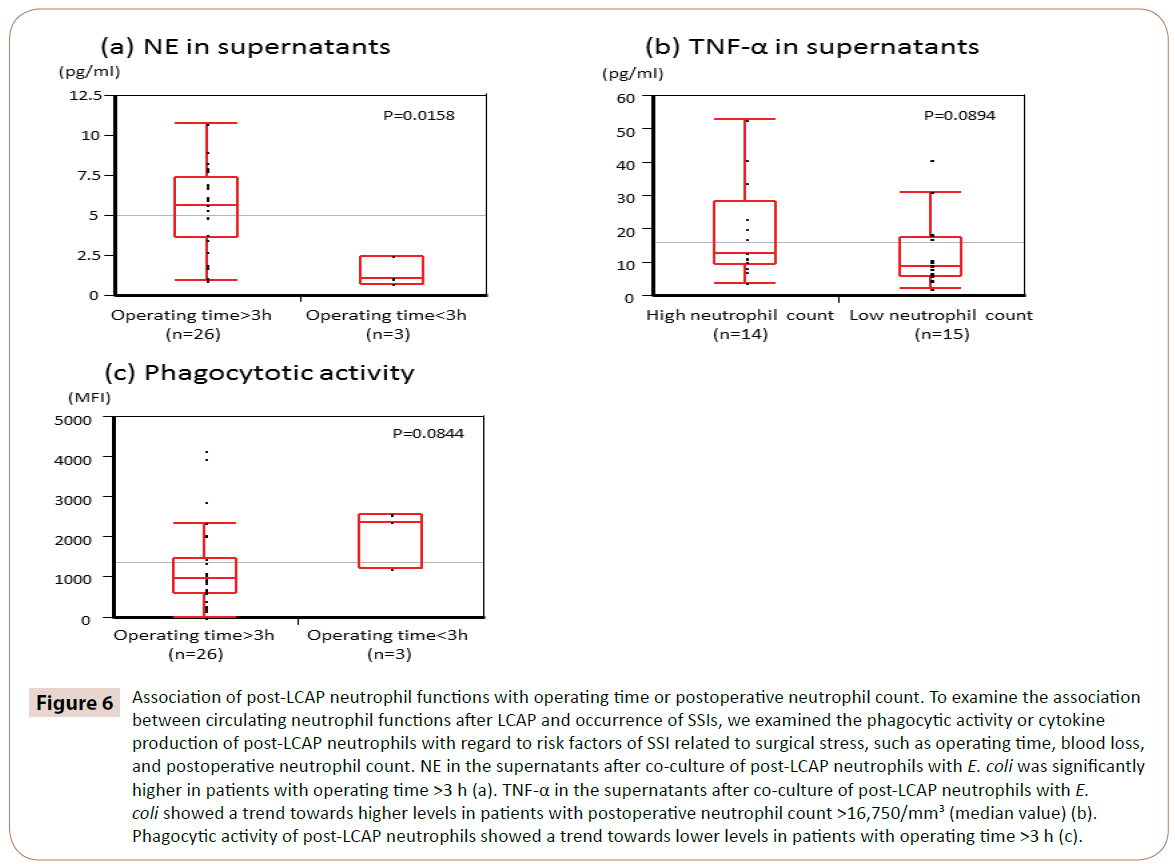
Figura 6: Asociación de las funciones de los neutrófilos post-LCAP con el tiempo de operación o el recuento de neutrófilos postoperatorio. Para examinar la asociación entre las funciones de los neutrófilos circulantes después de la LCAP y la aparición de ISQ, examinamos la actividad fagocítica o la producción de citocinas de los neutrófilos después de la LCAP con respecto a los factores de riesgo de ISQ relacionados con el estrés quirúrgico, como el tiempo de operación, la pérdida de sangre y el recuento postoperatorio de neutrófilos. La NE en los sobrenadantes tras el cocultivo de neutrófilos post-LCAP con E. coli fue significativamente mayor en los pacientes con un tiempo de operación >3 h (a). El TNF-α en los sobrenadantes tras el cocultivo de neutrófilos post-LCAP con E. coli mostró una tendencia hacia niveles más altos en los pacientes con un recuento de neutrófilos postoperatorio >16.750/mm3 (valor mediano) (b). La actividad fagocítica de los neutrófilos post-LCAP mostró una tendencia hacia niveles más bajos en los pacientes con tiempo de operación >3 h (c).
TNF-α en los sobrenadantes tras el co-cultivo de neutrófilos post-LCAP con E. coli mostró una tendencia hacia niveles más altos en pacientes con un recuento de neutrófilos postoperatorio >16.750/mm3 (valor medio) (P=0,0894).
La actividad fagocítica de los neutrófilos post-LCAP contra E. coli mostró una tendencia hacia niveles más bajos en pacientes con un tiempo de operación >3 h (P=0,0844).
Asociaciones entre el TNF-α sérico después de la LCAP y la ISQ
Para aclarar si la respuesta inflamatoria sistémica del huésped después de la LCAP influye en la aparición de la ISQ, se examinó la asociación entre los niveles de citoquinas séricas después de la LCAP y la aparición de la ISQ.
Como se muestra en la figura 7, el TNF-α sérico después de la LCAP mostró una tendencia hacia niveles más altos en los pacientes que desarrollaron ISQ que en los que no lo hicieron (P=0,0714).
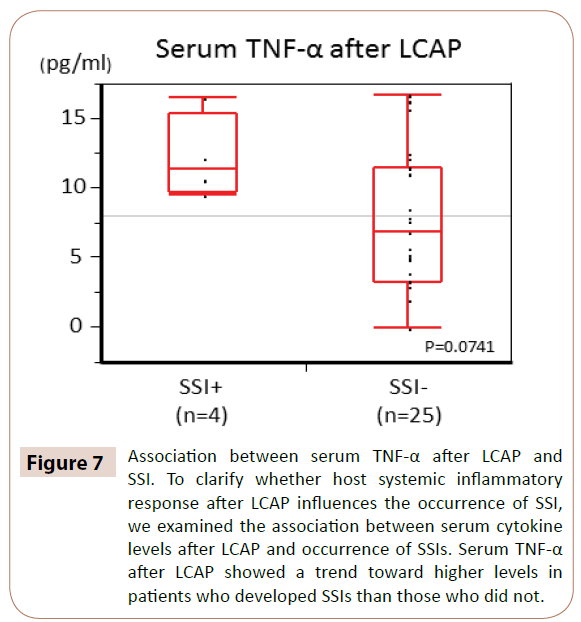
Figura 7: Asociación entre el TNF-α sérico después de la LCAP y la ISQ. Para aclarar si la respuesta inflamatoria sistémica del huésped tras la LCAP influye en la aparición de ISQ, examinamos la asociación entre los niveles de citoquinas séricas tras la LCAP y la aparición de ISQ. El TNF-α sérico después de la LCAP mostró una tendencia a niveles más altos en los pacientes que desarrollaron ISQ que en los que no lo hicieron.
No hubo diferencias significativas entre los niveles séricos de IL-6, IL-8 e IL-1Ra después de la LCAP y la aparición de ISQ.
Discusión
Se han descrito varios mecanismos posibles de acción de la LCAP o la GMA, aunque sus mecanismos exactos no se han investigado completamente. La variabilidad de los resultados parece depender de las diferencias en las células sanguíneas utilizadas para los análisis (granulocitos, monocitos o linfocitos), los métodos de toma de muestras de sangre (tomadas de la línea de entrada o salida, o de la vena periférica) y los sujetos del estudio (voluntarios sanos o pacientes enfermos).
La mayoría de los investigadores utilizaron leucocitos como neutrófilos, monocitos o linfocitos tomados de las líneas de entrada y salida de un dispositivo de circulación extracorpórea . Los leucocitos de las líneas de salida son las células restantes filtradas por la LCAP. Se devuelven a la circulación sistémica de los pacientes inmediatamente, y se vuelven a mezclar con los leucocitos circulantes. Los leucocitos de las líneas de salida son la pequeña proporción de todos los leucocitos circulantes después de la LCAP. Para aclarar el efecto sistémico de la LCAP en el sistema inmunitario del huésped, utilizamos neutrófilos circulantes aislados de las venas periféricas de pacientes con CU.
En sentido estricto, la leucocitaféresis (LCAP) debería denominarse leucocitafiltración porque no sólo puede eliminar los leucocitos sino también activarlos a través del filtro. De hecho, la LCAP no puede absorber y eliminar todas las células sanguíneas que entran en ella. Un cierto número de células sanguíneas puede atravesar el filtro y volver a la circulación. Se cree que las células sanguíneas filtradas son activadas por la filtración de la LCAP.
Los neutrófilos son la población más abundante de leucocitos y las células más eficazmente eliminadas por la LCAP. El número estimado de leucocitos filtrados es de casi 1,1 × 1010 células por cada sesión de LCAP , lo que podría ser comparable a la eliminación de casi la mitad del número de neutrófilos circulantes (2 × 10-3 × 1010 células). Así pues, investigamos la diferencia funcional entre los neutrófilos pre-LCAP y post-LCAP con respecto a la respuesta a E. coli para aclarar los posibles mecanismos de la observación clínica de que la LCAP postoperatoria reducía la incidencia de ISQ. Sin embargo, la LCAP con Cellsorba puede eliminar y activar no sólo los neutrófilos, sino también las demás células sanguíneas (monocitos, linfocitos y plaquetas) con una eficacia de eliminación diferente. Por lo tanto, es necesario investigar el cambio de la respuesta a E. coli no sólo en los neutrófilos, sino también en las otras células sanguíneas entre pre y post-LCAP, aunque no se evaluaron en este estudio.
Uno de los resultados más significativos del presente estudio fue el hecho de que el porcentaje de neutrófilos necróticos se redujo significativamente cuando los neutrófilos post-LCAP se co-cultivaron con E. coli, en comparación con los neutrófilos pre-LCAP. Esta observación sugiere que la LCAP disminuye la proporción de neutrófilos que inducen a la necrosis por E. coli, y aumenta la proporción de neutrófilos viables (probablemente no cebados) en la circulación sistémica.
Se observó una amplia variación del porcentaje de viabilidad, apoptosis o necrosis de los neutrófilos en cocultivo con E. coli. En nuestros recientes datos no publicados, el porcentaje de apoptosis temprana (Annexin V+, PI-) en los neutrófilos circulantes osciló ampliamente entre aproximadamente el 10% y el 90% en pacientes con inflamación sistémica como la elevación de la proteína C reactiva >0,3 mg/L. Estas observaciones sugieren que los neutrófilos pueden ser ya apoptóticos sin el cocultivo de E. coli debido a los insultos quirúrgicos más elevados.
Se cree que la necrosis es una muerte celular incontrolada, y parece que libera especies tóxicas de oxígeno y enzimas proteolíticas de forma inesperada . Se sabe que la necrosis de los neutrófilos es la causa principal del daño de las vías respiratorias y los pulmones en los pulmones intensamente inflamados de los pacientes con fibrosis quística . La LCAP postoperatoria puede inducir el reclutamiento de un subconjunto de neutrófilos resistentes a la muerte celular necrótica inesperada o incontrolada contra la infección bacteriana en la circulación sistémica, además de la eliminación de los leucocitos activados que causan la inflamación sistémica.
En contraste con los resultados anteriores de los experimentos ex vivo, la NE sérica después de la LCAP aumentó significativamente. No se observó la reducción inmediata de la NE sérica por la LCAP. Una posible explicación de esto es que una sola sesión de LCAP puede no suprimir suficientemente la liberación de NE de los neutrófilos de todo el cuerpo en la inflamación sistémica inducida por la cirugía
Los neutrófilos circulantes después de la LCAP aislados de pacientes con un tiempo de operación más largo (>3 h) o un mayor recuento de neutrófilos postoperatorios (>16.750/mm3; valor mediano) mostraron no sólo una mayor actividad de producción de NE o TNF-α, sino también una menor actividad fagocítica contra E. coli. Estos hallazgos sugieren que los neutrófilos aislados de pacientes con alto estrés quirúrgico muestran una producción excesiva de citoquinas proinflamatorias o una actividad fagocítica deteriorada, incluso después de la renovación de los neutrófilos por la LCAP postoperatoria.
Entre los 29 pacientes de CU con LCAP postoperatoria, sólo cuatro pacientes (13,8%) desarrollaron ISQ. Su TNF-α sérico después de la LCAP fue más alto que el de aquellos sin ISQ, aunque la diferencia no alcanzó significación estadística. Por lo tanto, el TNF-α sérico puede ser útil para identificar a los pacientes que desarrollarán ISQ después de la LCAP postoperatoria. Sin embargo, no se observó ninguna asociación entre el desarrollo de ISQ y la viabilidad, la apoptosis o la necrosis de los neutrófilos en co-cultivo con E. coli, lo que puede deberse en parte al pequeño tamaño de la muestra.
Recientemente, se ha reconocido que los neutrófilos circulantes son una población funcionalmente heterogénea y diferencialmente preparada contra diversos insultos . Hemos informado de la importancia clínica de los neutrófilos circulantes en la inflamación sistémica . Creemos que los neutrófilos circulantes pueden ser el objetivo principal para explorar el efecto sistémico de la LCAP en el sistema inmunitario del huésped.
Además, algunos investigadores han informado de que la leucodepleción, que elimina las células polimorfonucleares de la circulación sistémica utilizando filtros de leucocitos, conduce a una mejora significativa de la función pulmonar y renal de los pacientes que desarrollan el síndrome de respuesta inflamatoria sistémica (SIRS) después del bypass cardiopulmonar . La leucodepleción dirigida a los neutrófilos puede ser beneficiosa para prevenir el fallo orgánico debido al SIRS.
En conclusión, se cree que éste es el primer informe que demuestra que la LCAP postoperatoria disminuye el subconjunto de neutrófilos circulantes que inducen la necrosis contra la infección bacteriana. Puede ser beneficioso para la prevención de la ISQ reducir la muerte celular necrótica inesperada o incontrolada causada por la liberación de sustancias tóxicas o proteolíticas en la circulación sistémica.
Agradecimiento
Los autores agradecen a Motoko Ueeda y Chihiro Hibi su excelente asistencia técnica.
Contribución de los autores
K.T., T.A. y M.K. diseñaron y realizaron los experimentos, analizaron e interpretaron los datos y redactaron el manuscrito. S.Y., Y.O. y S.K. realizaron los experimentos y analizaron los datos. Y.T., M.I., M.O., M.K., Y.I., K.U. y Y.M. diseñaron los experimentos y analizaron e interpretaron los datos. C.M. y M.K. diseñaron los experimentos e interpretaron los datos.
Subvenciones y divulgación de acuerdos financieros
Este trabajo fue apoyado en parte por subvenciones del Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología de Japón (KAKENHI 23791523 a S.Y., 25861181 a Y.O., y 24791887 a M.I.).
- Summers C, Rankin SM, Condliffe AM,Singh N, Peters AM, et al. (2010) Neutrophil kinetics in health and disease. Trends Immunol31:318-324.
- Geering B, Stoeckle C, Conus S, Simon HU (2013) Vivir y morir por la inflamación: neutrófilos, eosinófilos, basófilos. Trends Immunol34:398-409.
- Jaillon S, Galdiero MR, Del Prete D, Cassatella MA, Garlanda C,et al. (2013) Neutrophils in innate and adaptive immunity. SeminImmunopathol35:377-394.
- Aziz M, Jacob A, Yang WL, Matsuda A, Wang P (2013) Current trends in inflammatory and immunomodulatory mediators in sepsis. J LeukocBiol93:329-342.
- Taylor NJ, Nishtala A, Manakkat Vijay GK,Abeles RD, Auzinger G, et al. (2013) Circulating neutrophil dysfunction in acute liver failure. Hepatology57:1142-1152.
- Fukunaga K, Matsumoto T (2012) Estado actual y perspectivas futuras de la leucocitaféresis para la enfermedad inflamatoria intestinal. J GastroenterolHepatol27:997-1003.
- Nakano R, Iwakiri R, Ikeda Y,Kishi T, Tsuruoka N, et al. (2013) Factores que afectan a los efectos a corto y largo plazo de la terapia de eliminación de leucocitos en la colitis ulcerosa activa. J GastroenterolHepatol28:303-308.
- Ueki Y, Yamasaki S, Kanamoto Y,Kawazu T, Yano M, et al. (2000) Evaluación de la leucocitaféresis por filtración para su uso en el tratamiento de pacientes con artritis reumatoide. Rheumatology (Oxford)39:165-171.
- Shirokaze J (2002) Leukocytapheresis using a leukocyte removal filter. TherApher6: 261-266.
- Shibata H, Kuriyama T, Yamawaki N (2003) Cellsorba. TherApher Dial 7:44-47.
- Hanai H, Iida T, Ikeya K, Abe J, Maruyama Y, et al. (2013) Un nuevo paradigma en la colitis ulcerosa: las células T reguladoras son el factor clave que induce/exacerba la CU a través de un desequilibrio inmunológico. MolImmunol54:173-180.
- Kashiwagi N, Sugimura K, Koiwai H, Yamamoto H, Yoshikawa T,et al. (2002)Efectos inmunomoduladores de la aféresis de adsorción de granulocitos y monocitos como tratamiento para pacientes con colitis ulcerosa. Dig Dis Sci47:1334-1341.
- Ramlow W, Emmrich J, Ahrenholz P, Sparmann G, Kashiwagi N,et al. (2005) Evaluación in vitro e in vivo de Adacolumncytapheresis en sujetos sanos. J ClinApher20:72-80.
- Korol E, Johnston K, Waser N, FrangiscosSifakis, Hasan S J, et al. (2013)Una revisión sistemática de los factores de riesgo asociados con las infecciones del sitio quirúrgico entre los pacientes quirúrgicos. PLoS One 8:e83743.
- Araki T, Okita Y, Uchino M, Ikeuchi H, Sasaki I, et al. (2013) Factores de riesgo de infección del sitio quirúrgico en pacientes japoneses con colitis ulcerosa: un estudio prospectivo multicéntrico. Surg Today.
- Miki C, Okita Y, Yoshiyama S,Araki T, Uchida K, et al. (2007)Aplicación postoperatoria temprana de aféresis leucocitaria extracorpórea en pacientes con colitis ulcerosa: resultados de un ensayo piloto para prevenir complicaciones sépticas postoperatorias. J Gastroenterol42:508-509.
- Itabashi M, Ikeuchi H, Araki T, Kono T, Nakamura T, et al. (2008) Effectiveness of leukocytapheresis in suppressing the occurrence of surgical site infections following surgery for ulcerative colitis. Surg Today 38:609-617.
- Miki C, Yoshiyama S, Okita Y, Araki T, Uchida K,et al. (2006) Neutrophil priming as a surgery-related risk factor for postoperative infectious complications in patients with ulcerative colitis. Dig Surg 23:179-185.
- Miki C, Ohmori Y, Yoshiyama S, Toiyama Y, Araki T,et al. (2007) Factores que predicen las complicaciones infecciosas postoperatorias y la inducción temprana de mediadores inflamatorios en pacientes con colitis ulcerosa. World J Surg 31:522-529.
- Yoshiyama S, Miki C, Okita Y, Araki T, Uchida K,et al. (2008) Neutrophil-related immunoinflammatory disturbance in steroid-overdosed ulcerative colitis patients. J Gastroenterol43:789-797.
- Okita Y, Miki C, Yoshiyama S,Otake K, Araki T, et al. (2011) Neutrophil dysfunction in steroid-overdosed patients with ulcerative colitis: potential relevance of macrophage migration inhibitory factor to increased postoperative morbidity. Surg Today 41:1504-1511.
- Kroemer G, Galluzzi L, Vandenabeele P, J Abrams, ES Alnemri, et al. (2009) Nomenclature Committee on Cell Death 2009. Clasificación de la muerte celular: recomendaciones del Comité de Nomenclatura sobre Muerte Celular 2009. Cell Death Differ 16:3-11.
- van den Berg CW, Tambourgi DV, Clark HW, Hoong SJ, Spiller OB, et al. (2014)Mechanism of neutrophil dysfunction: neutrophil serine proteases cleave and inactivate the C5a receptor. J Immunol192:1787-1795.
- Rydell-Törmänen K, Uller L, Erjefält JS (2006)Evidencia directa de la necrosis secundaria de los neutrófilos durante la inflamación pulmonar intensa. EurRespir J 28:268-274.
- TsaoFH, Xiang Z, Abbasi A, Meyer KC (2012) Necrosis de neutrófilos y degradación de anexina 1 asociada a la inflamación de las vías respiratorias en receptores de trasplantes de pulmón con fibrosis quística. BMC Pulm Med 12:44.
- Pillay J, Ramakers BP, Kamp VM,Hoong SJ, Spiller OB, et al. (2010) Functional heterogeneity and differential priming of circulating neutrophils in human experimental endotoxemia. J LeukocBiol88:211-220.
- Mócsai A (2013)Diversas funciones novedosas de los neutrófilos en la inmunidad, la inflamación y más allá. J Exp Med 210:1283-1299.
- Treacher DF, Sabbato M, Brown KA, Gant V (2001)Los efectos de la leucodepleción en pacientes que desarrollan el síndrome de respuesta inflamatoria sistémica después del bypass cardiopulmonar. Perfusión. 16:67-73.
- Lewis SM, Khan N, Beale R, Treacher DF, Brown KA (2013) Depleción de neutrófilos en sangre de pacientes con sepsis: ¿tratamiento para el futuro? IntImmunopharmacol17:1226-1232.