Introducción
El cáncer de próstata es la forma más común de neoplasia y la segunda causa de muerte por cáncer entre los hombres.1 Los estudios cadavéricos demuestran que la posibilidad de desarrollar microfocos de cáncer de próstata aumenta con la edad (30% en la cuarta década de la vida, 40% en la quinta década, etc.).2
Mientras que algunos cánceres son agresivos, otros tienen poco o ningún potencial metastásico.3 Muchos hombres con cáncer de próstata de bajo riesgo no progresarán ni se volverán clínicamente sintomáticos durante su vida.4 Debido a esta variabilidad, se han introducido diferentes opciones de tratamiento que ofrecen efectos terapéuticos comparables a los de la prostatectomía radical (PR), preservando al mismo tiempo la función sexual y la continencia. En este escenario, la vigilancia activa (EA) puede ofrecer una reducción de la morbilidad y una mejora de la calidad de vida.5 Los tumores pequeños y no agresivos son los candidatos ideales para la EA, aunque no se ha alcanzado un consenso. La enfermedad de bajo riesgo se define como puntuación de Gleason (GS) 6 y antígeno prostático específico (PSA)
ng/ml. Los pacientes con un estadio clínico >T2a suelen quedar excluidos.6
El grado histológico es un determinante independiente del pronóstico de la enfermedad y de la supervivencia.7 El sistema de gradación de la GS es la clasificación más ampliamente aceptada,8 pero muchos estudios han demostrado que la GS obtenida en la biopsia de próstata no siempre se correlaciona con el grado patológico final de las muestras quirúrgicas. Se ha notificado una mejora de la GS (aumento de la GS de al menos un punto) en hasta el 57% de los casos.9,10 Los errores en la asignación de la GS pueden conducir a una vigilancia inadecuada de los tumores biológicamente agresivos, o a la selección de tratamientos con tasas de curación inferiores en la enfermedad de alto riesgo, lo que en última instancia puede tener un impacto negativo en los resultados de los pacientes.11 Por lo tanto, varios estudios recientes han buscado factores que puedan predecir la progresión de la SG.12
El bajo volumen prostático (VP) y, más concretamente, la alta densidad del antígeno prostático específico (DAP) han demostrado ser predictores de la progresión del riesgo en muchos estudios, reflejando la posibilidad de un cáncer agresivo no detectado.6 Varios estudios han demostrado una fuerte relación entre el PSAD y la agresividad del cáncer de próstata.13 El PSAD se ha propuesto como un fuerte predictor de la progresión de la SG en pacientes con enfermedad de Gleason 6 confirmada por biopsia, pero no existe un consenso general sobre el valor de corte.11-17
El objetivo principal de nuestro estudio fue identificar los predictores independientes de la mejora de la SG y determinar el mejor valor de corte de la PSAD para identificar a los pacientes de riesgo.
Materiales y métodos
Recogimos la información del estudio de la base de datos mantenida prospectivamente en nuestro centro hospitalario. Se seleccionaron los pacientes con cáncer de próstata clínicamente localizado que se sometieron a una prostatectomía radical (PR) y tuvieron una biopsia de próstata preoperatoria dentro del marco de tiempo de enero de 2004 a febrero de 2015. Se tomó como criterio de inclusión la detección de GS 3+3 en la biopsia de próstata. Toda la información clínica, de imagen, de laboratorio y patológica se obtuvo de la base de datos y se corroboró con las historias clínicas de los pacientes.
Incluimos la edad preoperatoria del paciente, el estadio clínico de la enfermedad, el PSA previo a la biopsia, el PSAD preoperatorio, la GS de la biopsia, el número total de núcleos de biopsia tomados y el número de núcleos de biopsia con cáncer y analizamos la asociación de estos factores con la mejora de la GS tras la RP. Se utilizaron diferentes valores de corte para cada variable con el fin de identificar y cuantificar una posible relación con el aumento de Gleason. También se analizó la asociación de la mejora de la SG con las variables del síndrome metabólico, como la diabetes mellitus (DM), la hipertensión arterial (HBP) y la obesidad, que se obtuvieron de las historias clínicas de los pacientes. Estas últimas variables se incluyeron porque estudios previos han demostrado su asociación con un peor pronóstico y una mayor tasa de recidiva.18,19
La PSA se calculó dividiendo el valor de PSA preoperatorio por el PV. El PV se calculó mediante ecografía transrectal utilizando el diámetro transversal máximo (D1), el diámetro anteroposterior máximo (D2) y el diámetro longitudinal máximo (D3), utilizando la fórmula D1×D2×D3×ϖ/6 basada en la teoría de la dimensión de la elipse de la próstata.14 La biopsia de próstata se realizó utilizando el protocolo descrito previamente en nuestro hospital. Todos los pacientes fueron ligeramente sedados y se administró una única dosis i.v. de piperacilina/tazobactam 15 minutos antes del procedimiento.20 Utilizamos una aguja de calibre 18 con una pistola de biopsia automática para obtener el tejido prostático. Para la primera biopsia, se extrajeron entre 12 y 18 núcleos, dependiendo del tamaño de la próstata y de la presencia de nódulos sospechosos.21 Todas las muestras se colocaron en un recipiente separado que identificaba el lugar correspondiente y se enviaron al servicio de patología de nuestro hospital.
Las estadísticas descriptivas se presentaron como media±desviación estándar (DE) y mediana/IQR para las variables continuas y como frecuencia absoluta y porcentaje de distribución para las variables categóricas. Se comparó a los pacientes que pasaron a GS 7 o superior después de la operación con los que no pasaron. Para determinar las diferencias medias y las similitudes, las variables categóricas se compararon mediante la prueba de chi-cuadrado de Pearson y las variables continuas con la prueba de la mediana y la prueba t de Student. Se utilizó una prueba de regresión univariante para detectar predictores independientes significativos de la mejora. Se utilizó una curva de características operativas del receptor (ROC) y se calculó el área bajo la curva (AUC) para mostrar el valor de corte óptimo de las variables con significación predictiva para la mejora de la SG. Se estimó la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo de diferentes puntos de corte propuestos por otros autores, se aplicaron a nuestra población y se compararon con nuestro valor de corte. Todas las pruebas fueron de dos colas y un valor p de
Resultados
De un total de 342 pacientes de nuestra base de datos, 144 (42,1%) fueron excluidos por tener una GS ≥4 en la biopsia de próstata. Esto dejó 198 (57,9%) pacientes que cumplían nuestros criterios de inclusión de GS 6 (3+3). Setenta y tres de esos pacientes fueron excluidos debido a que la información clínica de las historias clínicas era incompleta.
La edad media de los pacientes fue de 65,1±6,3 años, el índice de masa corporal (IMC) fue de 26,7±3,6kg/m2, el número de núcleos tomados fue de 13,4±3,5, el número de núcleos positivos fue de 2,5±2, y el PSAD preoperatorio fue de 0,26±0,23ng/ml2. La mediana preoperatoria del PSA fue de 7,2 IQR 5,67-10,05 y el PV fue de 38 IQR 26,5-55,5. El estadio clínico basado en el tacto rectal fue T1c en 86 (69,6%) pacientes, T2a en 28 (22,4%), T2b en 7 (5,6%), T2c en 2 (1,6%) y T3 en un (0,8%) paciente.
El PSA preoperatorio se clasificó como sigue: 6 (4,8%) pacientes tenían valores de PSA
ng/ml, 88 (70,4%) estaban entre 4 y 9,9ng/ml, 23 (18,4%) estaban entre 10 y 19,9ng/ml, y 8 (6,4%) tenían PSA ≥20ng/ml. La GS de la biopsia y la GS quirúrgica se mantuvieron iguales en 71 (56,8%) pacientes con GS 3+3, mientras que 54 (43,2%) pacientes tuvieron una mejora. De los pacientes con actualización, el 70% ascendió a una GS de 7 y el 30% aumentó a ≥8.
La tabla 1 muestra las características demográficas y clínicas de los pacientes con y sin actualización de la GS. Encontramos una correlación estadísticamente significativa entre la mejora postoperatoria y el valor de PSAD preoperatorio (p0,001), el PSA preoperatorio (p=0,039), el PV (p=0,004) y la edad del paciente ≥70 años (p=0.011).
Características de los pacientes con y sin mejora de la puntuación de Gleason tras la prostatectomía radical.
| Características | Subida de puntuación | Sin subida de puntuación | Valor p |
|---|---|---|---|
| No. de pacientes (%) | 54 (43,2%) | 71 (56.8%) | |
| Edad (años) | |||
| Media±SD | 66.22±6,5 | 64,28±6,0 | 0,092b |
| Edad (años)) | |||
| >70 años de edad | 20 | 12 | 0.011*,a |
| 34 | 59 | ||
| IMC (kg/m2) | |||
| Media±SD | 26.22±4,0 | 27,14±3,1 | 0,178c |
| PSA (ng/ml) | |||
| Mediana/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c |
| Volumen prostático (ml) | |||
| Mediana/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c |
| PSAD (ng/ml2) | |||
| Media±SD | .36±.27 | .19±.16 | *,c |
| Núcleos de biopsia (n.) | |||
| Media±SD | 12,9±3,4 | 13,7±3,7 | 0.240c |
| Núcleos positivos (nº) | |||
| Media±SD | 2.9±2,4 | 2,1±1,6 | 0,0702c |
| Obesidad (nº) | |||
| Positivos | 9 (16,6%) | 16 (22,5%) | 0.500a |
| Negativa | 45 (83,4%) | 55 (77.5%) | |
| DM (nº) | |||
| Positivos | 16 (29,6%) | 14 (19.7%) | 0.150a |
| Negativa | 38 (70.4%) | 57 (80.3%) | |
| HBP (nº) | |||
| Positiva | 21 (38.9%) | 30 (42,2%) | 0,775a |
| Negativa | 33 (61,1%) | 41 (57.8%) | |
IQR: rango intercuartil; IMC: índice de masa corporal; PSA: antígeno prostático específico; PSAD: densidad del antígeno prostático específico; DM: diabetes mellitus; HBP: hipertensión arterial.
Prueba X2.
Prueba t de Student.
Prueba de la mediana.
Significativo desde el punto de vista estadístico con un valor p
Estimamos un punto de corte óptimo de PSAD de 0.17ng/ml2 mediante el análisis ROC, con un AUC de 0,675 (p=0,001, IC95% .580-.770), y luego analizamos los valores de corte propuestos por otros autores y los comparamos. La Tabla 2 y la Fig. 1 muestran esos resultados.
Análisis de diferentes valores de corte de PSAD como predictor de ascenso de GS.
| Actualización | Sin actualización | p | Odds ratio | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | ||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 |
| 10 (18.5%) | 29 (40.8%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 |
| 11 (20.4%) | 36 (50.7%) | |||||||
| PSAD (no.) | ||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 |
| 13 (24.1%) | 42 (59.2%) | |||||||
| PSAD (nº) | ||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 |
| 18 (33.4%) | 49 (69%) | |||||||
PSAD: antígeno prostático específico.
Test X2.
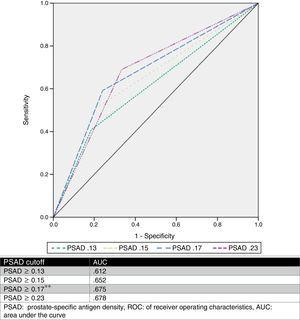
Curva ROC.
La tabla 3 muestra los resultados de la regresión univariante para la detección de predictores independientes de la mejora.
Predictores independientes de la mejora (regresión univariante).
| Características | HR | 95 CI | valor p |
|---|---|---|---|
| Edad | 0.5 | 0,99-1,11 | 0,09 |
| >70 años de edad | 1.06 | 1,26-6,63 | 0,039* |
| MC | 0,072 | 0,97-1.18 | 0,166 |
| PSAD ≥0,13 | 1,11 | 1,32-6,99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0.001* |
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | |
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | |
| PSA | 0,05 | 0,99-1,11 | 0,059 |
| Volumen prostático | 0.02 | 1,01-1,04 | 0,008* |
| Núcleos de biopsia positivos | 0.06 | 0,98-1,18 | 0,24 |
| Obesidad | 0,31 | 0.54-3,40 | 0,507 |
| DM | 0,61 | 0,79-4.27 | 0,152 |
| HBP | 0,10 | 0,53-2,29 | 0.775 |
IMC: índice de masa corporal; PSA: antígeno prostático específico; PSAD: densidad del antígeno prostático específico; DM: diabetes mellitus; HBP: hipertensión arterial.
Discusión
Varios estudios han encontrado una falta de concordancia entre el informe de la GS de la biopsia de próstata y el informe de la prostatectomía radical. En un metaanálisis reciente que incluía a 14.839 pacientes, los autores estimaron un aumento de la SG en el 30% de los pacientes, y sólo el 63% permaneció sin cambios después de la prostatectomía.22 El aumento de la escala de Gleason se ha encontrado en el 29-58% de los casos23 , y es peor en el subgrupo de pacientes con una escala de Gleason 3+3 en la biopsia (hasta el 63,3%).14 En nuestro centro hospitalario, encontramos un aumento de la escala de Gleason en el 42,1% de todos los pacientes sometidos a prostatectomía radical y en el 43,2% de los pacientes con una escala de Gleason 3+3 en la biopsia.
Muchos autores han tratado de encontrar predictores de aumento de la escala de Gleason, especialmente con la creciente popularidad de los protocolos de AS. Los predictores descritos anteriormente son la edad >60 años, el valor de PSA >5,0ng/ml y >25% de núcleos positivos durante la biopsia.24
Se ha analizado el PSA y se han descrito varios valores de corte (como ≥0,13ng/ml, ≥0,15ng/ml y ≥0,23ng/ml).11,13,16,17 Sin embargo, no hay consenso sobre el uso de este valor para predecir con exactitud un aumento de la SG. Basándonos en nuestros resultados, propusimos un valor de corte de ≥0,17ng/ml, que tenía un AUC de 0,675, una sensibilidad del 75,9%, una especificidad del 59,2%, un VPP del 58,5% y un VPN del 76,3% para la predicción del aumento de la SG. Seleccionamos este punto de corte, porque al analizar otros valores propuestos en relación con nuestra serie de casos, el mejor AUC se obtuvo con un valor ≥0,23ng/ml (0,678), pero tenía una peor sensibilidad y una elevada tasa de falsos negativos (33,33%). Por otro lado, cuando se utilizaron los valores ≥0,13ng/ml y ≥0,15ng/ml, tuvieron una tasa de falsos positivos del 59% y del 49%, respectivamente. La tasa de falsos negativos y la tasa de falsos positivos del punto de corte propuesto por nuestro equipo fue del 24% y el 41%, respectivamente, que consideramos el más útil. La Fig. 2 muestra un gráfico de nuestra población.

La población del estudio, mostrando las diferentes densidades de antígeno específico de la próstata y los datos de actualización.
Nuestro estudio incluyó sólo a pacientes con una GS de 3+3 en la biopsia, debido a la importancia de esta variable a la hora de considerar a un paciente para AS. Dado que hay otros factores que se tienen en cuenta para la vigilancia activa, no podemos declarar que el riesgo de aumento de GS y la PSAD sean variables determinantes para proponer una estrategia terapéutica, pero definitivamente creemos que deben ser discutidos antes de tomar una decisión. En los pacientes con una PSAD ≥0,17ng/ml podría estar indicada una segunda biopsia, teniendo en cuenta el riesgo de subclasificación, para corroborar la GS. La resonancia magnética de próstata y las biopsias de fusión guiadas por resonancia magnética han demostrado una alta sensibilidad y especificidad para localizar un cáncer significativo no identificado25. Sin embargo, estas opciones no están ampliamente disponibles en México, por lo que la saturación guiada por ultrasonido transrectal o la biopsia de plantilla podrían ser una opción más viable para aumentar la precisión diagnóstica.
Evidencias recientes han sugerido una asociación entre los diferentes componentes del síndrome metabólico y el cáncer de próstata, aumentando el riesgo de presentar la enfermedad y morir por ella,21 así como una mayor tasa de recurrencia bioquímica después del tratamiento radical.22 Sin embargo, en nuestro estudio no pudimos demostrar una asociación con el aumento de la puntuación de Gleason.
El volumen de la próstata, que está directamente relacionado con la edad, podría ser un elemento distractor. Cuando se realiza una biopsia aleatoria guiada por ecografía en una próstata de gran tamaño, existe el riesgo potencial de dejar zonas más grandes sin muestrear, lo que representa un mayor riesgo de pasar por alto un tumor significativo.
La AS ha proporcionado resultados prometedores en pacientes con cáncer de próstata de bajo riesgo, con mejoras en la calidad de vida, la preservación de la función eréctil y la continencia urinaria, y en otras complicaciones asociadas a los tratamientos radicales.6 Sin embargo, existe el riesgo de diagnosticar erróneamente un cáncer agresivo y retrasar el tratamiento oportuno, lo que afecta al pronóstico del paciente. Existen muchos criterios para seleccionar a los candidatos a AS, siendo la clasificación de riesgo de D’Amico26 y los criterios de Epstein27 los más utilizados para este fin. La primera no incluye el PSAD, pero en los criterios de Epstein se sugiere el uso de un valor de corte ≥0,15ng/ml. En nuestro hospital, utilizamos criterios muy estrictos y el valor de corte de PSAD ≥0,17ng/ml se incluirá como parte de la discusión a la hora de seleccionar un posible candidato a AS.
El carácter retrospectivo de nuestro estudio fue su principal limitación. La muestra potencial se redujo aún más debido a los datos incompletos de las historias clínicas. Otra limitación fue el hecho de no disponer de todos los datos de las muestras de biopsia, por lo que no pudimos analizar a los pacientes con los criterios completos de EA. Sin embargo, con la cantidad de pacientes incluidos en el estudio, se obtuvieron resultados significativos y éstos pueden utilizarse para considerar el riesgo de mejora de la GS en pacientes con GS 3+3.
Conclusiones
Concluimos que es importante utilizar tantas herramientas como sea posible para tomar decisiones precisas e identificar a los pacientes con alto riesgo de mejora patológica que podrían beneficiarse de una evaluación más meticulosa y/o un tratamiento agresivo. La PSAD debería utilizarse de forma rutinaria para identificar a los pacientes con cáncer de aparente bajo riesgo de aumento de la SG, lo que daría lugar a una selección más precisa de los candidatos a la AS. Según nuestros datos, podemos evitar una estadificación de GS potencialmente incorrecta en aproximadamente el 43% de los casos.
Encontramos una alta frecuencia de aumento de GS en nuestra población. En nuestro estudio, los valores de PSAD se asociaron significativamente con la actualización y el valor de corte más preciso fue de 0,17ng/ml2. Recomendamos que se lleve a cabo una revisión local del riesgo de aumento de la SG y sus posibles predictores en todos los centros hospitalarios antes de ofrecer la vigilancia activa a los posibles candidatos.
Divulgaciones éticasProtección de los sujetos humanos y animales
Los autores declaran que no se han realizado experimentos en seres humanos ni en animales para este estudio.
Confidencialidad de los datos
Los autores declaran que no aparecen datos de pacientes en este artículo.
Derecho a la intimidad y consentimiento informado
Los autores declaran que no aparecen datos de pacientes en este artículo.
Financiación
No se ha recibido ningún tipo de apoyo para realizar este artículo.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses, ni han recibido ningún patrocinio para el estudio.