El agua del grifo contiene gases atmosféricos, como el nitrógeno y el oxígeno, disueltos en ella. Cuando el vaso lleno de agua permanece fuera durante unas horas, su temperatura aumenta ligeramente (el agua se calienta), lo que hace que los gases disueltos en ella salgan del agua y formen burbujas a lo largo del interior del vaso.
Llene un vaso con agua (a temperatura ambiente o inferior) y déjelo sin tocar durante unas horas (puede hacerlo con agua del grifo). Con el tiempo notará que empiezan a aparecer burbujas muy pequeñas a lo largo del lado del vaso (en el interior). ¿Por qué ocurre esto?

- Solubilidad de los gases en el agua
- Los gases son más solubles en el agua a temperaturas más frías
- Peligro para la vida acuática debido al cambio de la temperatura del agua
- La solubilidad de los gases en el agua aumenta con el incremento de la presión
- Ley de Henry
- Por qué se forman burbujas en un vaso lleno de agua durante la noche
Solubilidad de los gases en el agua
El agua que sale de los grifos y canillas viaja por las tuberías antes de llegar a los grandes depósitos de almacenamiento. Por eso el agua está a una presión más alta de lo normal (mientras está en las tuberías), y también está más fría. Estas dos condiciones son ideales para que disuelva ciertos gases que se encuentran abundantemente en nuestra atmósfera, entre ellos el nitrógeno y el oxígeno.
Los gases son más solubles en el agua a temperaturas más frías
Los gases, en general, son más solubles en el agua cuando ésta se encuentra a una temperatura más baja. En otras palabras, se puede decir que la solubilidad de los gases en el agua disminuye a medida que aumenta la temperatura del agua. El siguiente gráfico debería ayudar a visualizar cómo varía la solubilidad de los gases con el cambio de temperatura.
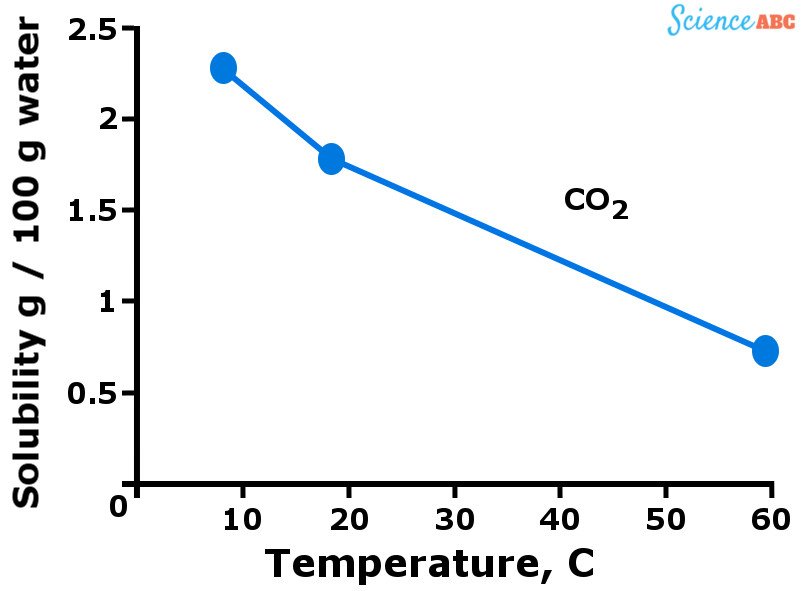
La variación de la solubilidad del dióxido de carbono en el agua con el aumento de la temperatura
La tendencia a la baja de la solubilidad de los gases con el aumento de la temperatura es bastante similar a cómo aumenta la presión de vapor con la temperatura. Como ves, se disuelven más moléculas de gas en el agua cuando está fría. Sin embargo, cuando el agua empieza a calentarse (es decir, la temperatura aumenta), la energía cinética de las moléculas de gas también aumenta.
Esto permite que esas moléculas se muevan más libremente y rompan los enlaces intermoleculares que las mantienen unidas, escapando así de la solución. Por eso la solubilidad de los gases disminuye a medida que aumenta la temperatura.
Peligro para la vida acuática debido al cambio de la temperatura del agua
La dependencia de la temperatura de la solubilidad de los gases en el agua tiene una implicación directa en la vida de las criaturas acuáticas. Verás, las criaturas acuáticas como los peces necesitan oxígeno para sobrevivir, y lo obtienen del agua en la que viven absorbiendo el oxígeno disuelto (en el agua) a través de sus branquias. Dado que el oxígeno es más soluble en aguas más frías, es crucial que la temperatura no aumente más allá de un determinado límite.

Los productos de desecho liberados por las centrales eléctricas aumentan la temperatura del agua, poniendo en peligro la vida marina (Crédito de la foto: Flickr)
Sin embargo, eso es exactamente lo que está ocurriendo hoy en día, en gran parte debido a las actividades humanas. Las centrales eléctricas, por ejemplo, vierten enormes volúmenes de agua caliente en grandes masas de agua, lo que eleva la temperatura del agua y afecta drásticamente a la vida acuática. Ese es un resultado muy indeseable de esa dependencia de la temperatura de la solubilidad de los gases.
La solubilidad de los gases en el agua aumenta con el incremento de la presión
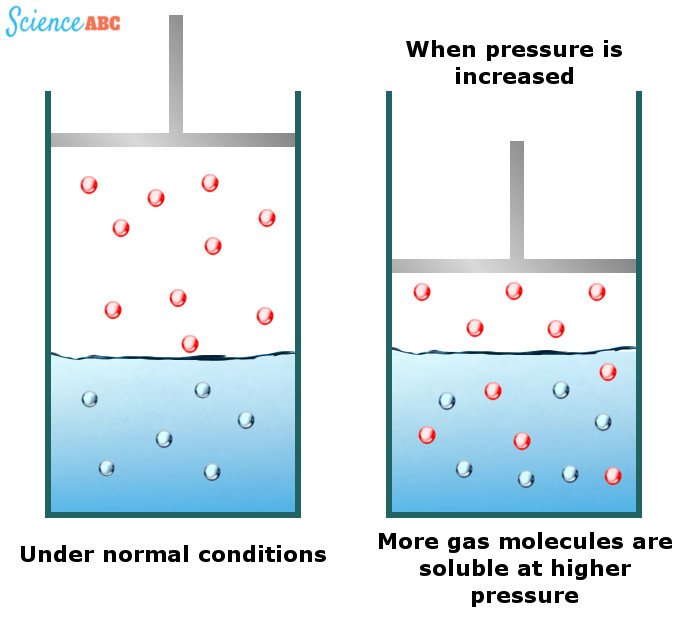
Aunque los líquidos y los sólidos no muestran prácticamente ningún cambio de solubilidad con el cambio de la presión del agua, los gases sí. Se ha observado que los gases son más solubles en el agua a mayores presiones. Las bebidas carbonatadas son excelentes ejemplos de este fenómeno.
Ley de Henry
Los efectos del cambio de la presión del agua en la solubilidad de los gases pueden explicarse mediante una de las leyes de los gases conocida como ley de Henry. Ésta establece que «la cantidad de gas disuelto es proporcional a su presión parcial en la fase gaseosa»
La forma más sencilla de explicar esta dependencia es que a medida que la presión aumenta, las moléculas de gas son forzadas a entrar en la solución para que la presión aplicada pueda aliviarse. La siguiente imagen debería ayudar a visualizar esto mejor:
Por qué se forman burbujas en un vaso lleno de agua durante la noche
Debido a los dos fenómenos físicos que comentamos anteriormente, el agua del grifo se convierte en un buen candidato (si no ideal) para mantener los gases atmosféricos disueltos. Sin embargo, cuando esa agua se vierte en un vaso y se deja durante unas horas a temperatura ambiente, su presión empieza a disminuir, mientras que su temperatura comienza a aumentar.

Se forman pequeñas burbujas en un vaso de agua durante la noche (Photo Credit : )
Esto hace que los gases disueltos en el agua salgan de la solución y formen burbujas en las asperezas del interior del vaso. Como el cambio de temperatura no es tan rápido (es decir, el agua no pasa de estar fría a estar muy caliente en pocos minutos), pasan unas horas antes de que las burbujas empiecen a aparecer en el vaso.