Fondos
Principio:
El salicilato de metilo (aceite de gaulteria) es un éster orgánico. Cuando un ácido (que contiene el grupo -COOH) reacciona con un alcohol (un compuesto que contiene un grupo -OH) se forma un éster. Este tipo de reacción puede conocerse como reacción de condensación porque la pequeña molécula de H2O se elimina de los reactivos mientras que los trozos restantes de los reactivos se condensan para dar el producto principal. Esta reacción también se denomina esterificación, ya que el producto de la reacción es un éster, un compuesto que contiene el grupo COOR.1
Objetivo:
Preparar salicilato de metilo a partir de ácido salicílico.
Reacción:
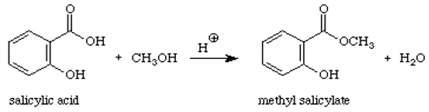
Mecanismo:
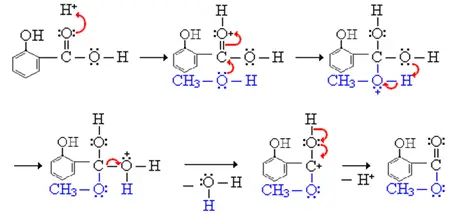
Uso:
Se utiliza para tratar el dolor muscular y articular.
REQUISITOS
Químicos: Ácido salicílico
Metanol seco
Ácido sulfúrico concentrado
Tetracloruro de carbono
Sulfato de magnesio, etc.
Aparato: Matraz de fondo redondo – 500 ml,
Condensador de reflujo
Termómetro
Funnel separador
Vaso de precipitados
Buchner
Cilindro de medida
Papel de filtro
PROCEDIMIENTO
Toma una mezcla de 28 g (0.2 mol) de ácido salicílico, 64 g (81 ml, 2 mol) de metanol seco y 8 ml de ácido sulfúrico concentrado en un matraz de fondo redondo de 500 ml. Poner unos trozos pequeños de porcelana porosa, colocar un condensador de reflujo en el matraz y hervir la mezcla suavemente durante 5 h. Destilar el exceso de alcohol en un baño de agua y dejar enfriar. Verter el residuo en unos 250 ml de agua contenida en un embudo de separación y enjuagar el matraz con unos pocos ml de agua que también se vierten en el embudo de separación. Si, debido a la diferencia comparativamente pequeña entre la densidad del éster y del agua, se experimenta dificultad para obtener una separación nítida de la capa inferior de éster y del agua, añadir 10-15 ml de tetracloruro de carbono (2) y agitar enérgicamente la mezcla de reacción en dicho embudo al ponerse en pie, la solución pesada de salicilato de metilo en el tetracloruro de carbono se separa brusca y rápidamente en el fondo del embudo de decantación. Eliminar la capa inferior con precaución, desechar la capa acuosa superior, devolver el salicilato de metilo al embudo y agitarlo con una solución fuerte de hidrogenocarbonato de sodio hasta que se elimine todo el ácido libre y no haya más evolución de dióxido de carbono. Lavar una vez con agua y secar vertiendo en un pequeño matraz cónico seco que contenga unos 5 g de sulfato de magnesio. Tapar el matraz, agitar durante unos 5 minutos y dejar reposar durante al menos media hora con agitación ocasional. Filtrar la solución de salicilato de metilo a través de un pequeño papel de filtro estriado directamente en un matraz de fondo redondo provisto de un alambique con un termómetro de 360 °C y un condensador de aire. Poner algunas virutas en ebullición y destilar a partir de un baño de aire; aumentar la temperatura lentamente al principio hasta que haya pasado todo el tetracloruro de carbono y luego calentar más fuertemente. Recoger el salicilato de metilo (un aceite incoloro de deliciosa fragancia, «aceite de gaulteria») a 221- 224 °C; el rendimiento es de 25 g (81%). El éster también puede destilarse a presión reducida; la p.a. es de 115 °C/20 mmHg y debe recogerse una fracción de 2 °C.
Cálculo:
Aquí el reactivo limitante es el ácido salicílico; por tanto, el rendimiento debe calcularse a partir de su cantidad tomada.
Fórmula molecular del ácido salicílico = C7H6O3
Fórmula molecular del salicilato de metilo = C8H8O3
Peso molecular del ácido salicílico = 138 g/mol
Peso molecular del salicilato de metilo = 152 g/mol
Rendimiento teórico:
138 g de ácido salicílico forman 152 g de salicilato de metilo
Por tanto, 28 g de ácido salicílico formarán …….? (X) g de salicilato de metilo
X =( 152 ×28)/138 = 30,84 g
Rendimiento teórico = 30.84 g
Rendimiento práctico = —– g
Rendimiento porcentual = (Rendimiento práctico)/(Rendimiento teórico) × 100
CONCLUSIÓN
Se sintetizó salicilato de metilo y el rendimiento porcentual resultó ser………..%