US Pharm. 2008;33(3)(OTC suppl):4-7.
El asma es una enfermedad pulmonar caracterizada por la obstrucción reversible del flujo aéreo y la hiperreactividad bronquial. El rasgo central del asma es la inflamación, que da lugar a episodios recurrentes de sibilancias, tos, dificultad para respirar y opresión en el pecho.1,2 El objetivo del tratamiento es conseguir el control de la enfermedad para mantener una calidad de vida normal.
La carga del asma ha aumentado de forma constante durante las últimas tres décadas. En 1970, aproximadamente el 3% de la población tenía asma, en comparación con el 5,5% y el 7,7% en 1995 y 2005, respectivamente.3 Esta última estimación equivale a aproximadamente 22,2 millones de estadounidenses.2,3 Con el aumento de la prevalencia de esta enfermedad en Estados Unidos, la morbilidad y la mortalidad debidas al asma también están aumentando. En 2004 se atribuyeron al asma 1,8 millones de visitas a los servicios de urgencias, 497.000 hospitalizaciones y 4.055 muertes.3
Tratamiento basado en el control del asma
El Programa Nacional de Educación y Prevención del Asma (NAEPP), una división del Instituto Nacional del Corazón, los Pulmones y la Sangre, publica las Directrices para el Diagnóstico y el Tratamiento del Asma, cuya última actualización es de 2007.2 Las directrices clasifican la gravedad del asma como intermitente o persistente en función de los síntomas y la frecuencia de uso de los medicamentos de alivio rápido. Las personas con asma intermitente tienen síntomas poco frecuentes, por lo que utilizan con poca frecuencia la medicación de alivio rápido y no interfieren con la actividad normal. Si el asma está menos controlada, la gravedad del asma se clasifica como persistente (véase la TABLA 1).
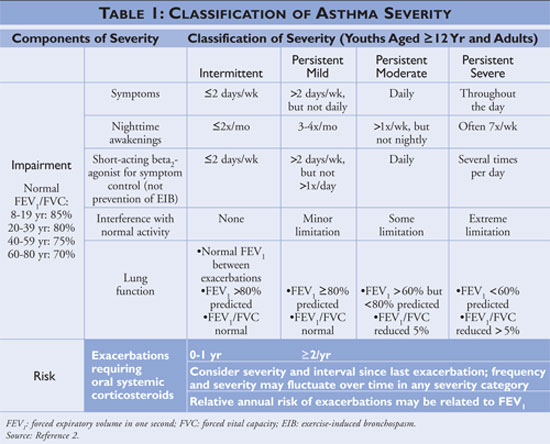
Las directrices describen las piedras angulares del manejo del asma como la educación para el autocontrol, el uso de medicamentos de alivio rápido y el uso de medicamentos de control a largo plazo en individuos con asma persistente. Los profesionales sanitarios que ofrecen educación para el autocontrol deben instruir a los pacientes para que identifiquen y eviten los desencadenantes del asma cuando sea posible, utilicen adecuadamente los tratamientos farmacológicos y diseñen un plan de acción contra el asma. La medicación de alivio rápido debe iniciarse en todos los pacientes diagnosticados de asma y puede utilizarse como monoterapia en individuos con asma intermitente; sin embargo, a los individuos diagnosticados de asma persistente se les debe añadir uno o más medicamentos de control a largo plazo. Los medicamentos de control a largo plazo incluyen los corticosteroides inhalados, los modificadores de los leucotrienos, los beta-agonistas de acción prolongada y la teofilina (véase la TABLA 2).

Las directrices también señalan que aproximadamente el 30% de la población estadounidense utiliza medicamentos e intervenciones complementarias y alternativas. Sin embargo, en la actualidad no existen pruebas suficientes para recomendar estas modalidades de tratamiento para el asma. Las directrices desaconsejan el uso de remedios a base de hierbas para tratar el asma debido a la falta de datos sobre seguridad y eficacia.
Productos de venta sin receta para el asma y su regulación
Los productos de venta sin receta para el asma han estado disponibles desde la década de 1950, aunque algunos de los ingredientes activos han cambiado considerablemente a lo largo de los años. Los principios activos de venta sin receta disponibles actualmente son la efedrina -con o sin guaifenesina- y la epinefrina. La teofilina y el fenobarbital fueron anteriormente ingredientes activos en los productos de venta libre para el asma; sin embargo, ambos están ahora clasificados como productos de prescripción.4
Durante las últimas tres décadas, la FDA ha tomado acciones con respecto a la regulación de los tratamientos de venta libre para el asma. En 1976, la FDA llegó a la conclusión de que la epinefrina inhalada proporcionaba un alivio rápido y eficaz del asma leve a moderada. En 1982, volvió a concluir en una monografía final provisional «La epinefrina, el bitartrato de epinefrina y el clorhidrato de epinefrina (racémico; desde entonces se denomina clorhidrato de racepinefrina) en formas de dosificación de aerosol de inhalación de dosis medida presurizada pueden ser generalmente reconocidos como seguros y eficaces para el uso de OTC en dosis para adultos y niños de 4 años de edad y mayores de 1 a 2 inhalaciones de una dosis medida equivalente a 0.En 1986, la FDA revisó los productos de efedrina para la broncodilatación y aprobó este principio activo como generalmente reconocido como seguro y eficaz para su uso sin receta. En ese año, la FDA decidió que los datos eran insuficientes para limitar la epinefrina inhalada a su uso con receta y que los beneficios de la disponibilidad sin receta superaban los riesgos. La FDA concluyó que un etiquetado ampliado y revisado beneficiaría a los consumidores.5,6
Después de los informes de eventos que ponían en peligro la vida y las muertes atribuibles a los productos combinados de venta sin receta que contenían teofilina, la FDA emitió una resolución final en 1995 en la que se declaraba que estos productos no eran seguros ni eficaces.7 Por lo tanto, los productos que contenían una combinación de efedrina y teofilina fueron descontinuados y algunos fueron reformulados para contener efedrina y guaifenesina. También en 1995, la FDA propuso retirar la efedrina del mercado de venta sin receta debido a su papel en la fabricación de metanfetamina y metcatinona y a su mal uso para el control de peso y el mejoramiento muscular.7
En 1996, la FDA modificó la monografía final de 1986 para retirar el estatus de monografía a los broncodilatadores de venta libre.6 En su lugar, los fabricantes de cualquier nuevo inhalador de dosis medida de venta libre deben presentar una solicitud aprobada que contenga información que no se encuentre en la monografía.6 Los broncodilatadores de venta libre actualmente comercializados no se vieron afectados por esta enmienda.
A pesar de la propuesta de la FDA de eliminar la efedrina del mercado de venta libre debido a su uso como elemento base en la producción de metanfetamina, el producto sigue estando disponible sin receta. En cambio, la Ley de Lucha contra la Epidemia de Metanfetamina de 2005, incorporada a la Ley Patriota en 2006, confirió a los productos de venta sin receta que contienen efedrina la condición de productos de venta sin receta.8 Los consumidores que deseen comprar productos que contengan efedrina deben presentar ahora una identificación con fotografía emitida por el gobierno en una farmacia, ya que estos productos ya no se venden legalmente en tiendas de conveniencia o almacenes sin una farmacia registrada.
Como parte de la protección de la salud pública mundial, se formó un acuerdo internacional para reducir y finalmente eliminar los productos que contienen sustancias que agotan la capa de ozono (SAO), como los clorofluorocarbonos (CFC) que se encuentran en los inhaladores de dosis medida (IDM). Este acuerdo dio lugar al Protocolo de Montreal de 1987 y, posteriormente, a las Enmiendas a la Ley de Aire Limpio de 1990.9-11 El acuerdo establece una exención para el uso de CFC en los IDM utilizados para el tratamiento del asma si la FDA determina que el uso del producto es esencial.12 Los medicamentos para el asma sin receta han permanecido bajo la designación de uso esencial. Sin embargo, en 2007 la FDA anunció una propuesta para eliminar la designación de uso esencial para la epinefrina inhalada a partir del 31 de diciembre de 2010.13 La FDA utilizó los siguientes criterios, que se encuentran en 21 CFR 2.125(g)(2), para revisar la designación de uso esencial para la epinefrina inhalada: «(i): Existen obstáculos técnicos sustanciales para formular el producto sin SAO; (ii): El producto proporcionará un importante beneficio de salud pública no disponible; y (iii): El uso del producto no libera cantidades acumulativas significativas de SAO a la atmósfera o la liberación se justifica en vista del importante beneficio no disponible para la salud pública».13 La FDA está recibiendo actualmente comentarios sobre este asunto antes de su decisión final.
Seguridad y eficacia de los productos de venta sin receta
Como demuestran las diversas propuestas realizadas y las medidas adoptadas por la FDA en relación con la situación de los productos para el asma de venta sin receta, en las últimas décadas se ha debatido mucho sobre la seguridad y la eficacia de los ingredientes activos de estos productos. Aunque estos productos no se promocionan activamente, su disponibilidad significa que su seguridad y eficacia son de importancia crítica para los consumidores.
Efedrina: Los productos de efedrina de un solo ingrediente para su uso como broncodilatadores han sido considerados generalmente reconocidos como seguros y eficaces por la FDA desde 1986.14 La efedrina libera epinefrina de los tejidos, lo que desencadena la actividad de los receptores alfa-adrenérgicos y beta-adrenérgicos no selectivos. La eficacia de la efedrina para la broncodilatación se ha demostrado en estudios que datan de la década de 1950. Las propiedades que hacen que la efedrina sea menos deseable como broncodilatador incluyen un inicio de acción más lento que el de los productos inhalados (de 15 minutos a una hora) y la no selectividad de la estimulación beta, que podría contribuir a los acontecimientos adversos (EA) cardiovasculares.15-17 Sin embargo, los estudios han demostrado resultados contradictorios con respecto a los acontecimientos adversos cardiovasculares atribuibles al uso de la efedrina a dosis indicadas de 12,5 a 25 mg.16
Epinefrina: La epinefrina presenta la misma actividad de los receptores alfa y beta-adrenérgicos que la efedrina; por lo tanto, existen las mismas preocupaciones en cuanto a la posibilidad de que se produzcan EA cardiovasculares. El inicio de acción de la epinefrina inhalada (15 segundos) es mucho más rápido que el de la efedrina oral, lo que la convierte en una opción más apropiada para el alivio inmediato de una exacerbación aguda del asma.6 Sin embargo, su corta duración de acción (23 minutos) puede hacer necesario que el paciente utilice el producto repetidamente para obtener un alivio continuado en lugar de seguir las instrucciones de la etiqueta de no realizar más de dos inhalaciones en tres horas.6 Los inhaladores de epinefrina de venta libre parecen ser seguros y eficaces para los pacientes con asma leve e intermitente cuando se utilizan según las indicaciones de la etiqueta.5 Sin embargo, esto sigue siendo una fuente de controversia, ya que a muchos proveedores de atención médica les preocupa que los pacientes que dependen de los inhaladores de venta libre no estén recibiendo un tratamiento adecuado de la enfermedad por parte de un equipo de atención médica, lo que podría tener repercusiones graves.
Guaifenesina: La guaifenesina se utiliza en combinación con la efedrina para el tratamiento del asma y está reconocida como segura y eficaz cuando el producto está etiquetado para la tos asociada al asma.14 Aunque la guaifenesina es un mucolítico aprobado por la FDA, no posee efectos broncodilatadores. Por lo tanto, no aporta ningún beneficio adicional al producto con efedrina para una exacerbación aguda.17
Uso de productos de venta sin receta para el asma
Una encuesta de Wyeth Consumer Healthcare (WCH) realizada en 1999 descubrió que aproximadamente seis millones (30%) de personas con asma utilizan inhaladores de epinefrina.6 Los autoinformes de los encuestados sugieren que alrededor del 20% de estos seis millones se clasificarían como personas con asma persistente de leve a moderada, lo que no está en el uso etiquetado para este producto.5 Las directrices de la NAEPP promueven el uso de agonistas beta de acción corta al menos cuando sea necesario para todas las personas que sufren de asma; sin embargo, las directrices no mencionan específicamente la epinefrina inhalada como una opción de tratamiento.
En 2005, el WCH realizó una encuesta por Internet a 330 personas sobre el uso de broncodilatadores de venta libre para el tratamiento de sus síntomas. El WCH determinó que, de los usuarios de broncodilatadores de venta libre, el 92% había sido diagnosticado con asma, el 91% utilizaba epinefrina inhalada sólo cuando experimentaba una exacerbación aguda del asma, el 31% no tenía seguro médico y el 38% no tenía seguro de prescripción.6 El WCH extrapoló estos resultados para estimar que aproximadamente del 5% al 10% de los individuos con asma utilizan broncodilatadores de venta libre como monoterapia.6 Las razones principales para el uso de los broncodilatadores de venta sin receta -facilidad de acceso y menor costo- se correlacionan directamente con la preocupación de los proveedores de salud de que los individuos que usan productos de venta sin receta para el asma pueden no estar recibiendo un manejo apropiado de la enfermedad.6
Discusión
Las propiedades deseables en el tratamiento del asma aguda incluyen la efectividad como broncodilatador, la seguridad cuando se toma como se indica en la etiqueta, el rápido inicio de la acción y la larga duración de la acción. Tanto la epinefrina inhalada como la efedrina oral han demostrado su eficacia en ensayos durante décadas. Sin embargo, dados los resultados cardiovasculares mixtos en los ensayos clínicos, la seguridad del uso de broncodilatadores sin prescripción por parte de individuos que pueden no tener un seguimiento médico es una de las principales preocupaciones de los proveedores de atención médica. La epinefrina inhalada tiene un inicio de acción más rápido que la efedrina oral, pero su corta duración de acción puede limitar su eficacia.
La disponibilidad de la efedrina oral se ha visto limitada desde 2006 por su condición de producto de venta libre. La disponibilidad de la epinefrina inhalada depende de la decisión de la FDA sobre si esta formulación mantendrá su designación de uso esencial. No existen alternativas de venta sin receta para los broncodilatadores de venta sin receta que contienen CFC.12 Un fabricante trató de reformular su producto de epinefrina inhalada de venta sin receta con un propulsor de hidrofluoroalcano, con efectos indeseables para el usuario; se ha asociado con otra empresa farmacéutica para la reformulación en previsión de presentar una solicitud a la FDA en 2011.6 Las preocupaciones clave con respecto a los propulsores alternativos incluyen la necesidad de una entrega efectiva de epinefrina y los datos de seguridad y eficacia del nuevo producto como resultado de los cambios.18
A la hora de determinar si se retira la designación de uso esencial para la epinefrina inhalada, la FDA no está examinando la seguridad o la eficacia de los productos que contienen CFC actualmente comercializados, sino que está examinando el impacto en la salud pública si se retira la designación. En las cartas enviadas por la Asociación Nacional de Cadenas de Farmacias y la Asociación Americana de Farmacéuticos a la FDA sobre la propuesta de eliminar la designación de uso esencial, la principal preocupación era el posible impacto negativo sobre los actuales usuarios de inhaladores de venta libre si los productos dejaran de estar disponibles.19,20 La FDA ha declarado que si la norma propuesta para eliminar la designación de uso esencial se convierte en definitiva y no existen alternativas de venta libre, será necesario que los consumidores obtengan una receta para un producto alternativo.12 Muchos consumidores que utilizan epinefrina inhalada pueden optar por renunciar al tratamiento del asma o buscar una terapia alternativa de venta sin receta.
Es imperativo que la comunidad médica conciencie al público de la gravedad de las consecuencias del asma no controlada y de que cualquier persona que experimente dificultades para respirar debe acudir a un proveedor de atención médica para recibir un diagnóstico y tratamiento. El paciente que decida utilizar broncodilatadores de venta libre debe ser advertido de que debe informar a su proveedor de atención médica; el paciente también debe ser aconsejado sobre la diferencia en las instrucciones de la etiqueta entre los inhaladores de venta libre y los de venta con receta. La actual y continua accesibilidad de los broncodilatadores de venta sin receta requiere la asesoría informada de los pacientes para prevenir el uso inadecuado de estos productos y los subsecuentes efectos adversos.
1. Moorman JE, Rudd RS, Johnson CA, et al. National Surveillance for Asthma–United States, 1980-2004. MMWR. Oct 19, 2007;56:1-14, 18-54.
2. Informe del panel de expertos 3: Directrices para el diagnóstico y el tratamiento del asma. Programa nacional de educación y prevención del asma. Bethesda, MD: National Heart, Lung, and Blood Institute, National Institutes of Health; 2007.
3. Akinbami L. Asthma prevalence, health care use and mortality: Estados Unidos, 2003-05. National Center for Health Statistics. www.cdc.gov/nchs/products/pubs
/pubd/hestats/ashtma03-05/asthma03-05.htm. Consultado el 10 de diciembre de 2007.
4. W. Steven Pray. OTCproducts and asthma therapy. US Pharm. 1997;22(7):18-22.
5. Dickinson BD, Altman RD, Deitchman SD, Champion HC. Safety of over-the-counter inhalers for asthma: report of the Council on Scientific Affairs. Chest. 2000;118:522-526.
6. Wyeth ConsumerHealthcare. 2005N-0374. Uso de sustancias que agotan la capa de ozono: determinación del uso esencial de los inhaladores dosificadores de epinefrina de venta libre. Documento informativo. 19 de diciembre de 2005. www.fda.gov/ohrms/dockets/ac
/06/briefing/2006-4200B1_01_01-Wyeth-Backgrounder.pdf. Consultado el 30 de diciembre de 2007.
7. Kupec IF. Broncodilatadores que contienen teofilina y productos farmacéuticos con efedrina. Respuestas T95-40. 27 de julio de 1995. www.fda.gov/bbs/topics/ANSWERS/ANS00675.html. Consultado el 10 de diciembre de 2007.
8. Drug Enforcement Administration. Información general sobre la Ley de lucha contra la epidemia de metanfetamina de 2005 . Mayo de 2006. www.deadiversion.usdoj.gov/meth/cma2005_general_info.pdf. Consultado el 4 de febrero de 2008.
9. Jarabek AM, Fisher JW, Rubenstein R, et al. Mechanistic insights aid the search for CFC substitutes: risk assessment of HCFC-123 as an example. Risk Anal. 1994;14:231-250.
10. DeCanio SJ, Norman CS. Economics of «essential use exemptions» for metered-dose inhalers under the Montreal Protocol. J Environ Manage.2007;85:1-8.
11. D’Souza S. The Montreal Protocol and essential use exemptions. J Aerosol Med. 1995;8(suppl 1):S13-S17.
12. Administración de Alimentos y Medicamentos. Noticias de la FDA. FDA proposing phase out of CFCs in metered-dose inhalers for epinephrine. www.fda.gov/bbs/topics/NEWS
/2007/NEW01706.html. Consultado el 10 de diciembre de 2007.
13. Food and Drug Administration. Code of Federal Regulation 21 CFR part 2 2007N-0262. www.fda.gov/ohrms/dockets/98fr/cd0612.pdf. Consultado el 6 de febrero de 2008.
14. Whitehall-Robins. RE: docket no. 98N-0148; Fed. Reg. 13258, international drug scheduling; Convention on Psychotropic Substances. 16 de abril de 1998. www.fda.gov/ohrms/dockets/dockets/98n0148/c000010.pdf. Consultado el 30 de diciembre de 2007.
15. Lexi-Comp Online. www.crlonline.com. Consultado el 28 de diciembre de 2007.
16. Tashkin DP, Meth R, Simmons DH, Lee YE. Double-blind comparison of acute bronchial and cardiovascular effects of oral terbutaline and ephedrine. Chest. 1975;68:155-161.
17. Dulfano MJ. Los nuevos broncodilatadores orales . Chest.1975;68:133-134.
18. Productos farmacéuticos para el resfriado, la tos, las alergias, los broncodilatadores y los antiasmáticos de uso humano sin receta médica; modificación de la monografía de los productos farmacéuticos broncodilatadores de venta libre. Fed Regist. 1996; 61:25142-25147.
19. Asociación nacional de cadenas de farmacias. Asunto: uso de propulsores que agotan la capa de ozono; eliminación de la designación de uso esencial para los inhaladores de dosis medidas de epinefrina de venta libre (MDI). 6 de enero de 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05n-0374-EC6-Attach-1.pdf. Consultado el 6 de febrero de 2008.
20. Declaración de la Asociación Americana de Farmacéuticos (APhA) al Comité Asesor de Medicamentos de Venta Libre de la Administración de Alimentos y Medicamentos y al Comité Asesor de Medicamentos para Alergias Pulmonares. Uso de sustancias destructoras de la capa de ozono: determinación del uso esencial de los inhaladores dosificadores de epinefrina de venta libre. 24 de enero de 2006. www.fda.gov/ohrms/dockets/dockets/05n0374/05N-0374-EC10-Attach-1.pdf. Consultado el 6 de febrero de 2008.
Para comentar este artículo, póngase en contacto con [email protected].