- Las cavidades libres de cromatina axial aparecen en plantas con un contenido medio de ADN 2C superior a 0.8 pg por cromosoma
- La condensación/descondensación cromosómica puede visualizarse en secciones semifinas de células de N. damascena tras la tinción con 4′,6-diamidino-2-fenilindol (DAPI)
- Condensación/descondensación del cromosoma durante la mitosis analizada tras la incorporación de 5-etil-2′-deoxiuridina (EdU)
- Condensación/decondensación de cromosomas durante la mitosis analizada por microscopía electrónica
Las cavidades libres de cromatina axial aparecen en plantas con un contenido medio de ADN 2C superior a 0.8 pg por cromosoma
Las cromátidas en anafase y telofase de algunas plantas contienen cavidades libres de cromatina en las regiones axiales, lo que distingue a estas plantas de la mayoría de otras plantas y animales investigados hasta la fecha (Fig. 1a, b). Hasta donde sabemos, los informes que describen esta organización cromosómica se limitan a plantas con genomas grandes, y se puede suponer que esta organización morfológica es una característica específica de estas plantas. Para comprobar esta sugerencia, también analizamos las cromátidas en anafase y telofase de 12 especies mediante microscopía electrónica (Tabla 1; Fig. 1a, b; Archivo adicional 1: Figura S1). La Figura 1c demuestra que las cavidades libres de cromatina axial se veían claramente sólo dentro de los cromosomas de las plantas con genomas grandes y con cromosomas grandes, pero parecía que el tamaño medio del cromosoma se correlacionaba mejor con la presencia o la ausencia de estas cavidades. Entre las plantas con cavidades axiales, Hordeum vulgare tenía el genoma más pequeño y el menor contenido medio de ADN 2C por cromosoma (0,79 pg). Así pues, esta organización cromosómica es un sello distintivo de los cromosomas de las plantas cuyo contenido de ADN 2C puede estimarse aproximadamente como superior a 0,8 pg por cromosoma.
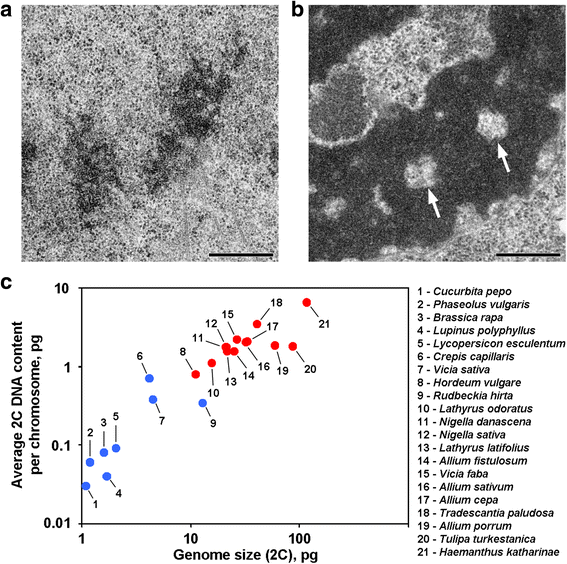
Dos variantes de organización cromosómica en las plantas. a Cromosomas en telofase de la judía común (Phaseolus vulgaris) como ejemplo de cromosomas sin cavidades libres de cromatina axial. b Cromosomas en telofase de N. damascena con cavidades libres de cromatina axial claramente visibles (flechas). c La presencia de cavidades libres de cromatina axial depende del genoma y del tamaño del cromosoma. Los puntos azules representan plantas en las que los cromosomas no contienen cavidades libres de cromatina axial; los puntos rojos representan plantas en las que los cromosomas contienen cavidades libres de cromatina axial. Barra de escala: 0,5 μm
La condensación/descondensación cromosómica puede visualizarse en secciones semifinas de células de N. damascena tras la tinción con 4′,6-diamidino-2-fenilindol (DAPI)
El objeto más conveniente para el estudio de los cromosomas de las plantas, el meristemo apical de la raíz, no permite la adquisición de imágenes de alta resolución debido a la fluorescencia desenfocada. En este caso, utilizamos un método basado en la aplicación de secciones semifinas (200-250 nm) de raíces embebidas en medio LR White. El grosor de estas secciones era significativamente menor que el de las secciones ópticas, incluso si se utilizaba un microscopio confocal. Para encontrar las características morfológicas que nos permitieran identificar las células en diferentes etapas mitóticas, analizamos la morfología de las células teñidas con DAPI.
Hubo varias transformaciones de la organización cromosómica de N. damascena que fueron fácilmente visibles incluso bajo el microscopio de fluorescencia. Dentro de los núcleos de la profase temprana, eran visibles partes de cromosomas delgados (de aproximadamente 0,6 μm de diámetro) (Fig. 2a). En la profase media, se formaron cromosomas de profase más gruesos (aproximadamente 1,2 μm), en cuyo interior era posible distinguir la presencia de fibras más finas, que probablemente correspondían a cromosomas de profase temprana plegados (Fig. 2b). Los cromosomas de la profase tardía (Fig. 2c), de la metafase (Fig. 2d) y de la anafase (Fig. 2e) estaban densamente condensados y no se detectó ninguna organización interna. Durante la descondensación en telofase, la separación de las fibras de cromatina con un diámetro de aproximadamente 0,4 μm condujo a la aparición de cavidades libres de cromatina en las regiones axiales de las cromátidas (Fig. 2f), cuyo tamaño aumentó gradualmente durante la telofase (Fig. 2g y h). El diámetro de las fibras de cromatina en los cromosomas de la telofase era comparable al tamaño de los cromosomas de la profase temprana. Así, todos los estadios mitóticos de N. damascena se detectaron fácilmente en secciones semifinas teñidas con DAPI.
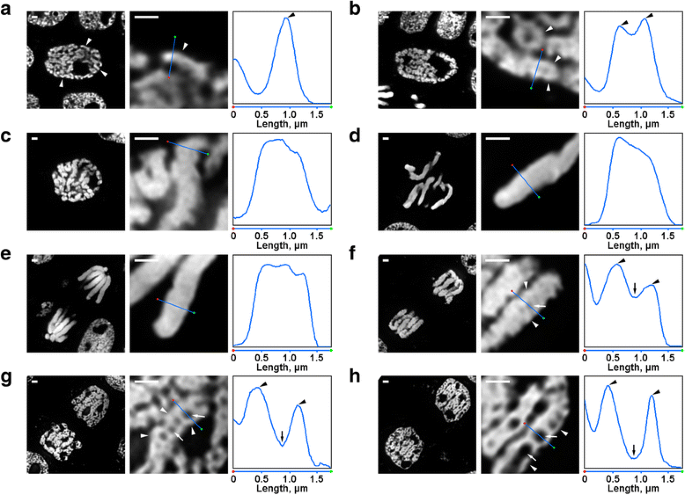
Morfología de los cromosomas mitóticos de N. damascena. Los paneles izquierdo y central representan imágenes de microscopía de fluorescencia de secciones semifinas teñidas con DAPI (vista general y fragmento); el panel derecho representa un gráfico de densidad a través de la línea de los paneles centrales. a Profase temprana (los cromosomas se indican con puntas de flecha). b Profase media (las fibras que forman los cromosomas, que parecen corresponder a los cromosomas de la profase temprana, se indican con puntas de flecha). c Profase tardía. d Metafase. e Anafase. f Telofase temprana (las cavidades axiales sin cromatina se indican con flechas, las fibras que forman los cromosomas de la telofase se indican con puntas de flecha). g Telofase tardía. h Fase G1. Barras de escala: 1 μm
Condensación/descondensación del cromosoma durante la mitosis analizada tras la incorporación de 5-etil-2′-deoxiuridina (EdU)
Durante la profase, los cromosomas delgados de la profase temprana se transformaron en cromosomas gruesos de la profase tardía. El engrosamiento de los cromosomas de la profase puede ser el resultado del plegamiento de los cromosomas de la profase temprana o el resultado de su engrosamiento gradual. Para investigar estos dos posibles mecanismos, fue necesario marcar los focos cromosómicos discretos que se dispusieron linealmente dentro de los cromosomas de la profase temprana y luego analizar sus reordenamientos espaciales durante la condensación de la profase. Como se muestra en la Fig. 3a, durante la transición de la profase temprana a la tardía, dichos focos perderían la disposición lineal (plegamiento) o conservarían la disposición lineal y estirarían los focos en bandas delgadas (engrosamiento). Para etiquetar las regiones cromosómicas, incorporamos el nucleótido sintético EdU, que puede detectarse mediante química de clic, en la cromatina durante la replicación.
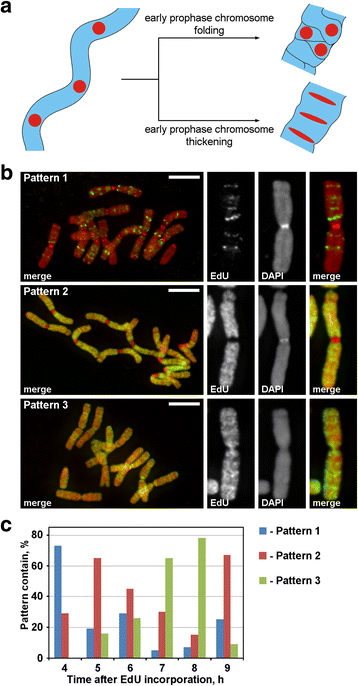
Etiquetado de cromosomas con EdU. a La localización de la región etiquetada y la morfología revelaron el principio de la condensación cromosómica de la profase. Las regiones cromosómicas etiquetadas dispuestas linealmente durante la transición de la profase temprana a la tardía perderían la disposición lineal (plegado) o mantendrían la disposición lineal (engrosamiento). b Se detectaron tres patrones de incorporación de EdU en los cromosomas: etiquetado de regiones discretas (patrón 1), etiquetado de los brazos del cromosoma pero no de los centrómeros (patrón 2) y etiquetado tanto de los brazos del cromosoma como de los centrómeros (patrón 3). c Frecuencias de los diferentes patrones de etiquetado en diferentes puntos temporales tras la incorporación de EdU. Barras de escala: 5 μm
Se incorporó EdU durante 30 min en las raíces de N. damascena y, tras diferentes periodos de persecución (de 2 a 14 h), se realizaron los extendidos de cromosomas. Se detectaron tres patrones de marcaje cromosómico: marcaje de regiones discretas (patrón 1), marcaje de los brazos del cromosoma pero no de los centrómeros (patrón 2) y marcaje tanto de los brazos del cromosoma como de los centrómeros (patrón 3) (Fig. 3b). El patrón 1 se observó con mayor frecuencia a las 4 h de la incorporación de EdU, lo que indica que dicho etiquetado era típico de la fase S tardía (Fig. 3c; Archivo adicional 2: Figura S2). En el caso del patrón 1, el etiquetado de los cromosomas homólogos fue similar (archivo adicional 3: Figura S3), indicando un patrón específico de incorporación de EdU. Los brazos cromosómicos se marcaron durante el resto de la fase S (patrones 2 y 3), pero las regiones centroméricas también se marcaron aproximadamente en el límite entre la fase S temprana y la tardía (patrón 3) (Fig. 3c).
Analizamos las transiciones de la profase temprana a la tardía utilizando cromosomas en los que se marcó la cromatina de replicación tardía (patrón 3). En los cromosomas de la profase temprana, las regiones etiquetadas estaban distribuidas linealmente a lo largo de cromosomas delgados (Fig. 4a). En los cromosomas de la profase tardía, que eran aproximadamente el doble de gruesos que los de la profase temprana, las regiones marcadas perdieron la linealidad de la distribución (Fig. 4b). Esta observación no era completamente válida, ya que los cromosomas de profase y metafase están formados por dos cromátidas, que se segregan gradualmente, y esto puede llevar a una pérdida de la linealidad de la distribución de las regiones marcadas. Por lo tanto, analizamos más a fondo las cromátidas en anafase (es decir, los cromosomas totalmente compactados tras la segregación de las cromátidas). En las cromátidas en anafase con un diámetro aproximadamente igual al de los cromosomas de la profase tardía, las regiones de cromatina marcadas no estaban dispuestas linealmente, sino que estaban distribuidas por todo el volumen de las cromátidas (Fig. 4c). En la telofase, las cavidades libres de cromatina eran claramente visibles en las regiones axiales de las cromátidas, permitiendo la detección de las fibras de cromatina dentro de las cuales las regiones etiquetadas estaban dispuestas linealmente (Fig. 4d). Por lo tanto, durante la transición de la profase temprana a la tardía, se produjo el plegamiento de los cromosomas de la profase temprana. Este resultado concuerda con las observaciones de los cromosomas de la profase media teñidos con DAPI (Fig. 2b), dentro de los cuales eran claramente visibles las fibras finas plegadas.
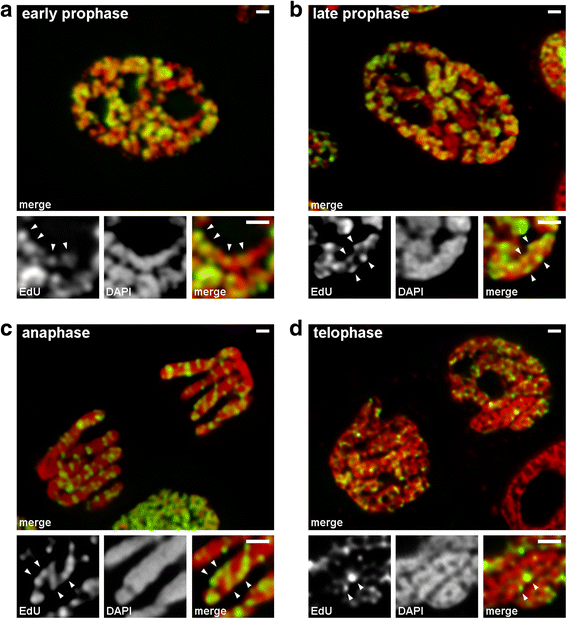
Condensación/descondensación de cromosomas durante la mitosis de N. damascena (células mitóticas cuyos cromosomas incluían EdU durante la fase S tardía). a En la profase temprana, las regiones marcadas estaban distribuidas linealmente en cromosomas delgados, abarcando la anchura del cromosoma casi por completo. b En la profase tardía, las regiones marcadas estaban dispersas por todo el volumen del cromosoma. c En la anafase, el patrón de marcaje era similar al de los cromosomas de la profase tardía. d En la telofase tardía, la descondensación reveló fibras delgadas que formaban cromátidas dentro de las cuales las regiones marcadas estaban distribuidas de forma similar a la de los cromosomas de la profase temprana. Barras de escala: 1 μm
Condensación/decondensación de cromosomas durante la mitosis analizada por microscopía electrónica
Para la detección de la organización interna de las fibras de cromatina, cuyo plegado se describió mediante microscopía óptica, utilizamos la microscopía electrónica. Para detectar y medir las subestructuras fibrilares de la cromatina, analizamos las cavidades libres de cromatina, que separaban las fibras de cromatina como suponíamos (archivo adicional 4: figura S4; tabla 2).
Los núcleos interfásicos estaban llenos de una malla de fibras gruesas de 234 ± 49 nm (media ± D.E.) (Fig. 5a), que pueden denominarse «cromonemas interfásicos», como ya se ha comentado. La microscopía electrónica permitió detectar tres estadios de condensación cromosómica en la profase, el primero de los cuales no fue posible detectar mediante microscopía óptica, y al que nos referiremos aquí como «preprofase». Las etapas segunda y tercera corresponden a la profase temprana y tardía, como se ha descrito anteriormente (Fig. 2a y c, respectivamente).
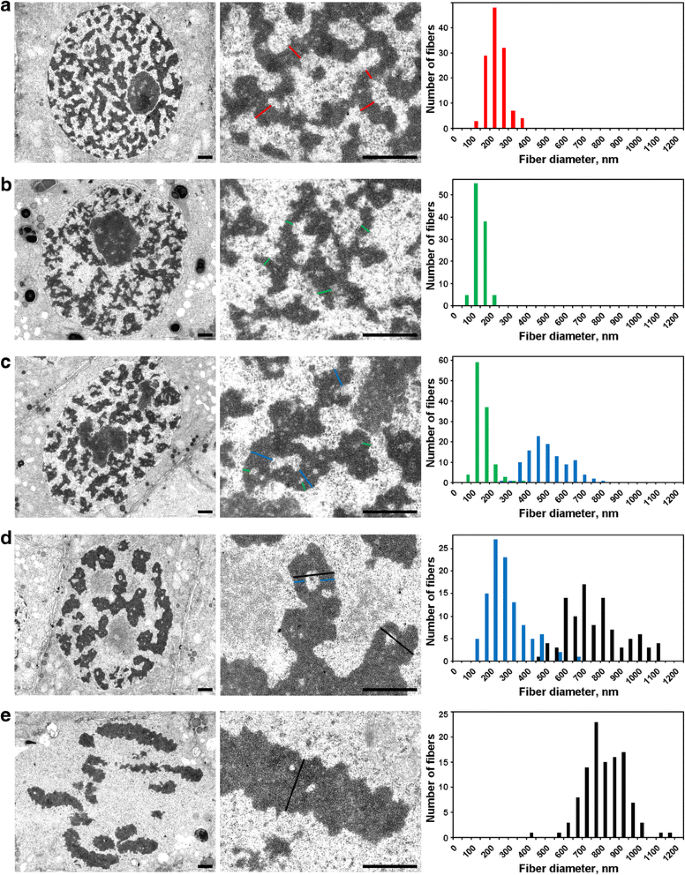
Morfometría por microscopía electrónica de los cromosomas de N. damascena: condensación cromosómica desde la interfase hasta la metafase. Los paneles de la izquierda y del centro muestran la organización ultraestructural (vista general y fragmento), los paneles de la derecha muestran los histogramas que representan las distribuciones de la anchura de los cromosomas y de las fibras de cromatina. a Interfase. b Preprofase. c Profase temprana. d Profase tardía. e Metafase. Las secciones transversales típicas de los cromosomas y/o de las fibrillas de cromatina se indican con líneas de color: rojo – cromonema de interfase (heterocromatina), verde – cromonema; azul – «fibras de 300 nm»; negro – cromosomas. Barras de escala: 1 μm
(1) En la preprofase, los cromosomas estaban poco separados entre sí, y no pudimos medir con precisión su diámetro (Fig. 5b). Los cromosomas de la preprofase estaban formados por fibras con un diámetro de 148 ± 30 nm (Tabla 2), que muy probablemente correspondían a las fibras con un diámetro de 100-130 nm (cromonema), que son la principal subestructura cromosómica de los cromosomas de la profase y la telofase en las células animales . Los datos no nos permitieron establecer la identidad de los cromonemas interfásicos y mitóticos, pero los datos comunicados anteriormente indican que los cromonemas interfásicos son complejos formados por cromonemas plegados.
(2) Al principio de la profase, se produjo la separación de los cromosomas (Fig. 5c). El diámetro de los cromosomas era de 527 ± 107 nm, y estos cromosomas también estaban formados por cromonemas con un diámetro de 158 ± 46 nm.
(3) Finalmente, analizamos las células de la profase tardía, que contenían cromosomas engrosados con un diámetro de 809 ± 185 nm (Fig. 5d). Algunos cromosomas de profase tardía contenían cavidades en las regiones axiales que nos permitieron distinguir las fibras con un diámetro de 285 ± 102 nm («fibra de 300 nm»). El análisis realizado con los segmentos cromosómicos etiquetados demostró que los cromosomas de la profase temprana se plegaron para formar cromosomas de la profase tardía más gruesos (Fig. 4). Por tanto, es posible suponer que las fibras de 285 ± 102 nm y los cromosomas de la profase temprana de 527 ± 107 nm eran las mismas fibras. La disminución del diámetro de las fibras puede estar asociada a la compactación de la cromatina de los cromosomas de la profase temprana, lo que también estaba indicado por la desaparición de los cromonemas visibles.
La cromatina del interior de los cromosomas de la metafase (Fig. 5e) y de las cromátidas de la anafase (Fig. 6a) estaba muy compactada y, aunque eran visibles raras cavidades libres de cromatina en su interior, era imposible distinguir con precisión cualquier subestructura fibrilar. En los cromosomas de la telofase temprana, se detectaron claramente dos tipos de cavidades (Fig. 6b). Las cavidades grandes se localizaron en la región axial de las cromátidas, permitiéndonos identificar y medir fibras con un diámetro de 422 ± 78 nm. En las regiones centrales de estas fibras, detectamos pequeñas cavidades que permitieron identificar un segundo tipo de fibras con un diámetro de 182 ± 47 nm. El primer tipo de fibras podría corresponder a las «fibras de 300 nm» del interior de los cromosomas de la profase tardía, el segundo tipo podría corresponder a los cromonemas.

Morfometría por microscopía electrónica de los cromosomas de N. damascena: descondensación cromosómica desde la anafase hasta la fase G1. Los paneles izquierdo y central muestran la organización ultraestructural (vista general y fragmento), el panel derecho muestra los histogramas que representan las distribuciones de la anchura de las cromátidas y de las fibras de cromatina. a Anafase. b Telofase temprana. c Telofase tardía. d Fase G1. Las secciones transversales típicas de los cromosomas y/o de las fibrillas de cromatina se indican con líneas de color: rojo – cromonemas en interfase, verde – cromonemas; azul – «fibras de 300 nm»; negro – cromátidas. Barras de escala: 1 μm
En la telofase tardía (Fig. 6c) y en la fase G1 (Fig. 6d), los cromosomas se descondensaron en dominios cromosómicos en los núcleos hijos, donde no se pueden observar fácilmente. No obstante, fue posible identificar fragmentos de cromátidas separados. En esta fase, las cromátidas estaban formadas por fibras con un diámetro de aproximadamente 250 nm, que corresponde aproximadamente al diámetro de los cromonemas interfásicos. Esta observación, además de la desaparición de las fibras de cromonema, indicaba que, en esta etapa de la mitosis, las fibras de cromatina se replegaban para formar complejos interfásicos de cromatina condensada.