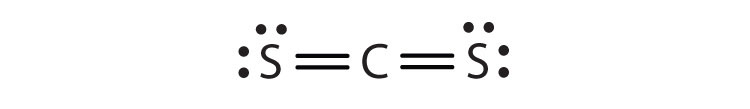4.3 Flere kovalente bindinger
Læringsmål
- Kend molekyler, der sandsynligvis vil have flere kovalente bindinger.
I mange molekyler vil oktetreglen ikke være opfyldt, hvis hvert par af bundne atomer deler to elektroner. Tænk på kuldioxid (CO2). Hvis hvert iltatom deler én elektron med kulstofatomet, får vi følgende:
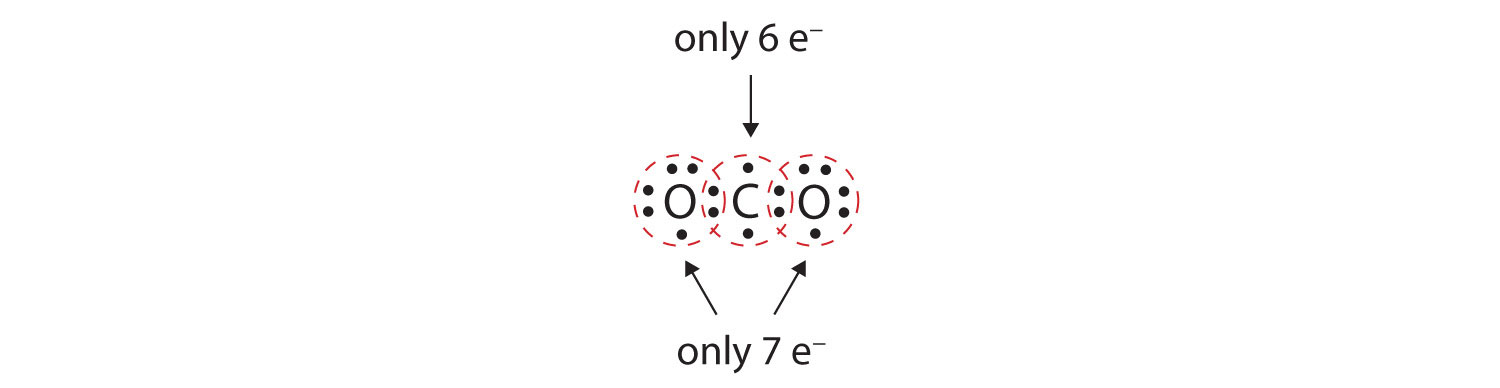
Det giver ikke kulstofatomet en komplet oktet; man finder kun seks elektroner i dets valensskal. Desuden har hvert oxygenatom kun syv elektroner i sin valensskal. Endelig laver intet atom det antal bindinger, som det typisk danner (figur 4.2 “Hvor mange kovalente bindinger dannes der?”). Dette arrangement af delte elektroner er langt fra tilfredsstillende.
I nogle tilfælde skal der deles mere end ét elektronpar mellem to atomer, for at begge atomer har en oktet. I kuldioxid deles en anden elektron fra hvert iltatom også med det centrale kulstofatom, og kulstofatomet deler yderligere en elektron med hvert iltatom:
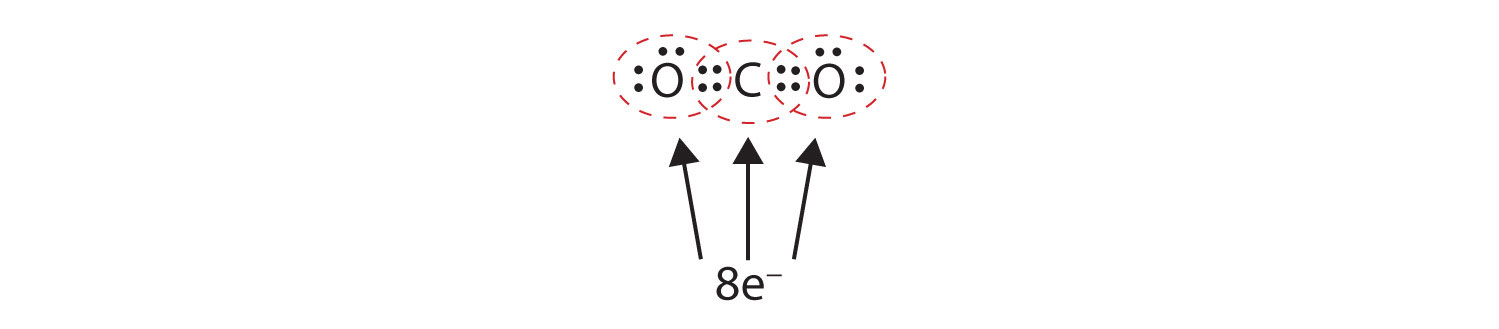
I dette arrangement deler kulstofatomet fire elektroner (to par) med iltatomet til venstre og fire elektroner med iltatomet til højre. Der er nu otte elektroner omkring hvert atom. To par elektroner, der deles mellem to atomer, danner en dobbeltbindingTo par elektroner, der deles af to atomer i et molekyle. mellem atomerne, som er repræsenteret ved en dobbelt streg:
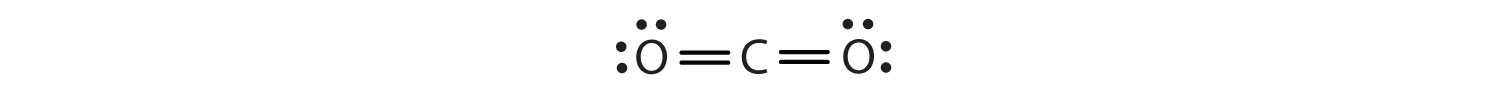
Nogle molekyler indeholder trippelbindingerTre par elektroner, der deles af to atomer i et molekyle., kovalente bindinger, hvor tre par elektroner deles af to atomer. En simpel forbindelse, der har en tripelbinding, er acetylen (C2H2), hvis Lewis-diagram ser ud som følger:

Eksempel 5
Tegn Lewis-diagrammet for hvert molekyle.
- N2
- CH2O (Kulstofatomet er det centrale atom.)
Løsning
-
Bindingen mellem de to kvælstofatomer er en tripelbinding. Lewis-diagrammet for N2 ser således ud:

-
I CH2O er det centrale atom omgivet af to forskellige typer af atomer. Lewis-diagrammet, der udfylder hvert atoms valenselektronskal, ser således ud:

Note
En anvendelse af CH2O, også kaldet formaldehyd, er konservering af biologiske eksemplarer. Vandige opløsninger af CH2O kaldes formalin og har en skarp, karakteristisk (skarp) lugt.
Færdighedsopgave
-
O2
-
C2H4
Tegn Lewis-diagrammet for hvert molekyle.
Opgave til gennemgang af begreber
-
Hvad er et tegn på, at et molekyle har en flerbinding?
Svar
-
Hvis enkeltbindinger mellem alle atomer ikke giver alle atomer (undtagen hydrogen) en oktet, kan der være flere kovalente bindinger til stede.
Nøgleudtryk
- Nogle molekyler skal have flere kovalente bindinger mellem atomerne for at opfylde oktetreglen.
Opgaver
-
Et molekyle indeholder flere bindinger. Tegn Lewis-diagrammet for hver. Det første element er det centrale atom.
- CS2
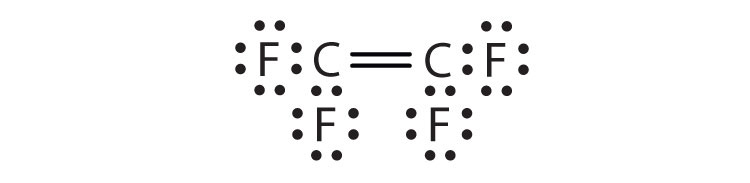
- C2F4
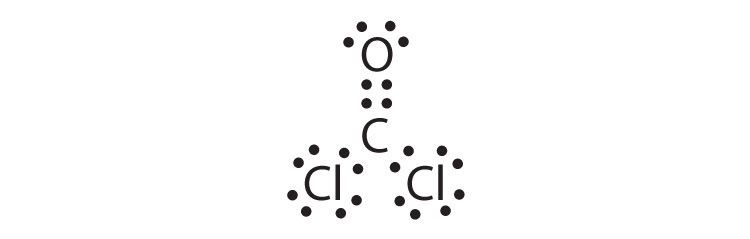
- COCl2
-
Hvert molekyle indeholder dobbeltbindinger. Tegn Lewis-diagrammet for hver af dem. Antag, at det første grundstof er det centrale atom, medmindre andet er angivet.
- N2
- HCN (Kulstofatomet er det centrale atom.)
- POCl (Phosphoratomet er det centrale atom.)
-
Forklar, hvorfor hydrogenatomer ikke danner dobbeltbindinger.
-
Hvorfor er det forkert at tegne en dobbeltbinding i Lewis-diagrammet for MgO?
Svar
Hydrogen kan kun acceptere endnu en elektron; flerbindinger kræver, at der deles mere end ét elektronpar.