Introduktion
Prostatakræft er den mest almindelige form for malignitet og den næsthøjeste årsag til kræftdød blandt mænd.1 Kadaverundersøgelser viser, at muligheden for at udvikle prostatakræftmikrofoci stiger med alderen (30 % i det fjerde årti af livet, 40 % i det femte årti osv.).2
Mens nogle kræftformer er aggressive, har andre kun et lille eller intet metastatisk potentiale.3 Mange mænd med lavrisikoprostatakræft vil ikke udvikle sig eller blive klinisk symptomatiske i løbet af deres levetid.4 På grund af denne variabilitet er der blevet indført forskellige behandlingsmuligheder, der tilbyder sammenlignelige terapeutiske virkninger med radikal prostatektomi (RP), samtidig med at seksuel funktion og kontinens bevares. I dette scenarie kan aktiv overvågning (AS) tilbyde reduceret morbiditet og forbedring af livskvaliteten.5 Små, ikke-aggressive tumorer er de ideelle kandidater til AS, selv om der ikke er opnået konsensus. Lavrisikosygdom defineres som Gleason-score (GS) 6 og prostataspecifikt antigen (PSA)
ng/ml. Patienter med klinisk stadium >T2a udelukkes normalt.6
Histologisk grad er en uafhængig determinant for sygdomsprognose og overlevelse.7 GS graderingssystemet er den mest almindeligt accepterede klassifikation,8 men mange undersøgelser har vist, at den GS, der opnås ved prostatabiopsi, ikke altid korrelerer med den endelige patologiske grad af de kirurgiske prøver. GS-opgradering (stigning i GS på mindst ét point) er blevet rapporteret i op til 57 % af tilfældene.9,10 Fejl i tildelingen af GS kan føre til uhensigtsmæssig overvågning af biologisk aggressive tumorer eller til valg af behandlinger med ringere helbredelsesrater ved højrisikosygdom, hvilket i sidste ende kan have en negativ indvirkning på patienternes resultater.11 Derfor har flere nyere undersøgelser søgt efter faktorer, der kan forudsige opgradering til GS.12
Lavt prostatavolumen (PV) og mere specifikt høj prostataspecifik antigentæthed (PSAD) har i mange undersøgelser vist sig at være prædiktorer for risikoprogression, hvilket afspejler muligheden for uopdaget aggressiv kræft.6 Flere undersøgelser har vist en stærk sammenhæng mellem PSAD og prostatakræfts aggressivitet.13 PSAD er blevet foreslået som en stærk prædiktor for opgradering af GS hos patienter med biopsibekræftet Gleason 6-sygdom, men der er ikke generel konsensus om cut-off-værdien.11-17
Det primære formål med vores undersøgelse var at identificere de uafhængige prædiktorer for GS-opgradering og bestemme den bedste cut-off-værdi for PSAD til at identificere risikopatienter.
Materiale og metoder
Vi indsamlede undersøgelsesoplysningerne fra vores hospitalscenters prospektivt vedligeholdte database. Patienter med klinisk lokaliseret prostatakræft, der gennemgik radikal prostatektomi (RP) og havde en præoperativ prostatabiopsi inden for tidsrammen fra januar 2004 til februar 2015, blev udvalgt. Påvisning af GS 3+3 ved prostatabiopsi blev taget som inklusionskriterier. Alle kliniske, billeddannende, laboratorie- og patologiske oplysninger blev indhentet fra databasen og bekræftet af patienternes kliniske journaler.
Vi inkluderede præoperativ patientalder, klinisk sygdomsstadie, præ-biopsi PSA, præoperativ PSAD, biopsi GS, samlet antal udtagne biopsi kerner og antal biopsi kerner med kræft og analyserede sammenhængen mellem disse faktorer og GS opgradering efter RP. Der blev anvendt forskellige cut-off-værdier for hver variabel for at identificere og kvantificere en potentiel sammenhæng med Gleason-opgradering. Vi analyserede også sammenhængen mellem GS-opgradering og variabler for metabolisk syndrom, såsom diabetes mellitus (DM), højt blodtryk (HBP) og fedme, som blev indhentet fra patienternes kliniske journaler. De sidste variabler blev inkluderet, fordi tidligere undersøgelser har vist deres sammenhæng med dårligere prognose og en højere recidivfrekvens.18,19
PSAD blev beregnet ved at dividere den præoperative PSA-værdi med PV. PV blev beregnet ved transrektal ultralyd ved hjælp af den maksimale tværgående diameter (D1), den maksimale anteroposterior diameter (D2) og den maksimale langsgående diameter (D3) ved hjælp af formlen D1×D2×D3×ϖ/6 baseret på teorien om prostatas ellipsedimensionen.14 Prostatabiopsi blev udført ved hjælp af vores hospitals tidligere beskrevne protokol. Alle patienter blev let bedøvet, og en enkelt i.v.-dosis piperacillin/tazobactam blev administreret 15min før proceduren.20 Vi brugte en 18-gauge nål med en automatisk biopsipistol til at udtage prostatavævet. Ved den første biopsi blev der udtaget 12-18 kerner, afhængigt af prostataens størrelse og tilstedeværelsen af mistænkelige knuder.21 Alle prøver blev anbragt i en separat beholder, der identificerede det tilsvarende sted, og blev sendt til patologitjenesten på vores hospital.
Deskriptoriske statistikker blev præsenteret som gennemsnit ± standardafvigelse (SD) og median/IQR for kontinuerlige variabler og som absolut frekvens og fordelingsprocent for kategoriske variabler. Patienter, der postoperativt blev opgraderet til GS 7 eller højere, blev sammenlignet med de patienter, der ikke blev opgraderet. For at bestemme gennemsnitsforskelle og ligheder blev de kategoriske variabler sammenlignet ved hjælp af Pearson chi-square-test og de kontinuerlige variabler med median-test og Student’s t-test. Der blev anvendt en univariat regressionstest til at påvise signifikante uafhængige prædiktorer for opgradering. Der blev anvendt en ROC-kurve (receiver operating characteristic), og arealet under kurven (AUC) blev beregnet for at vise den optimale cut-off-værdi for variabler med prædiktiv betydning for GS-opgradering. Vi vurderede sensitiviteten, specificiteten, den positive prædiktive værdi og den negative prædiktive værdi af forskellige cut-off-point foreslået af andre forfattere, anvendte dem på vores population og sammenlignede dem derefter med vores cut-off-værdi. Alle tests var tosidede, og en p-værdi på
Resultater
Ud af i alt 342 patienter i vores database blev 144 (42,1 %) udelukket, fordi de havde en GS ≥4 i prostatabiopsien. Dette efterlod 198 (57.9%) patienter, der opfyldte vores inklusionskriterier på GS 6 (3+3). 73 af disse patienter blev ekskluderet på grund af ufuldstændige kliniske oplysninger fra journalerne.
Den gennemsnitlige patientalder var 65,1±6,3 år, body mass index (BMI) var 26,7±3,6kg/m2, antallet af udtagne kerner var 13,4±3,5, antallet af positive kerner var 2,5±2, og præoperativ PSAD var 0,26±0,23ng/ml2. Den præoperative median PSA var 7,2 IQR 5,67-10,05 og PV var 38 IQR 26,5-55,5. Klinisk stadium baseret på digital rektalundersøgelse var T1c hos 86 (69,6 %) patienter, T2a hos 28 (22,4 %), T2b hos 7 (5,6 %), T2c hos 2 (1,6 %) og T3 hos én (0,8 %) patient.
Preoperativt PSA blev kategoriseret som følger: 6 (4,8 %) patienter havde PSA-værdier
ng/ml, 88 (70,4 %) var mellem 4 og 9,9ng/ml, 23 (18,4 %) var mellem 10 og 19,9ng/ml, og 8 (6,4 %) havde PSA ≥20ng/ml. Biopsi GS og kirurgisk GS forblev den samme hos 71 (56,8 %) patienter med GS 3+3, mens 54 (43,2 %) patienter havde en opgradering. Af de patienter med opgradering steg 70 % til en GS på 7 og 30 % steg til ≥8.
Tabel 1 viser de demografiske og kliniske karakteristika for patienter med og uden GS-opgradering. Vi fandt en statistisk signifikant korrelation mellem postoperativ opgradering og den præoperative PSAD-værdi (p0,001), præoperativ PSA (p=0,039), PV (p=0,004) og patientens alder ≥70 år (p=0,004).011).
Karakteristika for patienter med og uden opgradering af Gleason-score efter radikal prostatektomi.
| Karakteristika | Opgradering | Ingen opgradering | p-Value | |
|---|---|---|---|---|
| Nej. af patienter (%) | 54 (43,2 %) | 71 (56.8 %) | ||
| Alder (år) | ||||
| Middel±SD | 66.22±6,5 | 64,28±6,0 | 0,092b | |
| Age (no.) | ||||
| >70 år | 20 | 12 | 0.011*,a | |
| 34 | 59 | |||
| BMI (kg/m2) | ||||
| Middel ±SD | 26.22±4,0 | 27,14±3,1 | 0,178c | |
| PSA (ng/ml) | ||||
| Median/IQR | 8/6,5-12.6 | 6,8/5,4-9 | 0,039*,c | |
| Prostatavolumen (ml) | ||||
| Median/IQR | 30.6/22.5-43.5 | 46/32.2-63.7 | 0.007*,c | |
| PSAD (ng/ml2) | ||||
| Middel ± SD | .36±.27 | .19±.16 | *,c | |
| Biopsi kerner (nr.) | ||||
| Middel ± SD | 12,9±3,4 | 13,7±3,7 | 0.240c | |
| Positive kerner (nr.) | ||||
| Middel ± SD | 2.9±2,4 | 2,1±1,6 | 0,0702c | |
| Obesity (no.) | ||||
| Positiv | 9 (16,6 %) | 9 (16,6 %) | 16 (22,5 %) | 0.500a |
| Negativ | 45 (83,4%) | 55 (77.5%) | ||
| DM (nr.) | ||||
| Positiv | 16 (29,6%) | 14 (19.7%) | 0.150a | |
| Negativ | 38 (70,4%) | 57 (80.3%) | ||
| HBP (nr.) | ||||
| Positivt | 21 (38.9 %) | 30 (42,2 %) | 0,775a | |
| Negativ | 33 (61,1 %) | 41 (57.8 %) | ||
IQR: interkvartilområde; BMI: kropsmasseindeks; PSA: prostataspecifikt antigen; PSAD: prostataspecifik antigentæthed; DM: diabetes mellitus; HBP: forhøjet blodtryk.
X2-test.
Student’s t-t-test.
Mediantest.
Statistisk signifikant med en p-værdi
Vi estimerede et optimalt PSAD-cut-offpunkt på 0.17ng/ml2 ved hjælp af ROC-analyse med en AUC på 0,675 (p=0,001, 95%CI .580-.770), og analyserede derefter de grænseværdier, der er foreslået af andre forfattere, og sammenlignede dem. Tabel 2 og Fig. 1 viser disse resultater.
Analyse af forskellige cutoff-værdier af PSAD som en prædiktor for GS-opgradering.
| opgradering | ingen opgradering | ingen opgradering | p | Odds ratio | Sens % | Spec % | PPV % | NPV % | |
|---|---|---|---|---|---|---|---|---|---|
| PSAD (no.) | |||||||||
| ≥0.13 | 44 (81.5%) | 42 (59.2%) | 0.008*a | 3.03 | 81.5 | 40.8 | 51.1 | 74.3 | |
| 10 (18.5%) | 29 (40.8%) | ||||||||
| PSAD (nr.) | |||||||||
| ≥0.15 | 43 (79.6%) | 35 (49.3%) | 0.001*a | 4.02 | 79.6 | 50.7 | 55.1 | 76.5 | |
| 11 (20.4%) | 36 (50.7%) | ||||||||
| PSAD (nr.) | |||||||||
| ≥0.17* | 41 (75.9%) | 29 (40.8%) | a | 4.56 | 75.9 | 59.2 | 58.5 | 76.3 | |
| 13 (24.1%) | 42 (59.2%) | ||||||||
| PSAD (nr.) | |||||||||
| ≥0.23 | 36 (66.6%) | 22 (31%) | a | 4.4 | 66.7 | 69 | 62 | 73.1 | |
| 18 (33.4%) | 49 (69%) | ||||||||
PSAD: prostataspecifikt antigen.
X2-test.
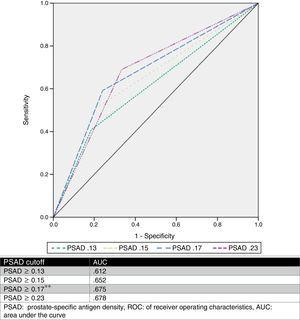
ROC-kurve.
Tabel 3 viser resultaterne fra den univariate regression for påvisning af uafhængige prædiktorer for opgradering.
Uafhængige prædiktorer for opgradering (univariat regression).
| Karakteristika | HR | 95 CI | p-værdi | |
|---|---|---|---|---|
| Alder | 0.5 | 0,99-1,11 | 0,09 | |
| >70 år | 1.06 | 1.26-6.63 | 0.039* | |
| BMI | 0.072 | 0.97-1.18 | 0.166 | |
| PSAD ≥0.13 | 1.11 | 1.32-6.99 | 0.99 | 0.009* |
| PSAD ≥0,15 | 1,39 | 1,79-9,03 | 0,009* | 0,009* |
| .001* | ||||
| PSAD ≥0,17 | 1,51 | 2,98-9,99 | ||
| PSAD ≥0.23 | 1,49 | 2,08-9,49 | ||
| PSA | 0,05 | 0,99-1,11 | 0,059 | |
| Prostatavolumen | 0.02 | 1,01-1,04 | 0,008* | |
| Positive biopsikerner | 0.06 | 0,98-1,18 | 0,24 | |
| Overvægt | 0,31 | 0,31 | 0.54-3.40 | 0.507 |
| DM | 0.61 | 0.79-4.27 | 0.152 | |
| HBP | 0.10 | 0.53-2.29 | 0.29 | 0.775 |
BMI: kropsmasseindeks; PSA: prostataspecifikt antigen; PSAD: prostataspecifik antigentæthed; DM: diabetes mellitus; HBP: højt blodtryk.
Diskussion
Flere undersøgelser har fundet en manglende overensstemmelse mellem GS-rapporten fra prostatabiopsien og rapporten fra den radikale prostatektomi. I en nyere metaanalyse, der omfattede 14 839 patienter, vurderede forfatterne en GS-opgradering hos 30 % af patienterne, mens kun 63 % forblev uændret efter prostatektomi22 . Gleason-opgradering er fundet i 29-58 % af tilfældene,23 og er værre i undergruppen af patienter med en biopsi GS 3+3 (op til 63,3 %).14 I vores hospitalscenter fandt vi en GS-opgradering hos 42,1 % af alle patienter, der gennemgik radikal prostatektomi, og hos 43,2 % af patienterne med en biopsi Gleason-score på 3+3.
Mange forfattere har forsøgt at finde prædiktorer for GS-opgradering, især med den i øjeblikket stigende popularitet af AS-protokollerne. Tidligere beskrevne prædiktorer er alder >60 år, PSA-værdi >5,0ng/ml og >25% positive kerner under biopsien.24
PSAD er blevet analyseret, og flere cut-off-værdier er blevet beskrevet (såsom ≥0,13ng/ml, ≥0,15ng/ml og ≥0,23ng/ml).11,13,16,17 Ikke desto mindre er der ingen konsensus om brugen af denne værdi til nøjagtigt at forudsige en GS-opgradering. På baggrund af vores resultater foreslog vi en cut-off-værdi på ≥0,17ng/ml, som havde en AUC på 0,675, en sensitivitet på 75,9 %, en specificitet på 59,2 %, en PPV på 58,5 % og en NPV på 76,3 % til forudsigelse af GS-opgradering. Vi valgte dette cut-off point, fordi der ved analyse af andre foreslåede værdier i forhold til vores case-serie blev den bedste AUC opnået med en værdi ≥0,23ng/ml (0,678), men den havde en dårligere sensitivitet og en høj falsk negativ rate (33,33 %). På den anden side, når vi brugte værdierne ≥0,13ng/ml og ≥0,15ng/ml, havde de en falsk positiv rate på henholdsvis 59 % og 49 %. Den falsk negative rate og falsk positive rate for den grænseværdi, der blev foreslået af vores hold, var henholdsvis 24 % og 41 %, som vi anså for at være den mest anvendelige. Fig. 2 viser en graf over vores population.

Undersøgelsespopulationen, der viser de forskellige prostataspecifikke antigentætheder og opgraderingsdata.
Vores undersøgelse omfattede kun patienter med en biopsi GS på 3+3, på grund af betydningen af denne variabel, når man overvejer en patient til AS. Da der er andre faktorer, der tages i betragtning ved aktiv overvågning, kan vi ikke erklære, at risikoen for opgradering af GS og PSAD er afgørende variabler for at foreslå en terapeutisk strategi, men vi mener bestemt, at de bør diskuteres, før der træffes en beslutning. En anden biopsi kunne være indiceret for patienter med en PSAD ≥0,17ng/ml, i betragtning af risikoen for underklassificering, med henblik på at bekræfte GS. Prostata-MRI og MRI-vejledte fusionsbiopsier har vist høj sensitivitet og specificitet med hensyn til at lokalisere uidentificeret signifikant kræft25 . Disse muligheder er dog ikke bredt tilgængelige i Mexico, så transrektal ultralydsvejledt mætningsbiopsi eller skabelonbiopsi kunne være en mere levedygtig mulighed for at øge den diagnostiske nøjagtighed.
Nyere dokumentation har antydet en sammenhæng mellem de forskellige komponenter af metabolisk syndrom og prostatacancer, hvilket øger risikoen for at præsentere sygdommen og dø af den,21 samt en højere risiko for biokemisk recidiv efter radikal behandling.22 I vores undersøgelse kunne vi imidlertid ikke påvise en sammenhæng med Gleason-scoreopgradering.
Prostatavolumen, som er direkte relateret til alder, kunne være et distraherende element. Når en tilfældig ultralydsvejledt biopsi udføres i en stor prostata, er der en potentiel risiko for at efterlade større underprøvetagede områder, hvilket udgør en større risiko for at overse en betydelig tumor.
AS har givet lovende resultater hos patienter med lavrisikoprostatacancer, med forbedringer i livskvalitet, bevarelse af erektil funktion og urinkontinens og i andre komplikationer forbundet med radikal behandling.6 Der er dog en risiko for fejldiagnosticering af en aggressiv kræft og forsinkelse af hensigtsmæssig behandling, hvilket påvirker patientens prognose. Der findes mange kriterier til udvælgelse af AS-kandidater, og D’Amico-risikoklassifikationen26 og Epstein-kriterierne27 er de mest udbredte til dette formål. Førstnævnte omfatter ikke PSAD, men i Epstein-kriterierne foreslås det at anvende en grænseværdi ≥0,15ng/ml. På vores hospital anvender vi meget strenge kriterier, og PSAD-cut-off-værdien ≥0,17ng/ml vil indgå som en del af diskussionen, når vi udvælger en mulig kandidat til AS.
Den retrospektive karakter af vores undersøgelse var dens vigtigste begrænsning. Den potentielle stikprøve blev reduceret yderligere på grund af ufuldstændige data i de kliniske journaler. En anden begrænsning var det faktum, at vi ikke havde alle data fra biopsiprøverne, så vi kunne ikke analysere patienter med de fulde AS-kriterier. Men med det antal patienter, der indgik i undersøgelsen, blev der opnået signifikante resultater, og disse kan bruges til at overveje risikoen for GS-opgradering hos patienter med GS 3+3.
Konklusioner
Vi konkluderer, at det er vigtigt at bruge så mange værktøjer som muligt for at træffe præcise beslutninger og identificere de patienter med høj risiko for patologisk opgradering, som kan drage fordel af en mere omhyggelig evaluering og/eller aggressiv behandling. PSAD bør anvendes rutinemæssigt til at identificere patienter med tilsyneladende lavrisikokræft med risiko for GS-opgradering, hvilket resulterer i en mere præcis udvælgelse af kandidater til AS. Ifølge vores data kan vi undgå en potentielt ukorrekt GS-stagning i ca. 43 % af tilfældene.
Vi fandt en høj frekvens af GS-opgradering i vores population. I vores undersøgelse var PSAD-værdierne signifikant forbundet med opgradering, og den mest præcise cut-off-værdi var 0,17ng/ml2. Vi anbefaler, at der foretages en lokal gennemgang af GS-opgraderingsrisiko og dens potentielle prædiktorer på alle hospitalscentre, før man tilbyder aktiv overvågning til potentielle kandidater.
Etiske oplysningerBeskyttelse af mennesker og dyr
Forfatterne erklærer, at der ikke blev udført forsøg på mennesker eller dyr i forbindelse med denne undersøgelse.
Fortrolighed af data
Forfatterne erklærer, at der ikke optræder patientdata i denne artikel.
Ret til privatlivets fred og informeret samtykke
Forfatterne erklærer, at der ikke er nogen patientdata i denne artikel.
Funding
Der blev ikke modtaget nogen form for støtte til at gennemføre denne artikel.
Interessekonflikter
Forfatterne erklærer, at de ikke har nogen interessekonflikter, og at de ikke har modtaget nogen form for sponsorering til undersøgelsen.